4种紫珠属药用植物RAPD多态性分析
2015-04-26杨先国谷陟欣刘克明
杨先国,谷陟欣,卢 捷,刘克明,黄 胜
(1.湖南中医药高等专科学校,湖南 株洲 412012;2.九芝堂股份有限公司,湖南 长沙 410021; 3.湖南师范大学 生命科学学院,湖南 长沙 410081)
4种紫珠属药用植物RAPD多态性分析
杨先国1,谷陟欣2,卢 捷2,刘克明3,黄 胜2
(1.湖南中医药高等专科学校,湖南 株洲 412012;2.九芝堂股份有限公司,湖南 长沙 410021; 3.湖南师范大学 生命科学学院,湖南 长沙 410081)
目的:运用随机扩增多态性技术探索4种紫珠属药用植物的遗传多态性,为其种质鉴定提供依据。 方法:采用试剂盒提取法提取裸花紫珠、广东紫珠、大叶紫珠与杜虹花4种新鲜植物叶中的总DNA,采用经过筛选的20条随机引物进行PCR扩增。结果:试剂盒可有效获取4种紫珠植物的总DNA,扩增得到条带共152条,多态性条带137条,多态率达到88.2%;聚类分析结果表明,4种紫珠供试材料共分为3类。结论:4种紫珠RAPD扩增后的聚类分析结果与植物形态学观察分类结果相一致,所得RAPD标记可用于紫珠属药用植物的多态性研究,为开发遗传鉴定的分子标记奠定基础。
紫珠属;基因组DNA;RAPD;多态性;聚类分析
紫珠属植物(CallicarpaLinn)来源于马鞭草科,我国紫珠属植物有46种,主要分布于长江以南的广大地区,如海南、广东、广西、云南、贵州、湖南、江西、福建等地。其中约有30多种可以作为药用,入药部位为茎叶或全株,其性平、味苦,归肝、脾、肺经,具有活血止血、清热解毒等功效,主要用于治疗吐血、咳血、便血、崩漏、创伤出血等[1-2]。
紫珠作为一种重要的中药资源,在我国被广泛使用。对我国的中药材地方标准中收载的紫珠品种进行统计可知,我国湖南、广东、广西、江西、云南、河南以及山东7个省区的中药材地方标准收载了近8种紫珠属药用植物,其中以裸花紫珠、广东紫珠、大叶紫珠以及杜虹花为主,现已作为中成药制剂的原料药广泛使用。由紫珠药材制成的中成药品种达20多种,其中裸花紫珠为九芝堂股份有限公司生产的裸花紫珠片的主要原料药[3-4]。但在原料收集过程中,可能有紫珠属的其他药材混入到原料药中,由于紫珠属植物叶及枝均具有止血、解毒等功效,且原植物药材性状极其相似,在市场流通及临床应用过程中难以鉴别,因而常常相互混用。目前文献研究主要集中在生药学鉴定[5-6]、质量标准研究方面[7-11],仍未从分子水平对常用紫珠属药材进行鉴定。本研究采用RAPD分子标记从DNA分子水平对四个紫珠品种展开相关研究,为合理利用紫珠属药用植物资源、从DNA分子水平揭示四种紫珠属药用植物品种的亲缘关系提供科学依据。
1 材料与仪器
1.1 材料
裸花紫珠CallicarpanudifloraHooker & Amott,广东紫珠callicarpakwangtungensisChun,大叶紫珠callicarpamacrophyllaVahl,杜虹花CallicarpaformosanaRolfe,由湖南中医药高等专科学校彭学著教授鉴定为真品。样品来源及分类见表1,每种植物均取嫩叶提取基因组DNA,-20℃保存。
1.2 仪器
DYY-2C电泳仪(北京六一仪器厂),PCR仪MASTERCYCLER(德国Eppendorf),凝胶成像系统Tanon 1600R(上海天能),-80℃超低温冰箱DW-HL538(中科美菱)。
1.3 试剂与引物
广谱性植物总DNA提取试剂盒(HiPure Plant DNA Kits)购自广州Magen(美基)生物公司,2×Taq master Mix购自康为世纪,RAPD引物购自上海生工公司产品(见表2)。其他试剂均为分析纯。

表1 4种紫珠样品来源及分类
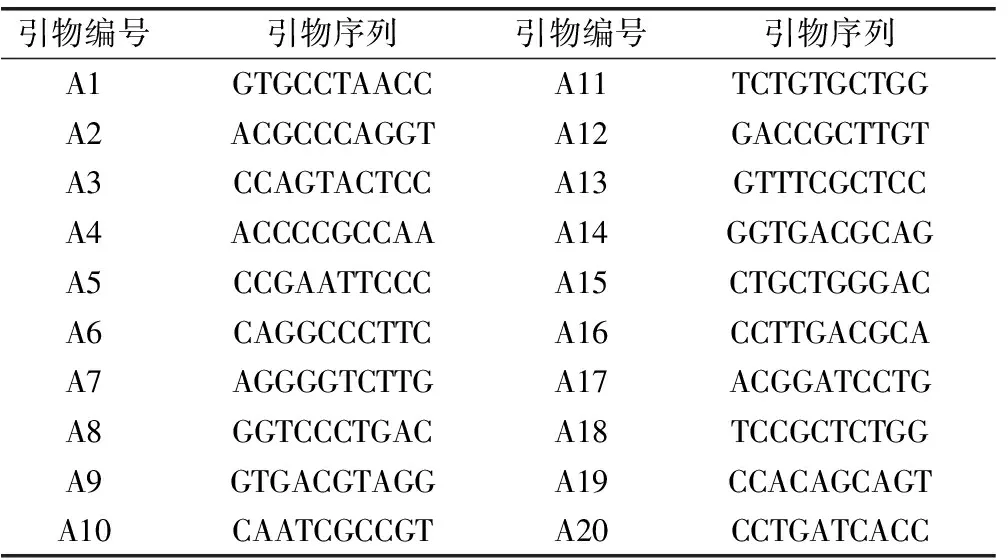
表2 RAPD分析所用引物
2 方法
2.1 紫珠植物组织DNA提取
采用Magen植物总DNA提取试剂盒标示的使用方法进行提取。采用液氮将植物样品研磨成粉末,转移50~100mg 冻藏样品至 2mL离心管中,立即加入 600μL Buffer PTL/2-Me 和 5μL RNase Solution 至样品中,剧烈涡旋使样品充分分散,65°C水浴20min,期间颠倒混匀 2~3次,加入600μL氯仿-异戊醇(24∶1),涡旋混匀30s,室温下12 000xg离心5min,转移上清液至新的离心管中,加入等倍体积 Buffer PBL 至上清液中,涡旋混匀30s,将DNA 柱装在收集管中,转移混合液(<700μL)至柱子中,8 000xg离心30~60s。然后按照使用手册方法进行提取,将提取的 DNA 保存于-20℃下备用。
2.2 PCR扩增及电泳检测
为获得稳定的试验结果,减少实验过程中因操作导致的实验误差,PCR反应体系选择2×Taq master Mix PCR扩增体系,只需在反应体系中加入DNA模板、引物以及去离子水,主要优化对RAPD影响较大的3个反应参数,即PCR反应体系中的DNA模板浓度(1μL、1.5μL、2.0μL、2.5μL、3.0μL)、引物浓度(0.4μL、0.8μL、1.2μL、1.6μL、2.0μL)、体系循环次数(25、30、35、40、45次)。优化结果表明,DNA模板浓度为2.5μL、引物浓度为2.0μL、循环40次为最佳反应条件。
PCR扩增反应程序:向紫珠RAPD反应的50μL反应体系中加入模板DNA 2.5μL、引物2μL、2×Taq Master Mix 25μL以及去离子水20.5μL。PCR扩增程序为94℃预变性5min,94℃变性30s,36℃退火30s,72℃延伸30s,40次循环,72℃后延伸7min,4℃保存。取扩增产物5μL,在1.5%琼脂糖凝胶上恒压(110V)电泳60min,凝胶中含0.5μg/mL溴化乙锭(EB),采用凝胶成像系统照相。
2.3 数据分析
对扩增后电泳带总数及多态性条带数进行统计。将电泳图谱中的每一条带(DNA片段)作为一个分子标记,并在模板上有一个结合位点,不同的样本在凝胶上泳动距离相同则表明其有相同的位点。根据各分子标记的有无得到所有位点的二元数据,有带记为“1”(强带和弱带同记),无带记为“0”,采用SPSS17.0软件进行聚类分析。
3 结果与分析
3.1 基因组DNA电泳检测
取4种紫珠基因组DNA提取液10μL,在稳压110V、1.0%琼脂糖凝胶上电泳60min。基因组DNA 电泳检测结果表明(见图1),通过试剂盒提取的紫珠DNA样品整齐一致,条带清晰,没有出现拖尾与扩散现象,纯度较高,因而可以满足RAPD扩增试验的要求。

图1 4种紫珠基因组DNA电泳谱
3.2 RAPD标记多态性分析
20条RAPD引物对4种紫珠属植物样本进行扩增得到的条带的相对分子量主要集中在300~200bp,共扩增得到条带152条,其中多态性条带共137条,多态率达88.2%,平均每条引物产生7.6个条带与6.8个多态性条带(见表3),4个样品的RAPD扩增结果见图2、图3、图4、图5。

表3 RAPD分析所用引物序列及扩增结果 (n)
3.3 聚类分析
根据扩增条带,采用SPSS17.0软件中的Within-groups linkage方法,根据遗传距离对4个样本进行聚类分析,绘出紫珠样本间的RAPD聚类系统图(见图6)。从图6中可以看出,利用RAPD方法可将4个紫珠样本分为3类,其中杜虹花与广东紫珠的遗传距离最近,可归为一类,大叶紫珠与裸花紫珠各为一类,而大叶紫珠比裸花紫珠在亲缘关系上更靠近广东紫珠与杜虹花。
4 结论
RAPD是建立在PCR基础上的一种可对整个未知序列的基因组进行多态性分析的分子标记技术,该技术具有操作简单、快速,能在短时间内完成对多个样本研究的特点,被广泛应用于药用植物种质资源的遗传多样性研究[12-13]、种质鉴定及评价[14-15]、引种驯化[16]和分类学研究等方面[17]。但由于RAPD-PCR的影响因素较多,重复性与稳定性较差,为提高实验的稳定性与可重复性,本实验采用2×Taq master Mix PCR混合反应体系,该体系中含有Mg2+、dNTP以及Taq酶浓度等均经过优化,适宜各类植物的扩增实验。在体系的优化过程中,仅需要对基因组DNA模板的浓度、引物浓度及循环次数等参数进行优化,实验结果表明,DNA模板浓度为2.5μL、引物浓度为2.0μL、循环40次时,扩增的条带较多,条带较清晰。

图2 裸花紫珠RAPD扩增图

图3 广东紫珠RAPD扩增图

图4 大叶紫珠RAPD扩增图

图5 杜虹花RAPD扩增图

图6 紫珠样品RAPD聚类分析结果
紫珠属植物RAPD分析结果表明,20个引物共检测出152条带,多态性条带共137条,多态率达88.2%。从DNA分子水平来说,样本间遗传距离越大,说明遗传分化越大;聚类分析结果表明,4个紫珠属样本可分为3类,其中杜虹花与广东紫珠的遗传距离最近,大叶紫珠与裸花紫珠各为一类,上述分析结果与紫珠属植物的生药学分类相一致。采用RAPD分子标记研究紫珠属资源之间的遗传多样性和亲缘关系,对于紫珠属药用植物种质资源的遗传育种、合理利用具有重要意义。
[1] 国家药典委员会.中华人民共和国药典[M].第1部.北京:人民卫生出版社,1977:588,621.
[2] 国家药典委员会.中华人民共和国药典[M].第1部.北京:中国医药科技出版社,2010.
[3] 颜冬兰,刘珊珊,宁云山.紫珠属植物化学、药理及临床应用进展[J].中成药,2008,30(9):1361-1363.
[4] 谷陟欣,刘宇婧,颜冬兰.裸花紫珠、大叶紫珠和广东紫珠的研究进展[J].中国医药导报,2011,8(29):11-13.
[5] 杜勤,王振华.六种紫珠叶的生药比较鉴别[J].广州中医药大学学报,2002,19(1):57-59.
[6] 陈伟波.紫珠类药材鉴别[J].中草药,2004,35(8):947-951.
[7] 周国平,谢二磊,盛杰曹,等.HPLC法同时测定江西不同产地广东紫珠药材中连翘酯苷B和金石蚕苷的含量[J].药物分析杂志,2008,28(10):1623-1625.
[8] 张光贤,蔡其辉,田宏现,等.RP-HPLC法测定广东紫珠中熊果酸、齐墩果酸的含量[J].中华医学实践杂志,2007,6(8):721-722.
[9] 周日宝,刘笑蓉,唐丽君,等.RP-HPLC法测定不同采收期广东紫珠、大叶紫珠中木犀草素的含量[J].中国药房,2011,22(23):2167-2168.
[10] 李才堂,文萍,郭琦丽,等.HPLC测定裸花紫珠药材中毛蕊花糖苷的含量[J].中国实验方剂学杂志,2012,18(1):84-86.
[11] 胡蓉,姚闽,李玉云,等.HPLC法测定裸花紫珠药材中木犀草素的含量[J].中药新药与临床药理,2009,20(3): 271-272.
[12] 张聪敏,张治国.青岛百合复合种群遗传多样性的RAPD分析[J].湖北农业科学,2014,53(13):3074-3081.
[13] 赵峰,李碧英,张其文,等.女贞不同种质材料基因组DNA的提取及RAPD引物筛选[J].安徽农业科学,2014,42(1):24-30.
[14] 郭晓丽,白丽荣,高汝勇.衡水湖野生大豆与栽培大豆的RAPD分析[J].种子,2013,32(9):32-34.
[15] 周精华,揭雨成,杜晓华,等.葛种质资源亲缘关系的RAPD分析[J].作物研究,2013,27(4):347-350.
[16] 王利丽,张金鸽,陈随清.密银花栽培变种分类及RAPD研究[J].中药材,2013,36(1):6-9.
[17] 杨欣,于英君.RAPD法构建板蓝根和大青叶基因组DNA指纹图谱[J].中医药信息,2013,30(2):95-98.
(责任编辑:尹晨茹)
Polymorphism of Four Kinds of Medicinal Plants Callicarpa Linn by RAPD
Yang Xianguo1,Gu Zhixin2,Lu Jie2,Liu Keming3,Huang Sheng2
(1.Traditional Chinese Medical College of Hunan,Zhuzhou 412012,China;2.Jiuzhitang Co Ltd,Changsha 410021,China;3.College of Life Science,Hunan Normal University,Changsha 410081,China)
Objective:To research the polymorphism of four kinds of medicinal plants Callicarpa linn by random amplified polymorphic DNA(RAPD)analysis and provide a basis for germplasm identification.Methods:The extraction kit was used to extract the genomic DNA of several plants,including 3 regions of Callicarpa nudiflora Hooker﹠Amott,callicarpa kwangtungensis Chun,callicarpa macrophylla Vahl and Callicarpa formosana Rolfe,then amplified by 20 selected random primers.Results:Extraction kit Was effeetive for 4 Callicarpa linn species genome DNA.With the DNA extracted from several plants as template,20 primers amplified a total of 152 bands,137 bands were polymorphic,polymorphism rate was 88.2%,and the effect amplification was good.The dendogram reflected that 4 samples clustered into three taxa.Conclusion:This result is in accordance with their morphological observed.RAPD markers can be used to analyze polymorphisms of medicinal plants Callicarpa linn,and provide the genetic basis for identification.
Callicarpa Linn;Genomic DNA;RAPD;Polymorphism;Clustering Analysis
2014-11-03
杨先国(1977-),男,湖南中医药高等专科学校讲师,研究方向为中药质量与中药资源。
R282.6
A
1673-2197(2015)07-0028-04
10.11954/ytctyy.201507014
