咪唑克生对体外血脑屏障炎症模型通透性的影响*
2015-04-17王新施朱振国夏念格郑荣远
王新施, 朱 攀, 朱振国, 夏念格, 李 佳, 郑荣远
(温州医科大学附属第一医院神经内科,浙江 温州 325000)
咪唑克生对体外血脑屏障炎症模型通透性的影响*
王新施, 朱 攀, 朱振国, 夏念格, 李 佳, 郑荣远△
(温州医科大学附属第一医院神经内科,浙江 温州 325000)
目的: 观察咪唑克生(idazoxan,IDA)对体外血脑屏障(blood-brain barrier, BBB)炎症模型的通透性、紧密连接蛋白ZO-1表达和分布及基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)和MMP-9抑制物——金属蛋白酶组织抑制物-1(tissue inhibitor of metalloproteinase-1, TIMP-1)表达的影响。 方法: 采用培养7 d的小鼠脑微血管内皮细胞株 b.End3建立体外BBB模型,采用TNF-α(10 nmol/L)处理24 h诱导BBB炎症模型,并对BBB炎症模型分别采用IDA 50、100、200 μmol/L预处理6 h以观察IDA对BBB炎症模型的作用。通过检测异硫氰酸荧光标记的葡聚糖通过率来确立模型的通透性,采用Western blot法检测紧密连接蛋白ZO-1的表达,通过免疫荧光法观察ZO-1的分布情况,并通过RT-PCR法检测MMP-9/TIMP-1的表达。结果: 培养7 d的b.End3细胞汇合成稳定的单层连接,有较好的屏障功能,而采用TNF-α处理24 h后诱导的BBB炎症模型的通透性明显升高,紧密连接蛋白ZO-1在膜上的表达明显减少、不连续,Western blot法显示ZO-1蛋白表达水平明显下降,MMP-9的表达明显升高;而采用IDA 50、100、200 μmol/L预处理6 h能明显降低其通透性,增加ZO-1蛋白的表达和改善ZO-1的分布异常,降低MMP-9的表达,其中200 μmol/L IDA作用最明显,差异有统计学意义(P<0.01)。结论: IDA能够直接作用于脑血管内皮细胞,降低TNF-α诱导的体外BBB炎症模型MMP-9的表达,增加紧密连接蛋白ZO-1的表达、修复紧密连接ZO-1的异常分布,从而改善其异常增高的通透性。
咪唑克生; 血脑屏障; 紧密连接; ZO-1; 基质金属蛋白酶-9; 组织型基质金属蛋白酶抑制物-1
血脑屏障(blood-brain barrier,BBB)功能失调是多发性硬化(multiple sclerosis, MS)及其动物模型实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)的一个重要病理途径。研究发现,在EAE发病时及MS临床复发时都存在BBB功能失调,BBB通透性增加,导致外周炎症细胞和炎症因子向中枢迁移,是EAE发病的一个重要环节,BBB的通透性与EAE的严重程度呈正相关[1]。但EAE/MS中BBB破坏的机制仍不明确。研究发现EAE/MS中BBB破坏的机制可能与基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)活性增高或MMP-9抑制物——金属蛋白酶组织抑制物-1(tissue inhibitors of metalloproteinase-1, TIMP-1)的平衡失调及BBB紧密连接蛋白-1(zonula occludens proteins-1,ZO-1)的表达异常等有关[2-4]。我们在前期的研究工作中已发现咪唑啉2受体(imidazoline 2 receptor,I2R)的配体咪唑克生(idazoxan,IDA)能增加BBB紧密连接蛋白ZO-1的表达,降低MMP-9的表达,降低EAE炎症时异常增高的BBB通透性,从而减轻小鼠EAE时的BBB破坏、抑制中枢炎症反应并减缓小鼠EAE的病情[5-6]。但IDA对EAE的保护作用是否直接继发于其对BBB的保护作用仍未知,IDA在体外对脑血管内皮细胞的直接作用目前国内外尚未见报道。故本课题拟采用小鼠脑微血管内皮细胞b.End3单层细胞培养建立体外BBB模型,并采用MS/EAE发病起关键作用的炎症细胞因子TNF-α诱导BBB炎症模型,以模拟EAE时的BBB破坏,观察IDA干预对体外BBB炎症模型的通透性、紧密连接蛋白ZO-1表达和分布及MMP-9/TIMP-1表达的影响来探讨IDA对BBB的直接作用及相关的分子机制。
材 料 和 方 法
1 材料
小鼠脑微血管内皮细胞株 b.End 3购自ATCC;Transwell培养板 (0.4 μm孔径,24孔板) 购自Corning;DMEM培养基、RPMI-1640购自HyClone;胎牛血清购自Gibco;PBS、0.25%胰蛋白酶、结晶紫购自基尔顿生物科技(上海)有限公司;羊抗兔FITC标记 II 抗、羊抗鼠Alexa flour 555标记 II 抗购自碧云天生物科技有限公司;ZO-1抗体购自Santa Cruz;MMP-9抗体购自Abcam;TRIzol购自Invitrogen; RT-PCR 试剂盒购自TaKaRa;MMP-9、 TIMP-1、GAPDH 引物由宝生物工程有限公司合成;异硫氰酸荧光标记的葡聚糖(fluorescein isothiocyanate-conjugated dextran,FD-40)购自 Sigma;其余生化试剂均为进口分装或国产分析纯试剂。
2 实验方法
2.1 b.End3细胞培养 将b.End3细胞接种于明胶包被的玻片或24孔板的Transwell培养板内培养,培养基为DMEM培养基加入10%胎牛血清、4.5 g/L葡萄糖、1×105U/L青霉素和100 mg/L链霉素、2 mmol/L 谷氨酰胺,在5% CO2、37 ℃培养箱中培养,2~4 d传代 1 次,倒置相差显微镜下每日观察细胞形态变化。
2.2 模型分组 在培养的第7天细胞已汇合成稳定的单层连接后,按照干预因素不同将模型分为:① 空白对照(control)组:不加任何干预的单层b.End3细胞构成的正常体外BBB模型;② TNF-α组:采用TNF-α(10 nmol/L)处理24 h诱导的BBB炎症模型;③ IDA50+TNF-α组:采用IDA 50 μmol/L预处理6 h后,再采用TNF-α (10 nmol/L)处理24 h诱导BBB炎症模型;④ IDA100+TNF-α组:采用IDA 100 μmol/L预处理6 h后,再采用TNF-α(10 nmol/L)处理24 h诱导BBB炎症模型;⑤ IDA200+TNF-α组:采用IDA 200 μmol/L预处理6 h后,再采用TNF-α (10 nmol/L)干预24 h诱导BBB炎症模型。
2.3 模型通透性检测 每次以1×107/L的密度将b.End3细胞悬液约0.3 mL接种于24孔板Transwell培养板内池,并于培养板外池加入培养基1.2 mL,保证培养板内外池两侧液面相等,倒置相差显微镜下每日观察细胞形态变化。利用FD-40通过率检测培养第7天已汇合成单层稳定连接的细胞层的通透性。FD-40加入膜上层,终浓度为0.1 mg/L。30 min后,收集基底膜上的细胞样品。利用荧光酶标仪检测样品的荧光强度,激发波长490 nm,发射波长520 nm。以上实验均做3复孔。
2.4 Western blot法检测ZO-1的表达 取各组培养7 d的b.End3细胞提取总蛋白,定量后-70 ℃保存。取50 μg总蛋白样品,8 % SDS-PAGE分离蛋白,4 ℃湿转至PDVF膜上,封闭过夜。加入稀释的 I 抗ZO-1(1∶1 000)和内参照β-actin(1∶500),室温下结合 2 h。TBST洗膜10 min×4次,然后加入稀释的 II 抗(1∶1 000),室温下结合 2 h,再以TBST 洗膜10 min×4次。将膜置于KCTM 化学发光试剂盒中室温孵育3 min,以X 光胶片曝光成像后用Image J 图像分析软件分析各条带的平均灰度值。
2.5 免疫荧光法检测ZO-1的表达 将明胶包被过的盖玻片置于24孔板中,长成单层的细胞用0.25%胰蛋白酶消化、计数,稀释为5×108/L,接种于盖玻片上,培养至第7 天,取出培养皿,用PBS(pH 7.4)洗2 min×2次;加入4%多聚甲醛室温固定15 min;0.5% Triton X-100透明化后,以5% BSA室温封闭2 h;加ZO-1 I抗(1∶100),4 ℃过夜;PBS洗涤5 min×2次;然后加 II 抗(1∶500),37 ℃孵育1 h; PBS洗涤5 min×2次;加入DAPI(1∶100)37 ℃避光1~2 min,PBS洗3 min×4次,用荧光显微镜观察各组细胞染色结果。
2.6 RT-PCR法检测MMP-9/TIMP-1的mRNA表达 按照TRIzol一步法提取各组细胞总RNA后根据RT-PCR试剂盒说明合成cDNA。MMP-9的PCR引物参考序列号为NM_004994.2,正义链为5’-TCAGGGAGACGCCCATTTC-3’,反义链为5’-ATTGCCGTCCTGGGTGTAG-3’,产物253 bp;TIMP-1引物参考序列为NM_003254.2,正义链为5’-ATTCCGACCTCGTCATCAG-3’,反义链为5’-CATTCCTCACAGCCAACAG-3’,产物340 bp;GAPDH参考序列号为NM_001256799.2,正义链为5’-CATCATCCCTGCCTCTACTG-3’,反义链为5’-TGGGTGTCGCTGTTGAAG-3’,产物258 bp。取正义和反义引物各200 ng和1或2 μL的cDNA按照RT-PCR试剂盒说明组成20 μL的PCR反应体系,PCR反应条件为94 ℃5 min; 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃ 7 min。取PCR产物5 μL用2%的琼脂糖凝胶电泳,用Gel Documentation System(Biosens SC6200)凝胶成像系统和Gel-Pro 3.2分析结果,以目的基因与GAPDH的灰度值之比作为反映目的基因mRNA相对水平的指标。
3 统计学处理
所有数据采用SPSS 16.0软件进行统计学分析,计量资料采用均数±标准差(mean±SD)表示。两组间比较用Student-t检验,多组间比较采用单因素方差分析;计数资料(发病率)的比较则采用χ2检验。以P<0.05 为差异有统计学意义。
结 果
1 细胞培养及通透性的检测结果
倒置显微镜下观察培养7 d的b.End3细胞,可见细胞呈长梭形或三角形,细胞排列紧密,单层生长,互不重叠,汇合成片呈铺路卵石样结构,具有良好的屏障功能。培养第7天,细胞层对FD-40的通透率较培养第1天的细胞样品和空白对照(未接种细胞)明显下降,标志着BBB体外模型的成功制备,见图1。

Figure 1.The incubation of b.End3 cells and measurement of permeability. Mean±SD.n=3.**P<0.01vs7 d.
图1 b.End3细胞培养情况和通透性检测
2 TNF-α和IDA干预后的各组通透性检测结果
采用TNF-α(10 nmol/L)处理24 h后诱导的BBB炎症模型的通透性明显升高,提示BBB炎症模型的成功制备。采用IDA 50、100、200 μmol/L预处理6 h后,再采用TNF-α(10 nmol/L)处理24 h诱导BBB炎症模型时,发现各IDA预处理组模型的通透性均明显下降,尤其以200 μmol/L作用更明显,差异具有统计学意义,提示IDA对炎症导致的BBB破坏、通透性升高具有明显的改善作用,见图2。

Figure 2.The permeability of FD-40 in different groups. Mean±SD.n=3.**P<0.01vsTNF-α group.
图2 各组模型对FD-40的通透性检测
3 ZO-1的 Western blot检测结果
空白对照组可检测到较稳定的BBB紧密连接蛋白ZO-1的表达,采用TNF-α(10 nmol/L)处理24 h后诱导的BBB炎症模型ZO-1的表达明显减少。采用IDA 50、100 μmol/L预处理后再以TNF-α诱导BBB炎症模型的IDA50+TNF-α组及IDA100+TNF-α组ZO-1蛋白的表达呈增加趋势,但无统计学意义。而采用IDA 200 μmol/L预处理后再以TNF-α诱导BBB炎症模型的IDA200+TNF-α组ZO-1的表达明显增加,差异有统计学意义(P<0.05),提示IDA预处理能上调BBB炎症模型的紧密连接蛋白ZO-1的表达,见图3。

Figure 3.The protein expression of ZO-1 detected by Western blot. Mean±SD.n=3.*P<0.05vsTNF-α group.
图3 ZO-1 蛋白的Western blot检测结果
4 ZO-1的免疫荧光检测结果
空白对照组可见BBB紧密连接蛋白ZO-1主要分布在细胞膜上、表达连续,采用TNF-α(10 nmol/L)

Figure 4.The distribution of ZO-1 in each groups detected by immunofluorescence (×400).
图4 ZO-1免疫荧光法检测结果
处理24 后诱导的BBB炎症模型ZO-1在膜上的表达明显减少、变得不连续,并进入细胞浆内。IDA50+TNF-α组及IDA100+TNF-α组ZO-1蛋白的分布无明显变化。而IDA200+TNF-α组中,ZO-1在膜上的表达增加、分布明显趋向连续,提示IDA 200 μmol/L预处理能改善TNF-α诱导的BBB炎症模型紧密连接蛋白ZO-1的异常分布,见图4。
5 MMP-9/TIMP-1的RT-PCR检测结果
空白对照组可检测到较低水平的MMP-9的表达,采用TNF-α(10 nmol/L)处理24 h后诱导的BBB炎症模型MMP-9的表达明显增加,而TIMP-1的表达明显降低(P<0.01)。IDA50+TNF-α组MMP-9的mRNA表达呈减少趋势,但无明显统计学意义。而IDA100+TNF-α及IDA200+TNF-α组MMP-9的表达明显减少,差异有统计学意义(P<0.01),而IDA各处理组的TIMP-1的表达均无明显变化,提示IDA预处理能下调BBB炎症模型的MMP-9的表达,但对TIMP-1的表达无明显影响,见图5、表1。
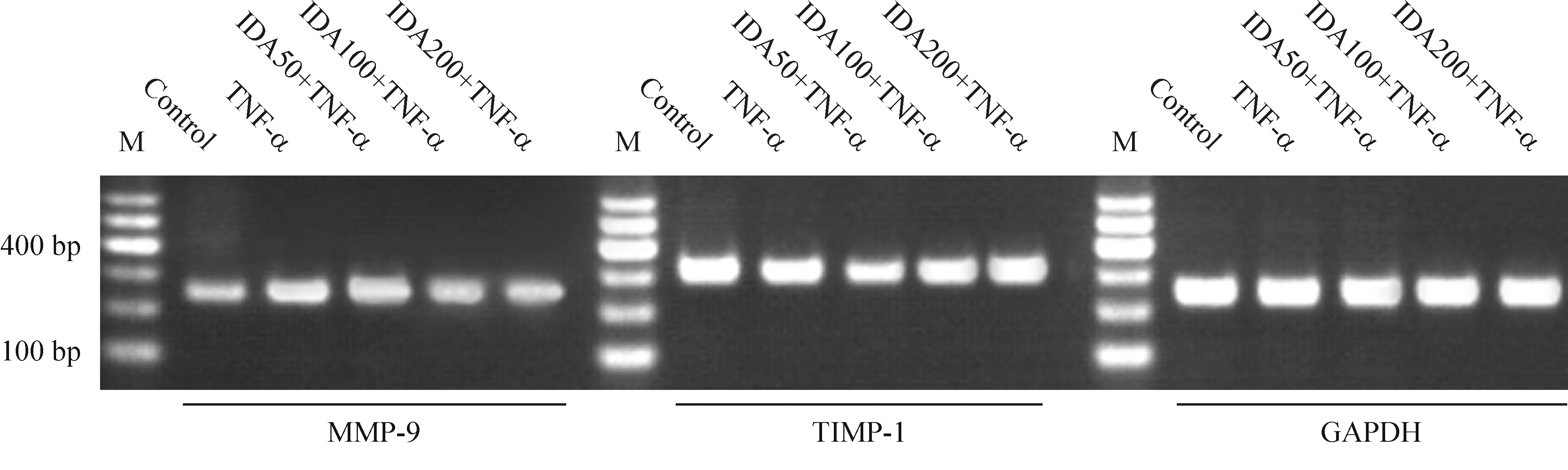
Figure 5.The mRNA expression of ZO-1 detected by RT-PCR.M:marker.
图5 MMP-9/TIMP-1半定量RT-PCR检测结果
表1 各组MMP-9/TIMP-1的RT-PCR检测结果
Table 1.The mRNA expression of MMP-9/TIMP-1 (Mean±SD.n=3)

GroupMMP-9/GAPDHTIMP-1/GAPDHControl0.46±0.03**0.92±0.03**TNF-α0.80±0.020.81±0.02IDA50+TNF-α0.76±0.030.82±0.03IDA100+TNF-α0.68±0.03**0.83±0.03IDA200+TNF-α0.55±0.03**0.84±0.02
**P<0.01vsTNF-α group.
讨 论
BBB主要由血管内皮细胞、基膜、胶质细胞组成,胶质细胞可以通过终足与内皮细胞相联系。其中,内皮细胞间的紧密连接是BBB机能与结构的主要基础[7]。紧密连接位于连接复合体最顶端的组成部分,是由跨膜蛋白包括咬合蛋白(occludin)、闭合蛋白(claudins)、连接黏附分子(junctional adhesion molecules,JAMs)、ZOs以及细胞骨架蛋白(主要是微丝蛋白actin)等共同组成的。电镜下可见到相邻细胞两层质膜紧紧靠在一起形成紧密连接,细胞-细胞膜的连接无空隙,如同焊条,发挥着屏障作用。BBB功能失调是MS/EAE的一个重要病理途径,研究发现,在EAE发病时及MS临床复发时都存在BBB功能失调,BBB通透性增加导致外周炎症细胞和炎症因子向中枢迁移是EAE/MS发病的一个重要环节,BBB的通透性与EAE的严重程度呈正相关[1]。但EAE/MS中BBB破坏的机制仍不明确。研究发现EAE/MS中BBB破坏的机制可能与紧密连接的异常如脑微血管内皮细胞膜上ZO-1的表达减少、Claudin-5的缺失或者下调等密切相关[2-4]。EAE/MS时,中枢的炎症因子如TNF-α等能诱发MMP-9的产生[8], MMP-9作为最重要的降解BBB的酶,不但能降解基底膜,也能降解BBB紧密连接蛋白ZO-1,导致BBB开放,炎症细胞和炎症因子进入CNS诱发MS/EAE[9]。在MS/EAE活动期,MMP-9浓度升高,或者MMP-9与其抑制物TIMP-1的平衡失调导致MMP-9活性明显增加,被认为是MS/EAE的一个重要活动性标志[10]。并且,研究发现无论是作为MS急性期主要治疗药物的糖皮质激素(glucocorticoid,GC)还是作为MS慢性期主要治疗药物的IFN-β都能下调MMP-9的表达或上调TIMP-1的表达,并无法调节体外BBB 模型的脑血管内皮细胞紧密连接蛋白的表达来降低BBB通透性[11-14]。综上所述,通过调节MMP-9的表达、脑血管内皮细胞间的紧密连接蛋白的表达降低BBB通透性可能是MS/EAE的重要治疗靶点。
我们在前期的研究工作中已发现咪唑2受体配体IDA具有减缓大鼠EAE发病的作用[15-16],然而该保护作用的机制不甚清楚。而我们在体外实验中已发现,咪唑克生具有拮抗NMDA受体介导的钙离子内流、降低谷氨酸兴奋毒性的作用[17]。而已有研究发现NMDA受体拮抗剂在动物实验有改善BBB通透性、减缓EAE发病的作用[18],在体外实验中能调节紧密连接蛋白ZO-1 和 occludin的分泌、提高BBB体外模型的屏障功能[19]。因此,我们推断具有NMDA受体拮抗作用的IDA也可能具有调节紧密连接相关蛋白的表达从而调控BBB通透性的作用。在以上的理论假设的基础上,我们在近期的在体实验研究中已经观察到,给予IDA 2 mg/kg(腹腔注射、2次/d、共15 d)进行干预后,能明显降低EAE炎症时异常增高的BBB通透性,增加BBB紧密连接蛋白ZO-1的表达,降低MMP-9的表达,从而减轻小鼠EAE时的BBB破坏,抑制中枢炎症反应,减缓小鼠EAE的病情[5-6]。为了进一步验证IDA对EAE的保护作用是否直接继发于其对BBB的保护作用,本实验通过体外实验观察IDA对体外BBB炎症模型通透性的直接影响,并通过Western blot法定量检测紧密连接蛋白ZO-1的蛋白表达量、采用免疫荧光法观察ZO-1的分布情况并通过RT-PCR法检测MMP-9/TIMP-1的表达来探讨IDA对BBB的直接作用。为了与小鼠动物实验统一,我们参考国内外文献采用了小鼠脑微血管内皮细胞系b.End3细胞体外培养建立体外BBB模型[20-21],并采用MS/EAE时最重要的炎症细胞因子TNF-α作为炎症刺激因子诱导建立体外BBB炎症模型以模拟MS/EAE时BBB的破坏[22]。与既往这些研究结果一致,本实验显示培养7 d的b.End3细胞具有良好的屏障功能,能较好地阻隔大分子量物质FD-40(分子量40 000 kD)的通过,ZO-1的Western blot及免疫荧光实验显示细胞间能形成稳定、连续的细胞间紧密连接,而RT-PCR结果显示其能分泌少量的MMP-9及TIMP-1。采用炎症因子TNF-α处理后,FD-40的通过率明显增加,提示细胞屏障功能破坏;后续的免疫荧光实验显示紧密连接蛋白ZO-1在膜上的表达明显减少、不连续,Western blot结果显示ZO-1蛋白表达水平明显下降,提示细胞间紧密连接破坏,同时RT-PCR结果提示MMP-9的表达明显升高、TIMP-1表达降低,较好地模拟了EAE时的BBB炎症破坏[1-4, 10]。采用IDA 50、100和200 μmol/L预处理6 h后均能明显改善BBB炎症模型的通透性,且呈现随剂量增加作用加强的趋势,以IDA 200 μmol/L的剂量作用最强;IDA 100和200 μmol/L组的MMP-9均明显降低,而只有IDA 200 μmol/L组能明显增加ZO-1蛋白的表达、改善TNF-α引起的紧密连接破坏、ZO-1的分布异常,提示IDA改善BBB炎症模型通透性的作用可能随剂量增加而增强,其作用机制包括降低MMP-9的表达、增加ZO-1的表达和改善其分布,而具体的剂量效应关系及最合适的体内剂量尚有待进一步的研究探讨。
[1] Holman DW, Klein RS, Ransohoff RM. The blood-brain barrier, chemokines and multiple sclerosis[J]. Biochim Biophys Acta, 2011, 1812(2):220-230.
[2] Errede M, Girolamo F, Ferrara G, et al. Blood-brain barrier alterations in the cerebral cortex in experimental autoimmune encephalomyelitis[J]. J Neuropathol Exp Neurol, 2012, 71(10):840-854.
[3] Bennett J, Basivireddy J, Kollar A, et al. Blood-brain barrier disruption and enhanced vascular permeability in the multiple sclerosis model EAE[J]. J Neuroimmunol, 2010, 229(1-2):180-191.
[4] Leech S, Kirk J, Plumb J, et al. Persistent endothelial abnormalities and blood-brain barrier leak in primary and secondary progressive multiple sclerosis[J]. Neuropathol Appl Neurobiol, 2007, 33(1):86-98.
[5] Wang XS, Fang HL, Chen Y, et al. Idazoxan reduces blood-brain barrier damage during experimental autoimmune encephalomyelitis in mouse[J]. Eur J Pharmacol, 2014, 736:70-76.
[6] 王新施,曾庆意,朱振国,等. 咪唑克生对EAE小鼠血脑屏障通透性及MMP-9/TIMP-1的影响[J]. 中国病理生理杂志, 2014, 30(12):2254-2258.
[7] Liu WY, Wang ZB, Zhang LC, et al. Tight junction in blood-brain barrier: an overview of structure, regulation, and regulator substances[J]. CNS Neurosci Ther, 2012, 18(8):609-615.
[8] 高 颖,蔡定芳. 基质金属蛋白酶-9与炎症反应研究进展[J]. 中国病理生理杂志, 2003, 19(8):126-129.
[9] Muroski ME, Roycik MD, Newcomer RG, et al. Matrix metalloproteinase-9/ gelatinase B is a putative therapeutic target of chronic obstructive pulmonary disease and multiple sclerosis[J]. Curr Pharm Biotechnol, 2008, 9(1):34-46.
[10]Kandagaddala LD, Kang MJ, Chung BC, et al. Expression and activation of matrix metalloproteinase-9 and NADPH oxidase in tissues and plasma of experimental autoimmune encephalomyelitis in mice[J]. Exp Toxicol Pathol, 2012, 64(1-2):109-114.
[11]Förster C, Silwedel C, Golenhofen N, et al. Occludin as direct target for glucocorticoid-induced improvement of blood-brain barrier properties in a murine in vitro system[J]. J Physiol, 2005, 565(Pt 2):475-486.
[12]Harkness KA, Adamson P, Sussman JD, et al. Dexamethasone regulation of matrix metalloproteinase expression in CNS vascular endothelium[J]. Brain, 2000, 123(Pt 4):698-709.
[13]Förster C, Kahles T, Kietz S, et al. Dexamethasone induces the expression of metalloproteinase inhibitor TIMP-1 in the murine cerebral vascular endothelial cell line cEND[J]. J Physiol, 2007, 580(Pt3):937-949.
[14]Kuruganti PA, Hinojoza JR, Eaton MJ, et al. Interferon-beta counteracts inflammatory mediator-induced effects on brain endothelial cell tight junction molecules-implications for multiple sclerosis[J]. J Neuropathol Exp Neurol, 2002, 61(8):710-724.
[15]Wang XS, Chen YY, Shang XF, et al. Idazoxan attenuates spinal cord injury by enhanced astrocytic activation and reduced microglial activation in rat experimental autoimmune encephalomyelitis[J]. Brain Res, 2009, 1253:198-209.
[16]朱振国,黄艳君,王新施,等. 咪唑克生对实验性自身免疫性脑脊髓炎大鼠脊髓GFAP及mRNA表达的影响[J]. 现代实用医学, 2008, 20(12):925-927,931.
[17]Jiang SX, Zheng RY, Zeng JQ, et al. Reversible inhibition of intracellular calcium influx through NMDA receptors by imidazoline I2 receptor antagonists[J]. Eur J Pharmacol, 2009, 629(1-3):12-19.
[18]Paul C, Bolton C. Modulation of blood-brain barrier dysfunction and neurological deficits during acute experimental allergic encephalomyelitis by the N-methyl-D-aspartate receptor antagonist memantine[J]. J Pharmacol Exp Ther, 2002, 302(1):50-57.
[19]Neuhaus W, Freidl M, Szkokan P, et al. Effects of NMDA receptor modulators on a blood-brain barrierinvitromodel[J]. Brain Res, 2011, 1394: 49-61.
[20]Kook SY, Hong HS, Moon M, et al. Aβ1-42-RAGE interaction disrupts tight junctions of the blood-brain barrier via Ca2+-calcineurin signaling[J]. J Neurosci, 2012, 32(26):8845-8854.
[21]Qian RZ, Zhang GP, Jin HM, et al. Dual-direction effect of crenulatin on apoptosis of cerebral microvascular endothelial cells and it’s mechanism[J]. Chinese J Pathophysiology, 2005, 21(11):2086-2090.
[22]Förster C, Burek M, Romero IA, et al. Differential effects of hydrocortisone and TNF alpha on tight junction proteins in aninvitromodel of the human blood-brain barrier[J]. J Physiol, 2008, 586(7):1937-1949.
Effect of idazoxan on permeability of inflammatory blood-brain barrier modelinvitro
WANG Xin-shi, ZHU Pan, ZHU Zhen-guo, XIA Nian-ge, LI Jia, ZHENG Rong-yuan
(DepartmentofNeurology,TheFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China.E-mail:zhengry2013@163.com)
AIM: To study the effect of idazoxan on the permeability of inflammatory blood-brain barrier (BBB) modelinvitroand the expression of tight junction protein ZO-1. METHODS:InvitroBBB model was established by murine brain endothelial cell line bEnd.3 incubated for 7 d. The cells were treated with TNF-α (10 nmol/L) for additional 24 h to establish the inflammatory BBB model, which was pretreated with IDA at doses of 50, 100 and 200 μmol/L, respectively. The permeability was measured using fluorescein isothiocyanate-conjugated dextran (FD-40, MW 40,000), the expression of ZO-1 was detected by Western blot analysis, the distribution of ZO-1 was observed by immunofluorescence, and the mRNA expression of MMP-9/TIMP-1 was measured by RT-PCR.RESULTS: After incubated for 7 d, b.End3 cells converged to be confluent monolayer with low permeability. The inflammatory BBB model induced by TNF-α treatment displayed much higher permeability with decreased expression of tight junction protein ZO-1, destroyed distribution of ZO-1 and increased mRNA expression of MMP-9. When pretreated with IDA, the permeability was greatly decreased, the expression of ZO-1 was greatly increased, the abnormal distribution of ZO-1 was greatly ameliorated and the mRNA expression of MMP-9 was obviously reduced. The effect was most significant in IDA (200 μmol/L)-pretreated group (P<0.01). CONCLUSION: IDA directly acts on brain endothelial cells to reduce the expression of MMP-9, increase the expression of tight junction protein ZO-1 and ameliorate the destroyed distribution of ZO-1 in the inflammatory BBB, thus reversing the abnormally elevated permeability in a inflammatory BBB modelinvitroinduced by TNF-α.
Idazoxan; Blood-brain barrier; Tight junction; ZO-1; Matrix metalloproteinases-9; Tissue inhibitors of metalloproteinase-1
1000- 4718(2015)04- 0669- 06
2015- 01- 07
2015- 03- 16
浙江省自然科学基金资助项目(No. LQ12H09002); 温州市科技计划项目(No. Y20140283)
R363.2
A
10.3969/j.issn.1000- 4718.2015.04.017
△通讯作者 Tel: 0577-55589361; E-mail: zhengry2013@163.com
