白藜芦醇对人卵巢癌SKOV-3 细胞形态及增殖的抑制作用
2015-04-13唐锐先吉林医药学院药学院吉林吉林303永吉县医院妇产科吉林吉林300
唐锐先,张 颖,李 伟,张 巍* (.吉林医药学院药学院,吉林 吉林 303;.永吉县医院妇产科,吉林吉林 300)
卵巢癌是女性生殖系统常见恶性肿瘤之一。对其常规治疗方法是癌细胞减灭术和放、化疗等[1]。此病在早期常无自觉症状,一旦出现临床症状时往往已失去了最佳手术治疗期[2]。而一些老人、体衰且伴有其他严重基础病的患者对根治手术及传统放、化疗方案不能耐受等原因,严重影响了卵巢癌治疗的疗效及愈后[3]。因此,寻找高效、低毒等医治手段及药物成为卵巢癌治疗的热点[4]。本研究是通过白藜芦醇(Res)对人类卵巢癌SKOV-3 细胞形态学的影响及其增殖抑制作用的研究,为白藜芦醇应用于卵巢癌的治疗寻找实验室依据。
1 材料与方法
1.1 材 料
四甲基偶氮唑蓝(MTT,美国Amerso 公司);倒置显微镜(日本奥林巴斯公司);二甲基亚砜(DMSO);酶联免疫检测仪(DNM-9602 型,北京普朗新技术有限公司)。纯度为95%白藜芦醇粉末(天津迈迪瑞康生物医药科技公司),人卵巢癌细胞SKOV-3 系(吉林医药学院实验中心保存);RPMI 1640 培养基(美国Gibco 公司);胎牛血清(吉林血研所);CO2培养箱(MCO-15AC 型,日本)。
1.2 白藜芦醇实验浓度的配制
白藜芦醇以DMSO 溶解后,用RPMI 1640 培养基配成100 mg/L 的储存液并置于-20 ℃低温冰箱保存。临用前用含10%胎牛血清的RPMI 1640 培养液分别稀释成所需的白藜芦醇实验浓度。
1.3 细胞的培养
将SKOV-3 细胞培养于含10%胎牛血清的无菌RPMI 1640 培养基中,置于37 ℃,5% CO2饱和湿度的培养箱中孵育,细胞生长至对数生长期,然后分瓶传代培养。
1.4 细胞形态学观察及MTT 法检测
取对数生长期的SKOV-3 细胞,用胰酶消化制成密度为1 ×105个/mL 细胞悬液,按100 μL/每孔接种于96 孔培养板。含10%胎牛血清的RPMI 1640 培养液加入白藜芦醇配制成20、40、80 μmol/L 的不同浓度组继续培养。同时设置不加细胞,只加培养液的空白对照组与不加药物,而作为各浓度处理组的细胞对照组。以上每组设3 个复孔,置于37 ℃,5% CO2饱和湿度的培养箱中分别培养24、48、72 h。期间使用倒置显微镜观察不同浓度白藜芦醇对SKOV-3 细胞影响,评估细胞细胞形态、生长速度。培养结束前4 h,每孔加入20 μL 四甲基偶氮唑蓝(MTT),置5%CO2培养箱继续培养4 h,弃去上清液,每孔加入DMSO 150 μL,振荡10 min 后,用酶标仪于波长为570 nm处测定吸光度值(OD 值),并通过下列公式计算出不同浓度的白藜芦醇对SKOV-3 细胞的增殖抑制率。[增殖抑制率(%)=[1 -(实验组OD 值-空白对照组OD 值)/(对照组OD 值-空白对照组OD值)]×100%,计算出半数抑制浓度(IC50)。
1.5 Hoechest 33258 荧光染色
另取对数生长期SKOV-3 细胞,培养24 h 后,吸出孔内培养液,用磷酸盐缓冲液(PBS)冲洗2 次,每次2 min;加入多聚甲醛固定15 min,吸出固定液,用PBS 洗2 次,每次2 ~3 min;每孔加入1 mL Hoechst 33258 工作液,避光染色5 min,荧光显微镜下检测细胞核形态。随机观察5 个视野,取效果良好的作为实验结果。
1.6 统计处理
2 结 果
2.1 白藜芦醇对SKOV-3 细胞形态学影响
见图1,对照组卵巢癌细胞SKOV-3 细胞紧贴瓶底,细胞密集,细胞间连接紧密,细胞形态饱满,边界清晰;细胞核为卵圆形,染色质丰富。与对照组比较,20 μmol/L 白藜芦醇组细胞形态变化不明显;40 μmol/L白藜芦醇组细胞较为稀疏,附壁疏松,脱壁细胞由椭圆形变圆,细胞肿胀;80 μmol/L 白藜芦醇组细胞皱缩变小,细胞边缘毛糙不规则,胞质致密,细胞核变形,细胞质中颗粒较多。
2.2 白藜芦醇对卵巢癌细胞SKOV-3 增殖影响
表1 是对照组和不同浓度白藜芦醇观察组作用不同时间后测得的OD 值。如表所示,白藜芦醇各观察组作用于SKOV-3 细胞后OD 值与对照OD 值相比,均明显下降,差异有统计学意义(P <0.05 或P <0.01)。
表2 是白藜芦醇各观察组对SKOV-3 细胞的增殖抑制率于不同时间、浓度的比较。计算出IC50为37.81 μmol/L。
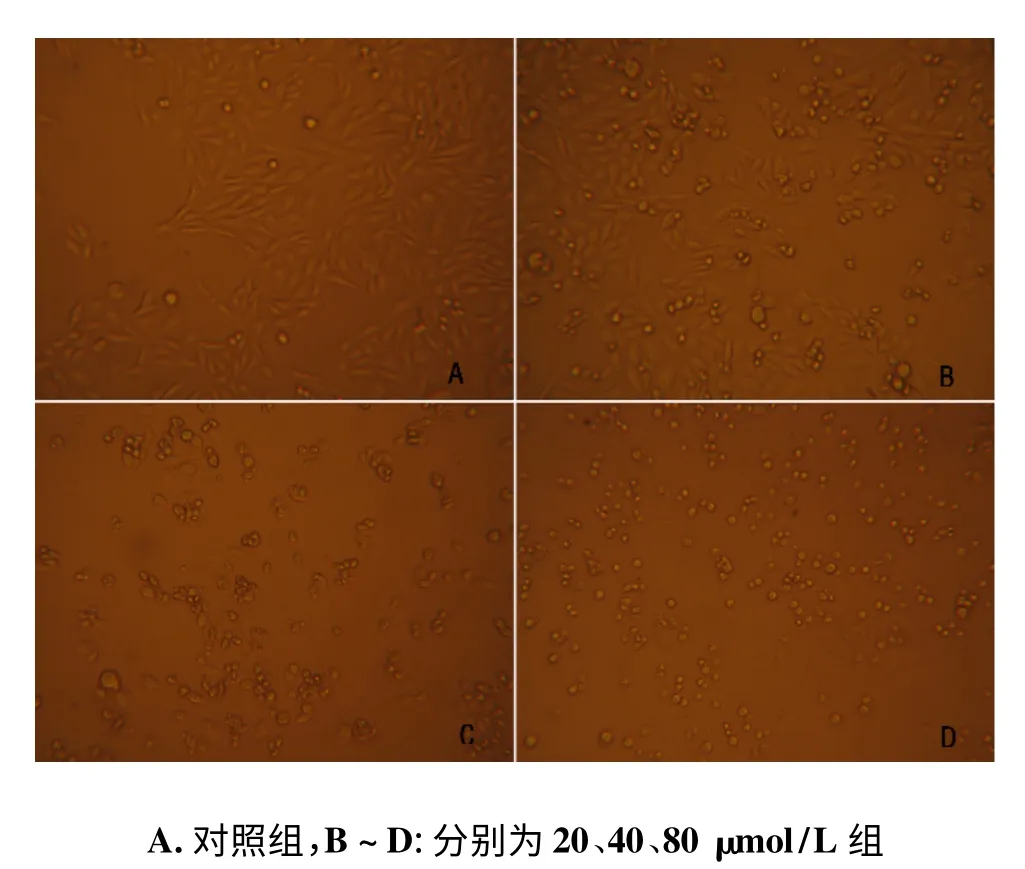
图1 不同浓度的白藜芦醇对SKOV-3 细胞形态的影响
2.3 白藜芦醇对卵巢癌SKOV-3 细胞核形态影响
荧光显微镜观察显示,对照组SKOV-3 细胞大小均一,成弥散均匀的淡蓝色弱荧光;经40 μmol/L 白藜芦醇组处理24 h 后,SKOV-3 细胞胞核皱缩明显,并可见致密强荧光,存在核碎裂和凋亡小体等强荧光团块(图2)。

表1 白藜芦醇对SKOV-3 细胞的吸光度值(×10 -2)
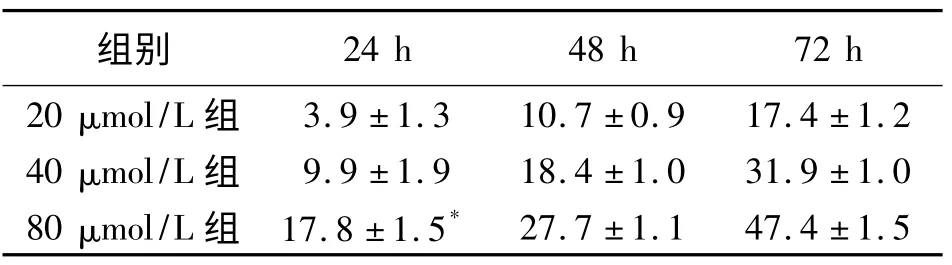
表2 不同条件白藜芦醇对SKOV-3 细胞的增殖抑制率
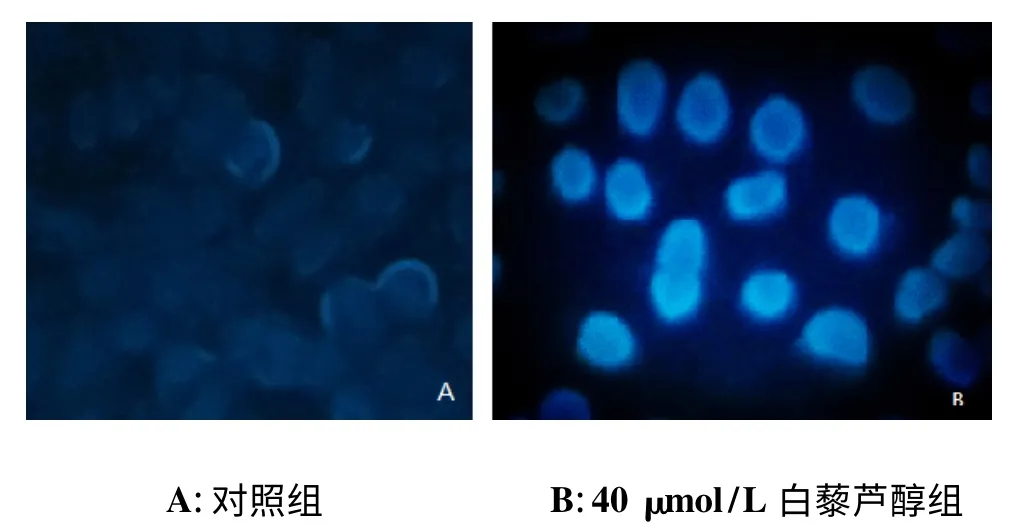
图2 白藜芦醇对SKOV-3 细胞核形态影响
3 讨 论
白藜芦醇是葡萄、虎杖等植物在遇到真菌感染、紫外线照射等恶劣环境下自身分泌的一种天然多酚类抗毒素[5]。近年来经研究表明白藜芦醇作为一生物还原剂,对炎性反应及应激反应产生的炎性介质及细胞因子有良好的清除作用,其抗肿瘤的作用也得到众多学者的重视[6]。白藜芦醇显著抑制多种肿瘤的生长并诱导肿瘤细胞发生凋亡,如人肝母细胞瘤、前列腺癌、乳腺癌、白血病、肺癌等[7-9]。
我们在白藜芦醇对人卵巢癌SKOV-3 细胞形态学的影响研究中发现在相同的处理时间里,随白藜芦醇浓度的增高,人卵巢癌SKOV-3 细胞由细胞间连接紧密、细胞形态饱满、边界清晰、细胞核为卵圆形,染色质丰富变为细胞皱缩变小,细胞边缘毛糙不规则,胞质致密,细胞核变形,细胞质中颗粒较多,产生凋亡小体等明显改变。
MTT 比色法因其快速、简便、灵活等优点而被广泛用于生物因子的活性检测、肿瘤放射敏感性测定、细胞毒性试验、抗癌药物对肿瘤增殖活性的影响等方面[10]。本研究结果发现,相对于对照组,各白藜芦醇浓度组作用于SKOV-3 细胞后的OD 值明显下降,差异有统计学意义。且在同一作用时间下,浓度较高组的抑制率高于浓度较低组的抑制率;在同一浓度白藜芦醇作用下,作用时间较长组的抑制率高于作用时间较短组的抑制率。综上所述白藜芦醇对SKOV-3 细胞的增殖抑制作用呈现剂量-时间依赖性,这与其他相类似研究结果相同[11]。
荧光染料Hoechst 33258 染色原理是因为Hoechst 33258 可少量通过正常细胞膜进入细胞内,使其染上浅蓝色。但随着凋亡细胞的膜通透性增强,进入凋亡细胞中的Hoechst 33258 比进入正常细胞的量增多,此外在凋亡早期细胞的染色体DNA 的结构发生了改变,使Hoechst 33258 染料能更有效地与DNA 结合,从而被染成亮蓝色[12]。根据IC50值,本研究选取与其接近的40 μmol/L 白藜芦醇做人卵巢癌SKOV-3细胞凋亡早期实验,以期能客观地反映白藜芦醇抑制人卵巢癌细胞SKOV-3 增殖扩展的能力。结果显示40 μmol/L 白藜芦醇可使人卵巢癌SKOV-3 细胞核形态发生改变,可促进人卵巢癌SKOV-3 细胞的早期凋亡。而白藜芦醇促进人卵巢癌SKOV-3 细胞凋亡机制则有待进一步研究。
[1] 王欣彦,王珺,秦雪,等.晚期复发卵巢癌合并恶性肠梗阻15 例临床分析[J].中国实用妇科及产科杂志,2012,28(6):455-456.
[2] 胡欣欣,张勤华,齐聪.晚期卵巢癌新辅助化疗研究进展[J].中国实用妇科及产科杂志,2011,27(1):77-80.
[3] 张雯碧,鹿欣.卵巢癌化疗耐药相关基因与预后的研究进展[J].国际妇产科学杂志,2007,34(3):193-196.
[4] 赵建国,曲芃芃.肿瘤细胞减灭术应用于复发性卵巢癌治疗进展[J].国际妇产科学杂志[J].2014,41(4):351-354.
[5] Tang MJ.The mechanism study of influence of resveratrol on proliferation,apoptosis,invasion in liver cancer Bel-7404 cells[J].Strait Pharmaceutical J,2013,25(2):241-243.
[6] Huang Xianfeng,Zhu Hailiang.Resveratrol and its analogues:promising antitumor agents[J].Anticancer Agents Med Chem,2011,11(5):479-490.
[7] 万志强,李薇,崔久嵬.等.胡桃醌对白血病细胞增殖的抑制作用[J].吉林大学学报:医学版,2012,38(3):486-489.
[8] 汪维佳,虞娉.白藜芦醇增强顺铂对肝癌细胞Bel-7402的生长抑制作用[J].实用肿瘤杂志,2009,24(2):157-159.
[9] 程海燕,周家华,杨德同.白藜芦醇诱导胰腺癌细胞凋亡通路的实验研究[J].现代医学,2010,38(5):515-517.
[10] 李上标,裴淑艳,蒋超,等.MTT 比色法研究应用进展[J].西北民族大学学报:自然科学版,2013,34(91):68-91.
[11] 蓝鸿雁,张纪妍,陈杰,等.白藜芦醇诱导卵巢癌SKOV3 细胞凋亡的作用机制[J].山东医药,2014,54(1):32-39.
[11] 于慧玲,李冬梅,屠军,等.宫颈鳞癌患者血液、癌组织中Survivin、Caspase-3、Bcl-2 和Bax 的表达及其相互关系[J].中国妇科幼保健,2014,26(9):22-24.
[12] 曾国平,向东山,何治柯.基于Hoechst 33258 荧光染料检测单链DNA 的方法研究[J].化学学报,2011,69(12):1450-1456.
