重度冷应激对三河牛血液生化指标及相关基因表达的影响
2015-03-22李金龙吴宏军刘爱荣王雅春
李 玮,刘 蕤,马 尧,李金龙,吴宏军,刘爱荣,俞 英,徐 青,王雅春*
(1.中国农业大学动物科技学院,农业部动物遗传育种试验室,畜禽育种国家工程实验室,北京100193; 2.北京交通大学生命科学与生物工程研究院,北京 100044;3.宁夏大学农学院,银川 750021; 4.内蒙古谢尔塔拉种牛场,海拉尔 021008;5.内蒙古海拉尔农垦集团,海拉尔 021008)
重度冷应激对三河牛血液生化指标及相关基因表达的影响
李 玮1,3,刘 蕤1,马 尧2,李金龙2,吴宏军4,刘爱荣5,俞 英1,徐 青2,王雅春1*
(1.中国农业大学动物科技学院,农业部动物遗传育种试验室,畜禽育种国家工程实验室,北京100193; 2.北京交通大学生命科学与生物工程研究院,北京 100044;3.宁夏大学农学院,银川 750021; 4.内蒙古谢尔塔拉种牛场,海拉尔 021008;5.内蒙古海拉尔农垦集团,海拉尔 021008)
本研究旨在检测与牛冷应激反应相关的生化指标,筛选参与牛冷应激反应的相关基因。以内蒙古三河牛为研究对象,对30头青年牛进行室外-32 ℃冷应激处理3 h,采集冷应激前后试验个体血样,检测血液生化指标及基因表达量的变化。冷应激3 h后,试验个体T3、T4及ACTH3个血液生化指标极显著升高(P<0.01)。mRNA差异显示方法(DDRT)检测到基因LIN54和KLF12在冷应激后表达量降低,荧光定量RT-PCR验证了冷应激后2个基因表达下调(LIN54下调显著(P<0.05),KLF12下调极显著(P<0.01))的结果。筛选到的2个基因分别属于LINC和KLF家族,LINC参与有丝分裂基因的活化,KLF参与细胞增殖和凋亡。T3、T4及ACTH 3项生化指标可以初步作为衡量三河牛冷应激反应强弱的侯选指标在大群体中进行验证,筛选到的2个基因,可作为参与三河牛冷应激反应的重要侯选基因,进一步研究2个基因在牛冷应激反应中的作用机制,综合这些生化指标及侯选基因表达的变化,用于评价个体冷应激反应的强度,在三河牛抗冷应激育种中将具有更广泛的应用价值。
冷应激;三河牛;生化指标;基因表达;mRNA差异显示
应激(Stress)是指机体对外界或内部的各种异常刺激所产生的非特异性应答反应的总和。温度应激是应激反应中最常见的一种,包括热应激和冷应激。冷应激是我国北方高寒地区一种最普遍的应激因素,在这些高寒地区,冬春寒冷季节达5个月之久,寒流常伴有暴风雪天气。由于低温而导致的冷应激常引起畜禽机体生理平衡的破坏,导致免疫力下降,表现为生长放缓、生产性能下降、繁殖力降低、发病率和死亡率高等。北方地区是我国畜禽养殖的主要地区,因此冷应激给我国北方地区的畜牧业造成了巨大经济损失,是制约我国畜牧业高效发展的主要因素之一。
在冷应激状态下,动物机体启动一系列非特异性的自身免疫反应来中和应激的影响,这个过程会导致血液中一些生化分子的浓度发生变化。近年来,对小鼠的冷应激相关研究已证明,冷应激可导致动物促肾上腺皮质激素(ACTH) 的分泌增加,从而作用于肾上腺,调节皮质醇的合成和分泌,以使机体增强适应性,保持体内平衡[1]。另一方面,冷应激可导致动物较短时间内血液中促甲状腺激素(TSH)的分泌增加,从而引起血清中三碘甲腺原氨酸(T3)、甲状腺素(T4)水平升高,而不同动物冷应激后不同时间内T3和T4的变化不同[2]。血浆皮质酮(CORT)的浓度在动物急性冷应激时分泌增加,使动物可以抵御外界低温环境的刺激。K.Fukuhara等[3]报道,大鼠在冷应激1 h后血浆皮质酮水平增加,9 h后趋向于正常,24 h时仍高于对照水平,而冷应激5 d时只稍高于对照水平。开产前金定蛋鸭冷应激12 h内,CORT的含量前期上升迅速,后期变化规律不明显[4]。此外,动物冷应激反应中谷胱甘肽过氧化物酶(GSH-Px)与红细胞钾含量的变化也有较多报道[5-7]。
冷应激反应是生物机体的一种整体变化,涉及到机体多系统、多层次的协调效应[8-9]。关于动物冷应激反应机制及受冷应激调控的基因有很多报道,大约有几十种基因参与机体的冷应激反应。其中研究较多的有热休克蛋白基因(HSPs)、解偶联蛋白基因(UCPs)、冷诱导结合RNA蛋白基因(CIRP)、金属硫蛋白基因(MT)。李忠秋等[10]在对猪成纤维细胞进行的冷应激研究中发现,冷应激会诱导HSP90的表达量显著上调,且随着温度的降低而升高。李士泽等[11]、吴永魁等[12]分别对大鼠和仔猪进行冷应激,发现HSP70蛋白表达量在组织及淋巴细胞中均上调。金福厚等[13]从冷处理的BALB/C鼠的睾丸组织中克隆出CIRP的cDNA,表明CIRP在生物体中能够被低温诱导,可能防止生物体遭受冷损伤。谷爱梅等[14]通过对NIH3T3细胞转染MTⅡA基因,检测到MT表达的上调可提高细胞对低温的耐受性,且随其含量的升高耐受性增大。这些基因的表达变化和冷应激强度及冷应激过程密切相关,可作为评价动物冷应激反应强弱的另一种有效的标志物。目前,筛选差异表达基因的技术主要有扣除杂交、抑制消减杂交、mRNA差异显示等多种[15-16]。 其中,mRNA差异显示技术[17](Differential display reverse transcription polymerase chain reaction,DDRT-PCR)具有速度快、操作简便,能够检测低丰度mRNA、灵敏度高,花费较低等优点[18-20]。
目前,国内外有关畜禽冷应激的研究较少,而对牛冷应激相关的生化指标和基因的筛选研究的相关报道更少。本研究以内蒙古三河牛为试验群体,-32 ℃冷应激3 h,检测试验个体应激前后血液生化指标及基因的表达变化,筛选三河牛冷应激反应相关的血液生化指标及差异表达基因,初步探讨三河牛冷应激反应的分子机理。
1 材料与方法
1.1 试验动物和样品采集
随机选取内蒙古谢尔塔拉牛场三河牛群体中体质健康、体重相近、月龄相近且无亲缘关系的30头青年母牛,饲养于同一牛舍内。采用配对试验设计,进行冷应激前后三河牛血液生化指标和基因差异表达的试验。该牛场为砖瓦结构,牛群采用半舍饲饲养方式,饲喂全混合日粮。试验动物在温度为5 ℃左右的牛舍内过夜饲养15 h,然后在室外平均气温-32 ℃的低温环境中冷处理3 h。分别采集冷应激前后牛颈静脉抗凝血10 mL,非抗凝血10 mL。
1.2 血液生化指标检测
取所有30头青年母牛的新鲜非抗凝血各10 mL,3 000 r·min-1离心10 min,收集血清检测GSH-Px、T3、T4、ACTH、CORT的含量,收集红细胞检测钾离子含量。所有生化指标均委托北京华英生物技术研究所采用放射免疫分析法进行测定。
1.3 血液白细胞总RNA提取
取30头青年母牛的新鲜抗凝血各10 mL, 3 000 r·min-1离心10 min,吸取白膜层细胞,加入1.5 mL RNA固定液中,-80 ℃低温冷冻保存,用于RNA的提取。采用TRIzol Reagent(Invitrogen)提取总RNA,取200 μL加入RNA固定液的白细胞样品,加入1 mL TRIzol,充分裂解细胞,提取细胞总RNA,Nanodrop 2000检测总RNA的含量和纯度,2%琼脂糖检测总RNA完整性。
1.4 反转录和DDRT-PCR
在30头青年母牛中任选6个个体样本用于DDRT-PCR试验,200 ng总RNA,加入2 μL 50 μmol·L-1锚定引物,用RNase-free水调至14 μL,70 ℃保温10 min后,迅速置于冰上冷却。加入4 μL 5×M-MLV Buffer,1 μL 10 mmol·L-1dNTP mixture,0.5 μL 40 U·μL-1RNase inhibitor,0.5 μL 200 U·μL-1M-MLV反转录酶(TaKaRa),42 ℃保温1 h,70 ℃处理15 min,终止反应。以cDNA产物为模板,3条锚定引物和24条随机引物(表3)两两组合进行DDRT-PCR 反应。反应体系为20 μL,其中2 μL 10×PCR Buffer,1.5 μL dNTP mixture(2.5 mmol·L-1),0.2 μLTaq聚合酶(5 U·μL-1),锚定引物(10 μmol·L-1)1 μL,随机引物(10 μmol·L-1)0.5 μL,灭菌去离子水补齐至20 μL。反应条件: 94 ℃ 5 min;94 ℃ 30 s,38 ℃ 60 s,72 ℃ 60 s,25个循环;94 ℃ 30 s,40 ℃ 60 s,72 ℃ 60 s,15个循环;72 ℃ 5 min。3条锚定引物和24条随机引物的序列详见表3。
1.5 差异片段的PAGE凝胶电泳,银染显示及克隆测序
取DDRT-PCR产物4 μL,加入2 μL上样缓冲液,6%非变性聚丙烯酰胺凝胶130 V电泳12~14 h,至溴酚蓝离胶底1.5 cm时结束电泳,进行银染。去离子水中漂洗5 min,10%乙醇固定10 min,1% AgNO3染色10 min,2.5% NaOH洗5 min,甲醛显色至条带清晰。记录分子量为100~1 000 bp,清晰可辨,可以重复扩增的差异显示片段。按同一扩增片段在试验个体冷应激前后出现与否进行差异表达片段的筛选。筛选标准:在3个以上个体中变化同时出现,即作为差异表达的候选片段。回收差异表达的候选片段,采用与原PCR相同的引物组合和反应条件,进行二次扩增,克隆质粒酶切鉴定正确后,委托华大基因公司进行测序,用BLAST软件进行序列分析。
1.6 荧光定量RT-PCR
对通过DDRT-PCR筛选到的候选差异基因,采用荧光定量RT-PCR进一步在30个个体中进行验证。使用PrimerScript RT regent Kit(TaKaRa)合成cDNA第一链,冻存于-40 ℃。以Ensemble上牛的基因组序列为模板,采用Primer 3设计定量PCR引物(表1)。用SYBR Select Master Mix(Applied Biosystems)进行实时定量PCR反应,每个个体设置3次重复,以GAPDH为内参基因,通过Ct法计算该个体目的基因冷应激前后目标基因的相对表达量。
1.7 数据处理
冷应激前后血液中6项生化指标的数据,运用SAS9.1软件进行配对t检验,再利用GLM过程分析各因素对生化指标变化的影响,模型中考虑体重和月龄;荧光定量RT-PCR数据运用Excel进行配对t检验。所有数值用“Mean±SD”表示。
2 结 果
2.1 冷应激前后三河牛血清生化指标的变化分析
对30头三河牛冷应激前后的6项血液生化指标:血清谷胱甘肽过氧化物酶(GSH-Px)、三碘甲腺原氨酸(T3)、甲状腺素(T4)、促肾上腺皮质激素(ACTH)、皮质酮(CORT)、红细胞钾含量进行检测,统计分析结果见表2。三河牛冷应激3 h后,检测的6项血液生化指标中,T3、T4和ACTH含量极显著升高(P<0.01),其余几项指标未表现出显著差异,而试验个体体重和月龄对各生化指标的变化无显著影响(P>0.05)。
表1 荧光定量RT-PCR引物
Table 1 Primers for Real-time PCR

基因名称Genename引物序列(5′⁃3′)PrimersequenceKLF12Forward:GCAAAGCACAAATGGACCCC,Reverse:AGGGCCGTAGATCCAGTTTCLIN54Forward:CTCTGGTCCGGTAATCACGA,Reverse:GAACCCTACCTGCAATGACCGAPDHForward:GGCGCCAAGAGGGTCAT,Reverse:AGGCATTGCTGACAATCTTGAG
表2 三河牛冷应激前后血液中相关生化指标的变化
Table 2 Changes of the blood biochemical parameters of Sanhe cattle before and after cold stress

T3/(ng·mL-1)T4/(ng·mL-1)ACTH/(pg·mL-1)CORT/(ng·mL-1)GSH⁃PX/(U·mL-1)K+/(mmol·L-1)应激前Beforecoldstress0.84±0.17a38.93±7.29a19.88±4.70a248.69±14.69801.11±50.9419.39±4.28应激后Aftercoldstress1.34±0.32b50.03±8.03b27.74±6.63b248.76±21.5784.21±107.4919.68±4.75
同列中不同肩注字母表示差异极显著(P<0.01)
Different letters in the same row mean extremely significant difference between the treatments (P<0.01)
2.2 DDRT-PCR结果
本研究利用文献[21]中报道的3条锚定引物和24条随机引物配对组合,采用高低严谨(先经过25个低严谨PCR循环,再采用15个高严谨PCR循环)相结合的PCR方法,将大小为100~1 000 bp,清晰可见,相同的差异在3个以上个体中重现的片段记录为差异片段,结果共发现21条冷应激前后表达量有差异的片段,表3提供了获得21个差异片段的引物组合、大小等详细信息,部分差异显示结果见图1 A。
将21条差异表达片段经过二次PCR扩增、回收、克隆后,最后得到11个大小正确的阳性克隆质粒,对11个克隆测序结果进行同源性比对,共发现2条序列分别与牛的2个基因同源,引物组合H-T11A/AP5所得差异片段位于牛基因组6号染色体LIN54基因的第一个外显子(ENSBTAE00000113827)区,而H-T11A/AP12所得差异片段位于牛基因组12号染色体KLF12基因的第一个外显子(ENSBTAE00000440535)区。Blast比对结果表明,这2个基因在人、小鼠、牛及其他一些物种之间具有较高的保守性(表4)。
2.3 差异基因的荧光定量PCR验证结果
采用SYBR Green荧光标记的方法,以GAPDH作为内参基因,对2个差异表达基因LIN54和KLF12进行验证。在mRNA差异显示的银染胶图谱中(图1A),与冷应激前相比,2个基因冷应激后表达下调。从基因的定量PCR结果可以看出(图1B),2个差异显示基因的相对表达量冷应激后显著下调,这与mRNA差异显示的银染图谱结果一致,其中KLF12极显著下调(P<0.01),LIN54显著下调(P<0.05)。
3 讨 论
当机体遇到冷环境的刺激时,机体内T3和T4的含量迅速升高,T3的升高可增强Na+/K+-ATPase的活性,促进Na+、K+的跨膜转运,引起红细胞内K+含量的改变,并导致体内ATP消耗的增加,最终导致机体产热增加。冷应激会激活下丘脑-垂体-甲状腺轴(HTP),导致促甲状腺激素释放激素的分泌增加,从而引起血液中甲状腺素(T4)、三碘甲腺原氨酸(T3)含量的升高。在本研究中,三河牛冷应激前后血清中T3、T4和ACTH的变化显著,这与已有的研究报道一致,提示这3项生化指标可以作为衡量三河牛冷应激反应强弱的辅助指标。本研究没有发现其他指标的显著变化,可能是由于冷处理时间较短,或者三河牛对低温有较强的耐受性[22-24]等原因造成的。因为不同种属动物对冷应激的反应不尽相同,甚至同一种属对不同时间和不同强度的冷应激所做出的反应也不同。对小鼠和猪进行不同程度的急性冷应激后,血液中ACTH、T3、T4的含量显著升高,但延长冷应激时间或停止冷应激后,T3和T4的含量都会有下降的趋势[25-26]。因此,利用血液中生化指标的变化来衡量三河牛冷应激反应的强弱,还需要更为详尽的研究,而利用分子生物学手段,筛选与三河牛冷应激相关的分子标记,再综合生化指标变化的数据,可能会更准确地反应个体对冷应激的反应,在三河牛抗冷应激育种中具有更广泛的应用价值。
表3 DDRT-PCR引物及冷应激前后差异表达片段
Table 3 Primers for DDRT-PCR and fragments expressed differentially before and after cold stress
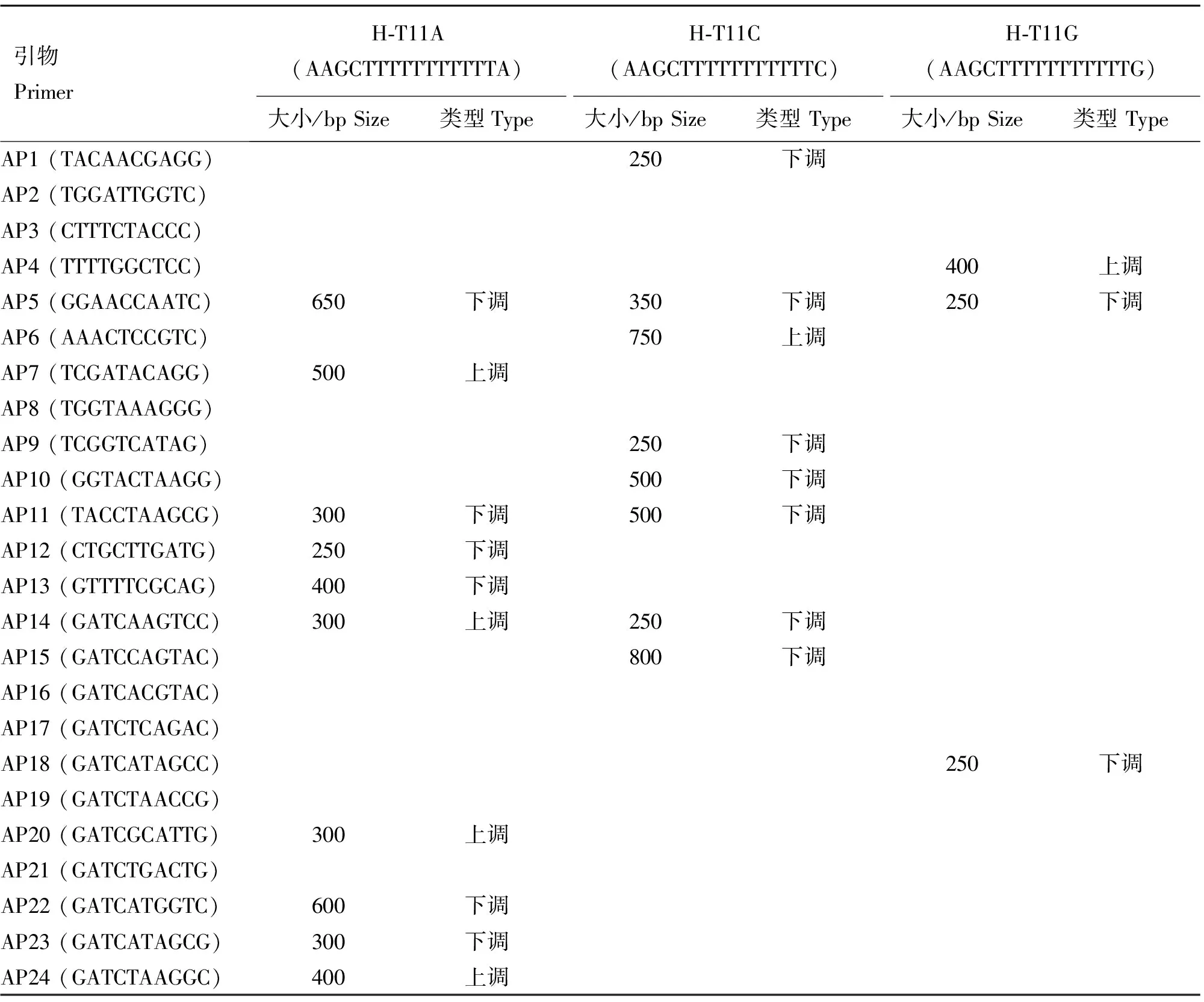
引物PrimerH⁃T11A(AAGCTTTTTTTTTTTA)H⁃T11C(AAGCTTTTTTTTTTTC)H⁃T11G(AAGCTTTTTTTTTTTG)大小/bpSize类型Type大小/bpSize类型Type大小/bpSize类型TypeAP1(TACAACGAGG)250下调AP2(TGGATTGGTC)AP3(CTTTCTACCC)AP4(TTTTGGCTCC)400上调AP5(GGAACCAATC)650下调350下调250下调AP6(AAACTCCGTC)750上调AP7(TCGATACAGG)500上调AP8(TGGTAAAGGG)AP9(TCGGTCATAG)250下调AP10(GGTACTAAGG)500下调AP11(TACCTAAGCG)300下调500下调AP12(CTGCTTGATG)250下调AP13(GTTTTCGCAG)400下调AP14(GATCAAGTCC)300上调250下调AP15(GATCCAGTAC)800下调AP16(GATCACGTAC)AP17(GATCTCAGAC)AP18(GATCATAGCC)250下调AP19(GATCTAACCG)AP20(GATCGCATTG)300上调AP21(GATCTGACTG)AP22(GATCATGGTC)600下调AP23(GATCATAGCG)300下调AP24(GATCTAAGGC)400上调
表4 差异表达片段Blast分析结果
Table 4 Blast analysis of differentially expressed fragments

差异片段Number同源基因Homologousgene片段大小/bpSize序列号AccessionNo.基因功能Genefunction表达模式Type1Proteinlin⁃54homolog(LIN54)510AC_000163.1有丝分裂相关基因的活化下调2Krueppel⁃likefactor12(KLF12)375AC_000169.1细胞增殖和凋亡下调
通过DDRT法筛选到2个差异表达基因,KLF12属于Kruppel样转录因子(Kruppel-like factors,KLF)家族。KLF家族是高度保守的转录因子家族,在真核细胞的基因转录调控过程中起着重要作用,参与调节细胞增殖、凋亡等多种生命活动。目前,KLF12与肿瘤相关的研究比较多,而与应激相关的研究未见报道。但体内和体外试验证明,同一家族的KLF11基因能使氧化应激基因SOD2和CAT1的表达下调,增加了细胞对氧化应激的敏感性[27]。而冷应激可以诱发机体的氧化应激,导致体内自由基增多,对机体造成损伤。也有研究报道称KLF11在小鼠肝脏的糖代谢过程中起着重要作用[28],而糖代谢又是为机体提供能量的主要途径,与冷应激后机体维持体温恒定密切相关,但具体的机理仍待进一步的研究。而同家族的另一成员KLF4,能够与HSPs基因启动子区结合可直接调控HSPs的基础表达,在小鼠热休克反应中表达上调[29],提示KLF12可能参与动物的应激反应。而LIN54属于LINC家族(人源的LINC家族也称DREAM),LINC家族是在哺乳动物细胞中发现的一种新的E2F-口袋蛋白复合体,在静止期细胞和有丝分裂基因的活化中起重要作用[30-32]。LIN54是LINC的一个重要的家族成员,在细胞周期进程中起着重要的作用,LIN54富含半胱氨酸的CXC结构域是连接cdc2启动子的新型DNA结合区域,在cdc2启动子处发现了LIN54的两个结合位点,其中一个和细胞周期转录起始位点的同源区域重叠。在冷应激环境中,细胞活性降低,因为LIN54与细胞周期进程高度相关,推测其在维持细胞稳态中起重要作用。

A.两个冷应激前后差异表达片段银染结果:BC.冷应激前;AC.冷应激后。B.两个冷应激前后差异表达片段的荧光定量PCR结果:**代表差异极显著(P<0.01);*代表差异显著(P<0.05)A.Silver staining map of 2 fragments differentially displayed before and after cold stress:BC.Before cold stress;AC.After cold stress.B.RT-qPCR results of 2 differentially expressed before and after cold stress:** means very significant difference(P<0.01);* means significant difference(P<0.05)图1 两个冷应激前后差异表达片段Fig.1 Two fragments differentially expressed before and after cold stress
本研究所用样品来自内蒙古海拉尔地区的三河牛,牛本身作为一种大型的经济动物,在试验处理和样本的采集过程中存在许多局限性。在对三河牛冷应激研究的过程中,发现试验个体的体重、月龄、个体血样采集中的反应等都可能对试验结果造成影响,而且无法采集参与冷应激调控体系中的重要组织样本,不能比较参与组织与血液应对冷应激反应的基因表达及各生化指标的差异,不能连续追踪冷应激不同时间内基因表达及各生化指标的变化趋势等问题,使得对牛等大型动物的冷应激研究存在许多不确定性,为了克服这些问题,本课题组下一步准备先采用模式动物(小鼠或大鼠)和细胞模型,精确控制所有试验条件,检测不同时间及不同强度的冷应激条件下基因的表达差异及生化指标的变化,筛选与冷应激相关的生化指标和基因,然后再对牛群中对应的冷应激相关基因进行分析和验证。尽管存在诸多问题,本研究首次从分子水平及生化指标2个方面同时进行牛的冷应激研究,后期的工作将扩大群体进一步验证及分析筛选到的差异表达基因及检测到的生化指标,寻找能够评价牛冷应激反应强度的标志物,研究牛冷应激反应的分子遗传机制。
[1] 孙 燕,柳锋霖,宋耿青,等.急性和慢性束缚应激对大鼠内脏敏感性和神经内分泌的影响[J].中华消化杂志,2006,26(1):38-41. SUN Y,LIU F L,SONG G Q,et al.Effects of acute and chronic restraint stress on visceral sensitivity and neuroendocrine response in rats[J].ChineseJournalofDigestion,2006,26(1):38-41.(in Chinese)
[2] 李士泽,杨玉英,杨焕民,等.急性冷暴露和冷习服对大鼠和雏鸡某些内分泌活动影响的比较生理学研究[J].中国应用生理学杂志,2008,24(1):23-24. LI S Z,YANG Y Y,YANG H M,et al.Comparative physiology research of acute cold exposure and cold acclimation to the certain endocrine activity in rats and chicks[J].TheChineseJournalofAppliedPhysiology,2008,24(1):23-24.(in Chinese)
[3] FUKUHARA K,KVETNANSKY R,CIZZA G,et al.Interrelations between sympathoadrenal system and hypothalamo-pituitary-adrenocortical/thyroid systems in rats exposed to cold stress[J].JNeuroendocrinol,1996,8(7):533-541.
[4] 王建鑫,王 安.急性冷应激对金定鸭开产前内分泌活动的影响[J].东北农业大学学报, 2005,36(4):480-485. WANG J X,WANG A.Study on the effect of acute cold stress on incretion activity in pre-egged Jin-ding ducks in cage[J].JournalofNortheastAgriculturalUniversity,2005,36(4):480-485.(in Chinese)
[5] PAJOVIC S B,PEJIC S,STOJILJKOVIC V,et al.Alterations in hippocampal antioxidant enzyme activities and sympatho-adrenomedullary system of rats in response to different stress models[J].PhysiolRes,2006,55:453-460.
[7] 曹靖宝,于宏敏.红细胞钾作为中国荷斯坦牛耐寒性选择遗传标记物的可靠性研究[J].中国奶牛,1997 (6):26-28. CAO J B,YU H M.Reliability research about erythrocyte potassium as the selected genetic markers of Chinese Holstein cow cold resistance[J].ChinaDairyCattle,1997(6):26-28.(in Chinese)
[8] WANG J W,XU S W.Effects of cold stress on the messenger ribonucleic acid levels of corticotrophin-releasing hormone and thyrotropin-releasing hormone in hypothalami of broilers[J].PoultSci,2008,87(5):973-978.
[9] WANG J T,LI S,LI J L,et al.Effects of cold stress on the messenger ribonucleic acid levels of peroxisome proliferator-activated receptor-γ in spleen,thymus,and bursa of fabricius of chickens[J].PoultSci,2009,88(12):2549-2554.
[10] 李忠秋,刘春龙,马 红,等.冷应激对东北野猪成纤维细胞HSP90 mRNA 转录水平的影响[J].畜牧兽医学报,2012,43(12):1978-1983. LI Z Q,LIU C L,MA H,et al.Influence of cold stress on transcription ofHSP90 in northeast wild boar fibroblasts[J].ActaVeterinariaetZootechnicaSinica,2012,43(12):1978-1983.(in Chinese)
[11] 李士泽,任宝波,杨焕民,等.不同强度冷应激对大鼠肌肉、脾脏和肝脏中 HSP70 表达的影响[J].应用与环境生物学报,2006,12(2):235-238. LI S Z,REN B B,YANG H M,et al.The effects of different intensity of cold stress on the expression of HSP70 in rat muscle,spleen and liver[J].ChineseJournalofApplied&EnvironmentalBiology,2006,12(2):235-238.(in Chinese)
[12] 吴永魁,计 红,胡仲明,等.不同强度冷应激对仔猪应激激素和 HSP70 的影响[A].中国畜牧兽医学会动物传染病学分会第三届猪病防控学术研讨会[C],2008:871-872. WU Y K,JI H,HU Z M,et al.The effects of different intensity of cold stress on stress hormones and HSP70 in piglet[A].China Animal Husbandry and Veterinary Association Animal Epidemiology Branch of the Third Conference on Swine Disease Prevention and Control[C],2008:871-872.(in Chinese)
[13] 金福厚,庞 岩,李士泽,等.BALB/C 鼠睾丸组织中冷诱导 RNA 结合蛋白的 cDNA 克隆与序列分析[J].应用与环境生物学报,2009,15(1):87-90. JIN F H,PANG Y,LI S Z,et al.CDNA cloning and sequence analysis of cold-induced RNA binding protein in BALB/C mice testicular tissue[J].ChineseJournalofApplied&EnvironmentalBiology,2009,15(1):87-90.(in Chinese)
[14] 谷爱梅,董兆申,邓欣珠.金属硫蛋白与细胞耐寒力的关系[J].中华劳动卫生职业病杂志,1999,17(5):272-275. GU A M,DONG Z S,DENG X Z.Relationship between metallothionein and cold tolerance of cells[J].ChineseJournalofIndustrialHygieneandOccupationalDiseases,1999,17(5):272-275.(in Chinese)
[15] 李文雍,陈清轩.mRNA 差异显示技术研究进展[J].农业生物技术学报,2004,12(5):597-601. LI W Y,CHEN Q X.Progress in the technique of mRNA differential display[J].JournalofAgriculturalBiotechnology,2004,12(5):597-601.(in Chinese)
[16] 安 健,汪 明,王黎霞,等.mRNA 差异显示 PCR 的研究进展[J].北京农学院学报,2005,20(2):64-68. AN J,WANG M,WANG L X,et al.mRNA differential display and its application on drug-resistance of coccidia[J].JournalofBeijingAgriculturalCollege,2005,20(2):64-68.(in Chinese)
[17] HAAG E,RAMAN V.Effects of primer choice and source ofTaqDNA polymerase on the banding patterns of differential display RT-PCR[J].Biotechniques,1994,17(2):226-228.
[18] LIANG P,PARDEE A B.Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction[J].Science,1992,257(5072):967-971.
[19] STEINAU M,RAJEEVAN M S.RNA profiling in peripheral blood cells by fluorescent differential display PCR[M].MethodsMolBiol,2009:211-222.
[20] SHEN M M.Identification of differentially expressed genes in mouse development using differential display andinsituhybridization[J].Methods,2001,24(1):15-27.
[21] BAUER D,MUULLER H,REICH J,et al.Identification of differentially expressed mRNA species by an improved display technique (DDRT-PCR)[J].NucleicAcidsRes,1993,21(18):4272-4280.
[22] 卢振峰,刘莉莉,赵国丽,等.三河牛DGAT1 基因 K232A 位点与产奶性状的关联分析[J].中国奶牛,2014(3):13-16. LU Z F,LIU L L,ZHAO G L,et al.Association of K232A in DGAT1 gene with milk production traits in Sanhe cattle[J].ChinaDairyCattle,2014(3):13-16.(in Chinese)
[23] 马秋萌,秦春华,吴宏军,等.三河牛目标性状边际效益研究[J].中国农业科学,2014,47(7):1409-1416. MA Q M,QIN C H,WU H J,et al.Study on marginal profits of traits in the breeding goal in Sanhe cattle[J].ScientiaAgriculturaSinica,2014,47(7):1409-1416.(in Chinese)
[24] 吴宏军,马孝林,刘爱荣,等.内蒙古三河牛培育历程及进展[J].中国牛业科学,2012,38(4):48-52. WU H J,MA X L,LIU A R,et al.Breeding history and current improvements of Sanhe cattle in Inner Mongolia[J].ChinaCattleScience,2012,38(4):48-52.(in Chinese)
[25] 吴永魁.仔猪冷应激反应中激素、HSP70 及其 mRNA 的动态分析[D].长春:吉林大学,2006. WU Y K.Dynamic analysis of hormones,HSP70 and HSP70 mRNA during piglets cold stress[D].Changchun:Jilin University,2006.(in Chinese)
[26] SASAKI F,WU P,ROUGEAU D,et al.Cytochemical studies of responses of corticotropes and thyrotropes to cold and novel environment stress[J].Endocrinology,1990,127(1):285-297.
[27] FERNANDEZ-ZAPICO M E,MLADEK A,ELLENRIEDER V,et al.An mSin3A interaction domain links the transcriptional activity ofKLF11 with its role in growth regulation[J].EMBOJ,2003,22(18):4748-4758.
[28] 章华兵.KLF11作为一个关键的转录因子调节小鼠肝脏脂代谢的分子机制研究[D].北京:北京协和医学院,2012. ZHANG H B.Mouse KLF11 is a key mediator of hepatic lipid metabolism[D].Beijing:Peking Union Medical College,2012.(in Chinese)
[29] 刘 瑛.KLF4:一个热休克反应和热休克蛋白表达的新调控介质[D].长沙:中南大学,2006. LIU Y.KLF4,a new regulate mediator of heat shock response and heat shock protein[D].Changsha:Central South University,2006.(in Chinese)
[30] LITOVCHICK L,SADASIVAM S,FLORENS L,et al.Evolutionarily conserved multisubunit RBL2/p130 and E2F4 protein complex represses human cell cycle-dependent genes in quiescence[J].MolCell,2007,26(4):539-551.
[31] SCHMIT F,KORENJAK M,MANNEFELD M,et al.LINC,a human complex that is related to pRB-containing complexes in invertebrates regulates the expression ofG2/Mgenes[J].CellCycle,2007,6(15):1903-1913.
[32] PILKINTON M,SANDOVAL R,COLAMONICI O R.Mammalian Mip/LIN-9 interacts with either the p107,p130/E2F4 repressor complex or B-Myb in a cell cycle-phase-dependent context distinct from theDrosophiladREAM complex[J].Oncogene,2007,26(54):7535-7543.
(编辑 郭云雁)
Effects of Severe Cold Stress on Blood Biochemical Parameters and Related Gene Expression in Sanhe Cattle
LI Wei1,3,LIU Rui1,MA Yao2,LI Jin-long2,WU Hong-jun4,LIU Ai-rong5, YU Ying1,XU Qing2,WANG Ya-chun1*
(1.KeyLaboratoryofAgriculturalAnimalGeneticsandBreeding,NationalEngineeringLaboratoryofAnimalBreeding,CollegeofAnimalScienceandTechnology,ChinaAgriculturalUniversity,Beijing100193,China;2.InstituteofBiologicalScienceandBioengineering,BeijingJiaotongUniversity,Beijing100044,China;3.SchoolofAgriculture,NingxiaUniversity,Yinchuan750021,China;4.InnerMongoliaXieertalaCattleBreedingFarm,Hailaer021008,China; 5.InnerMongoliaHailaerAgriculturalReclamationGroup,Hailaer021008,China)
The aim of this study was to detect the biochemical indexes and relevant genes related to cold stress in Sanhe cattle.Thirty heifer Sanhe cattle in Inner Mongolia were kept at -32 ℃ for 3 h,and then blood samples were collected before and after cold stress separately to detect the biochemical indexes and gene expression changes.After 3 h cold stress,T3,T4 and ACTH in blood significantly increased (P<0.01).The expressions ofLIN54 andKLF12 decreased in silver staining map produced by mRNA differential display method (DDRT),decrease of the 2 genes expression were further verified at the level ofP<0.05 forLIN54 andP<0.01 forKLF12 by fluorescence quantitative RT-PCR.The 2 genes belonged to LINC and KLF families,respectively,LINC involved in mitotic gene activation,KLF involved in cell proliferation and apoptosis.T3,T4 and ACTH may be used as the candidate indexes to measure the strength of cold stress in large population,LIN54 andKLF12 may be the important candidate genes for further study on genetic mechanism of cold stress in cattle.The combination of these biochemical indexes and expression change of candidate genes would be used to assess the change of individual under cold stress,which will be more valuable in breeding for cold resistance ability in Sanhe cattle.
cold stress;Sanhe cattle;biochemical index;gene expression;mRNA differential display
10.11843/j.issn.0366-6964.2015.08.024
2014-11-07
国家自然科学基金(31172191);“十二五”科技支撑计划(2011BAD28B02);现代农业产业技术体系建设专项资金(CARS-37);长江学者和创新团队发展计划(IRT1191)
李 玮(1990-),女,河北邢台人,硕士生,主要从事动物分子遗传学研究,E-mail:lw9056@163.com;刘 蕤(1988-),女,四川宜宾人,硕士,主要从事动物分子数量遗传学研究,E-mail:kkrabbit-2007@163.com。李 玮和刘 蕤为共同第一作者
*通信作者:王雅春,教授,E-mail:wangyachun@cau.edu.cn
S823.2
A
0366-6964(2015)08-1463-08
