基于DTI分析小脑上脚及其交叉各向异性分数和ADC值的差异性
2015-03-22付民峰许宏霞
付民峰,许宏霞
(山东省邹城市人民医院①放射科,②中医科,山东 邹城 273500)
基于DTI分析小脑上脚及其交叉各向异性分数和ADC值的差异性
付民峰1,许宏霞2
(山东省邹城市人民医院①放射科,②中医科,山东 邹城 273500)
目的:应用DTI定量评估小脑上脚和小脑上脚交叉的各向异性分数(fractional anisotropy,FA)与ADC值,并比较小脑上脚与小脑上脚交叉数值之间的差异性。方法:回顾性分析100例在我院行颅脑MRI检查患者的DTI图像数据,由2名专家运用ROI功能在FA图和ADC图上分别测量小脑上脚交叉和两侧小脑上脚的FA值和ADC值。计量资料比较采用配对样本t检验。结果:100例中,平均FA值两侧小脑上脚为0.710±0.049,明显高于小脑上脚交叉0.514±0.042,差异有统计学意义(t= 37.165,P=0.000)。小脑上脚和小脑上脚交叉的平均ADC值分别为(759.59±30.87)×10-6mm2/s和(723.86±36.33)×10-6mm2/s,差异有统计学意义(t=8.128,P=0.000)。结论:小脑上脚交叉的FA值和ADC值均低于小脑上脚,说明两者的微细结构存在差异性。FA图可以区分小脑上脚和小脑上脚交叉。
弥散张量成像;磁共振成像;各向异性分数;表现弥散系数;小脑上脚
DTI是一种MRI功能成像技术,可定量评价脑白质的各向异性[1],其中各向异性分数(fractional anisotropy,FA)和ADC是DTI中主要参数指标。FA值可反映神经纤维解剖结构的完整性,ADC值主要反映细胞外间隙的大小[2-3]。小脑上脚是连接小脑和中脑的最大传出纤维,两侧小脑上脚在中脑下部水平的交汇处即为小脑上脚交叉,小脑上脚和小脑上脚交叉都是脑干结构的重要组成部分,也是许多疾病研究的对象,如脑梗死、多发性硬化、进行性核上性麻痹、Wernekink综合征、Joubert综合征、多系统萎缩和帕金森病[4-9]等。因此准确认识小脑上脚及其交叉在临床工作中具有重要意义。本文应用DTI定量评估小脑上脚和小脑上脚交叉的FA值和ADC值,并比较数值之间的差异性。
1 资料与方法
1.1 一般资料 收集2014年7—12月在我院行颅脑MRI患者100例,其中男47例,女53例;年龄22~78岁,平均52.4岁。入选标准:①图像无严重的运动伪影或几何变形、失真;②无固定的假牙或其他金属牙齿填充物;③神经科体格检查正常,无神经及精神疾病史;④头颅常规横断面T1WI、T2WI、FLAIR和矢状面T2WI无异常。100例按年龄分为3组,即20~39岁25例、40~59岁 38例和 60~78岁 37例,各组男女比例为12∶13,18∶20和17∶20。本研究经医院医学伦理委员会批准,资料均为回顾性分析。
1.2 仪器与方法 应用Siemens Avanto 1.5 T超导MRI成像仪,头部线圈,行全脑扫描。常规扫描序列:横轴位T1FLAIR(TR/TE 2 000 ms/55 ms),横轴位 FSE T2WI(TR/TE 4 000 ms/99 ms),横轴位 T2FLAIR(TR/TE 9 000 ms/99 ms),矢状位FSE T2WI(TR/TE 4 500 ms/88 ms)。矩阵512×512,层厚5 mm,层距1.5 mm,FOV 230 mm×230 mm。DTI参数:单次激发自旋回波-回波平面成像(SE-EPI)序列,TR/TE 2 700 ms/88 ms,2次信号平均,b值取0、1 000 s/mm2,层厚3 mm,无间距,矩阵128×128,FOV 230 mm× 230 mm。扩散敏感梯度方向20个,扫描时间3 min 56 s。
1.3 图像测量及评价 DTI扫描结束后设备自动获得颅脑横轴位FA图和ADC图。小脑上脚交叉和两侧小脑上脚的FA值和ADC值测量采用圆形ROI功能在相应横轴位FA图和ADC图上进行(图1)。ROI的测量面积小于小脑上脚或小脑上脚交叉的解剖面积,以避免周围组织的影响。采用双盲法,由2名高年资主治医师(从事MRI诊断10年以上)分别测量3次求其平均值作为测量结果,以2名医师测量值的平均值作为最终测量值。
1.4 统计学分析 采用SPSS 16.0软件进行数据分析,FA值和ADC值均以±s表示。数值比较采用配对样本t检验和单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
100例的图像质量均符合研究要求。
经配对样本t检验,2名医师对双侧小脑上脚和小脑上脚交叉FA值与ADC值的测量数据差异均无统计学意义(均P>0.05)。因此2名医师测量值的平均值作为最终测量值。
右侧小脑上脚和左侧小脑上脚的平均FA值分别为0.708±0.050和0.713±0.051,差异无统计学意义(t=-1.753,P=0.083)。双侧小脑上脚的平均FA值0.710±0.049明显高于小脑上脚交叉的 FA值0.514±0.042(t=37.165,P=0.000)(图2)。3个年龄组中,小脑上脚FA值均高于小脑上脚交叉,差异均有统计学意义(表1)。随着年龄增长,小脑上脚FA值逐渐升高,小脑上脚交叉FA值也随之增高,其中20~39岁与40~59岁组FA值比较差异无统计学意义(P=0.301),而FA值在20~39岁与60~78岁组、40~59岁与60~78岁组间比较差异均有统计学意义(P=0.004,0.031)。
右侧小脑上脚和左侧小脑上脚的平均ADC值分别为759.68±36.83和759.49±29.36,差异无统计学意义(t=0.076,P=0.940)。双侧小脑上脚的平均ADC值759.59±30.87明显高于小脑上脚交叉的ADC值723.86±36.33(t=8.128,P=0.000)(图2)。3组ADC值差异均有统计学意义(表2)。随着年龄增长,小脑上脚交叉和小脑上脚ADC值未见明显变化,ADC值在各年龄组之间差异均无统计学意义(均P>0.05)。
表1 各年龄组小脑上脚和小脑上脚交叉FA值比较(±s)
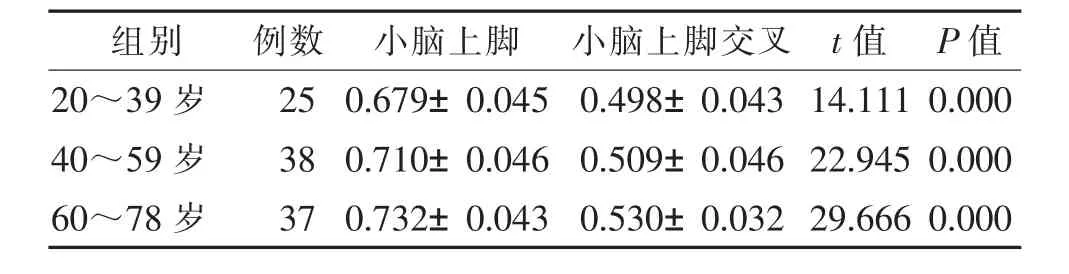
表1 各年龄组小脑上脚和小脑上脚交叉FA值比较(±s)
组别 例数 小脑上脚 小脑上脚交叉 t值 P值20~39岁 25 0.679±0.045 0.498±0.043 14.111 0.000 40~59岁 38 0.710±0.046 0.509±0.046 22.945 0.000 60~78岁 37 0.732±0.043 0.530±0.032 29.666 0.000
表2 3组小脑上脚和小脑上脚交叉ADC值比较(×10-6mm2/s,±s)
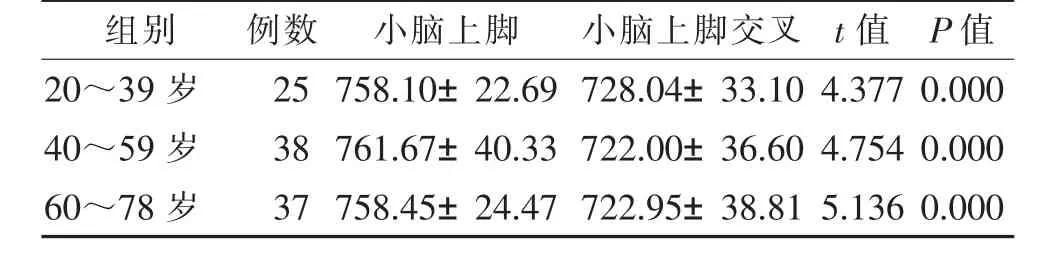
表2 3组小脑上脚和小脑上脚交叉ADC值比较(×10-6mm2/s,±s)
组别 例数 小脑上脚 小脑上脚交叉 t值 P值20~39岁 25 758.10±22.69 728.04±33.10 4.377 0.000 40~59岁 38 761.67±40.33 722.00±36.60 4.754 0.000 60~78岁 37 758.45±24.47 722.95±38.81 5.136 0.000
FA图均能识别小脑上脚交叉和双侧小脑上脚(图2),而在常规T2WI图像中,小脑上脚交叉和双侧小脑上脚均呈等信号,无法区分(图3)。
3 讨论
DTI是目前唯一可在活体上无创显示脑白质纤维束的成像方法,可测量活体组织微结构,可较常规MRI更清晰地显示神经纤维束的走行[10]。ADC、FA值是DTI反映水分子扩散及各向异性的重要参数。
FA值可提供脑白质扩散各向异性的信息,反映活体组织间水分子交换状况和脑白质的精细结构。Shimony等[11]认为不同部位白质纤维的各向异性程度不同,FA值的高低主要与神经纤维的排列方向有关,可反映白质纤维束的方向性,平行纤维越多,说明纤维束的方向一致性越高,FA值越高;而纤维的交叉走行使联络纤维的FA值减低。本研究显示:FA图可直观显示双侧小脑上脚纤维的分布和走行,双侧小脑上脚的平均FA值明显高于小脑上脚交叉的平均FA值,说明小脑上脚较小脑上脚交叉内含有较多的平行纤维,而斜行纤维相对较少。
随着年龄的增长,小脑上脚和小脑上脚交叉的FA值均随之增高。另外,脑白质的各向异性还与脑白质内神经纤维的直径和密度、神经胶质细胞密度、脑白质的磷脂化程度,以及组织的水合化程度、髓鞘结构的完整性等相关[12-13]。本研究显示:小脑上脚交叉的FA值明显低于小脑上脚,并见于各年龄组,证明小脑上脚和小脑上脚交叉的各向异性程度不同,反映了其神经纤维中水分子扩散空间的表现特征不同[14],小脑上脚交叉纤维由小脑上脚纤维的椭圆球体扩散空间逐渐改变为类圆球形,使交叉纤维内水分子扩散阻力相对减小,各向异性降低。小脑上脚交叉FA值或各向异性的降低与轴突和髓鞘的病理过程引起白质纤维破坏而导致FA值降低明显不同[15]。
ADC值可量化分析脑内微观病变,绝对ADC值可用来准确识别缺血组织。ADC值的大小取决于扩散介质的黏滞度、扩散屏障的通透性和空间大小,同时还受细胞器数目和大小、细胞间隙、毛细血管血流,以及组织细胞对水的主动转运过程等因素的影响[16]。脑白质内的髓鞘形成阻碍了水分子扩散屏障的通透性,因此小脑上脚交叉和小脑上脚纤维呈现出不同的扩散状态。本组资料显示,ADC值小脑上脚交叉的(723.86±36.33)×10-6mm2/s,明显低于小脑上脚的(759.59±30.87)×10-6mm2/s,且3组小脑上脚交叉的ADC值均低于小脑上脚。目前临床上急性期脑梗死扩散受限的ADC阈值为600×10-6mm2/s[17],正常小脑上脚及其交叉的ADC值明显高于阈值。然而不同部位急性期脑梗死的ADC阈值也不同。有研究[18]报道,脑干急性期、亚急性期梗死灶的ADC值分别为(344.72±73.96)×10-6mm2/s、(425.62±92.86)× 10-6mm2/s,明显低于正常小脑上脚交叉区ADC值(682.02±36.83)×10-6mm2/s。
本研究中,小脑上脚交叉的FA值和ADC值均较小脑上脚的低,而脑梗死的FA值和ADC值也较周围组织低,因此小脑上脚交叉的FA值和ADC值的降低需与脑干梗死相鉴别。有学者对脑梗死后不同时期患者进行研究[19],发现超急性期 ADC值降低,FA值变化不定;急性期ADC值和FA值均降低;亚急性期ADC值逐渐升高,可呈假阴性,而FA值降低;慢性期ADC值增高,FA值降低。倪建明等[20]回顾性分析了98例不同发病时间的149次脑梗死的DTI资料,发现梗死灶的FA值在发病24 h内无显著变化,而24 h后迅速下降并持续到慢性晚期。上述研究结果均表明,在脑梗死的不同时期,梗死灶的FA值和ADC值随时间均呈现一定的变化趋势。而在本研究中小脑上脚交叉和双侧小脑上脚的FA值和ADC值不随时间发生明显变化。
总之,相对于小脑上脚,小脑上脚交叉FA值和ADC值的降低与脑(干)梗死的FA值和ADC值降低具有明显的不同,因此FA值和ADC值有助于两者的鉴别。本研究尚存在不足,首先,由于小脑上脚交叉和两侧小脑上脚的解剖结构较小,ROI的放置可能存在主观因素导致的偏差。其次,小脑上脚交叉存在变异,窦郁等[12]利用MRI扩散张量纤维束成像(DTT)三维重建技术显示脑干小脑上脚交叉纤维束表现为交叉、对吻和分叉三种解剖类型。因此小脑上脚交叉形态的多样性可能对测量获得的数值产生一定的影响。
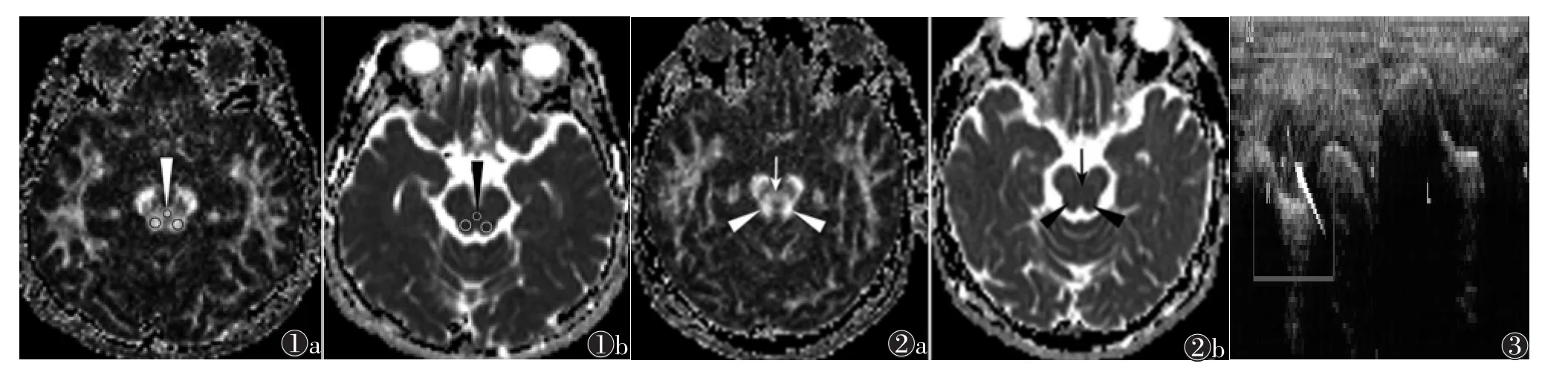
图1 a,1b 小脑上脚和小脑上脚交叉在横轴位FA图和ADC图上的ROI放置示意图。图中上方○(长箭)表示小脑上脚交叉的ROI位置,下方○表示左右小脑上脚的ROI位置 图2a,2b 小脑上脚和小脑上脚交叉在横轴位FA图和ADC图上的表现,小脑上脚交叉(箭头)的FA值和ADC值均低于小脑上脚(长箭)的FA值和ADC值。FA图可以区分小脑上脚和双侧小脑上脚交叉 图3 小脑上脚和小脑上脚交叉在横轴位T2WI上呈等信号,无法识别
[1]郭睿,邓奎品,刘铁军.磁共振弥散张量成像在中枢神经系统的应用研究进展[J].医学影像学杂志,2009,19(6):762-765.
[2]韩鸿宾,王俭,阎军浩,等.层面选择方向扩散加权成像在中脑大脑脚间产生高信号的机制[J].中华放射学杂志,2008,42(9):936-940.
[3]王红,马景旭,贾文霄,等.弥散张量成像FA值和ADC值在颅内肿瘤病变中的应用[J].磁共振成像,2012,3(2):136-140.
[4]Hara K,Watanabe H,Ito M,et al.Potential of a new MRI for visualizing cerebellar involvement in progressive supranuclear palsy[J].Parkinsonism Relat Disord,2013,20:157-161.
[5]Liu H,Qiao L,He Z.Wernekink commissure syndrome:a rare midbrain syndrome[J].Neurol Sci,2012,33:1419-1421.
[6]Dai AI,Wasay M.Wernekink comissure syndrome:a rare midbrain syndrome secondary to stroke[J].J Pak Med Assoc,2006,56:289-290.
[7]Spampinato MV,Kraas J,Maria BL,et al.Absence of decussation of the superior cerebellar peduncles in patients with Joubert syndrome[J].Am J Med Genet A,2008,146:1389-1394.
[8]Poretti A,Boltshauser E,Loenneker T,et al.Diffusion tensor imaging in Joubert syndrome[J].AJNR Am J Neuroradiol,2007,28:1929-1933.
[9]傅方望,贺丹,郝烘玉,等.磁共振形态学测量帕金森叠加综合征[J].中国医学影像技术,2013,29(10):1602-1606.
[10]Okada T,Miki Y,Fushimi Y,et al.Diffusion-tensor fiber tractography:Intra-individual comparison of 3.0T and 1.5 T MR Imaging[J].Radiology,2006,238:668-678.
[11]Shimony JS,McKinstry RC,Akbudak E,et al.Quantitative diffusion-tensor anisotropy brain MR imaging:normative human data and anatomic analysis[J].Radiology,1999,212:770-784.
[12]窦郁,雷军强,郭顺林,等.3.0 T MR三维重建脑干小脑上脚纤维交叉的研究[J].中国临床解剖学杂志,2013,31(1):56-59.
[13]Schaechter JD.Motor rehabilitation and brain plasticity after hemiparetic stroke[J].Prog Neurobiol,2004,73:61-72.
[14]Hageman NS,Toga AW,Narr KL,et al.A diffusion tensor imaging tractography algorithm based on Navier-Stokes fluid mechanics[J].IEEE Trans Med Imaging,2009,28:348-360.
[15]窦郁,郭顺林,韩鸿宾,等.小脑上脚纤维交叉MR扩散加权成像研究[J].临床放射学杂志,2010,29(11):1445-1448.
[16]覃媛媛,张顺,张妍,等.缺血性脑梗死双指数ADC值的参数化研究[J].放射学实践,2013,28(3):264-267.
[17]马得廷,王君霞,孔庆奎,等.中脑脚间区弥散加权成像信号与表观弥散系数的分析研究[J/CD].中华临床医师杂志(电子版),2014,8(2):199-204.
[18]马得廷,王君霞,张有军,等.脑干急性梗死与小脑上脚交叉弥散高信号的表观弥散系数的对比研究[J/CD].中华临床医师杂志(电子版),2015,9(4):598-601.
[19]Bhagat YA,Hussain MS,Stobbe RW,et al.Elevations of diffusion anisotropy are associated with hyper-acute stroke:a serial imaging study[J].Magn Reson Imaging,2008,26:683-693.
[20]倪建明,黄钢,沈天真,等.缺血性脑梗死扩散各向异性的时间演变规律[J].临床放射学杂志,2009,28(7):899-903.
Comparative study of fractional anisotropy and apparent diffusion coefficient values between superior cerebellar pedun-cle (SCP)and decussation of SCP on diffusion tensor imaging
FU Minfeng,XU Hongxia.Department of Radiology,the People’s Hospital of Zoucheng City,Zoucheng,273500,China.
Objective:This study is to compare the fractional anisotropy(FA)and apparent diffusion coefficient(ADC)values between superior cerebellar peduncle(SCP)and decussation of SCP(DSCP).Methods:Axial FA maps and ADC maps of 100 neurologically normal subjects(47 men,53 women;age range:22-78 years,mean age:52.4 years)using diffusion tensor imaging(DTI)were evaluated retrospectively.Measurement of the FAs and ADC values was done by two radiologists and by placing circular ROIs in the SCP and DSCPs.Paried-Sample t-test was used to evaluate the difference of FA and ADC values of SCP and DSCP.Results:In 100 healthy patients,the mean FA value was significantly higher in the SCP(0.710±0.049)than in the DSCP(0.514±0.042),the difference was significant(t=37.165,P=0.000).The mean ADC value was significantly higher in the SCP (759.59±30.87×10-6mm2/s)than in the DSCP (723.86±36.33×10-6mm2/s),the difference was significant(t=8.128,P= 0.000).Conclusion:Both FA and ADC values of the DSCP are lower than those of the SCP,which show structural difference between SCP and DSCP.
Diffusion tensor imaging;Magnetic resonance imaging;Anisotropy anisotropy;Apparent diffusion coefficient;Superior cerebellar peduncle
10.3969/j.issn.1672-0512.2015.05.006
付民峰,E-mail:670073520@qq.com。
2015-04-17)
