前列腺中央腺体癌3.0 T MRS的初步研究
2015-03-22安宏斌赵粤东
安宏斌,赵粤东
(山东省泰安市中医医院CT室,山东 泰安 271000)
论著
前列腺中央腺体癌3.0 T MRS的初步研究
安宏斌,赵粤东
(山东省泰安市中医医院CT室,山东 泰安 271000)
目的:分析前列腺中央腺体癌3.0 T MRS表现,探讨其诊断价值。方法:回顾性分析经手术病理证实的11例前列腺中央腺体癌的3.0 T MRI及MRS表现,比较中央腺体癌区及非癌区(胆碱+肌酸)/枸橼酸盐[(Cho+Cre)/Cit]的比值。结果:MRI检查11例均表现为中央腺体增大;2例中央腺体区信号不均匀,见不规则低信号;8例中央腺体区示低、稍高混杂信号结节;1例中央腺体区弥漫性低、等混杂信号结节,侵入外周带。MRS测得中央腺体癌区(Cho+Cre)/Cit值为2.75±1.34,范围1.12~5.67;非癌区(Cho+Cre)/Cit值为0.65±0.32,范围为0.17~0.98,两者差异有统计学意义(P<0.05)。结论:前列腺中央腺体癌3.0 T MRI信号复杂多样,常规序列不易检出、定性困难;MRS能提供中央腺体癌的代谢信息,有助于提高中央腺体癌的诊断水平。
前列腺肿瘤;磁共振波谱学
前列腺癌是老年男性常见的恶性肿瘤之一,25%~30%发生在中央腺体[1]。中央腺体也是前列腺增生的好发部位,两者鉴别诊断在临床上一直是个难题。MRS是一种反映前列腺代谢、生化水平及化合物定量分析的无创性检查方法,在常规MRI基础上加MRS代谢信息能显著提高前列腺病变诊断的准确率[2-4]。目前国内对前列腺中央腺体癌的研究较少,本研究通过回顾性分析我院2012年9月至2014年10月经手术病理证实的11例前列腺中央腺体癌患者临床及影像学资料,分析其MRI和MRS特征,为临床鉴别诊断提供依据。
1 资料与方法
1.1 一般资料 本组11例,年龄62~83岁,平均73.8岁。主诉:排尿困难,夜尿增多,血尿。直肠指检前列腺增大。血清前列腺特异抗原(PSA)4.5~360 ng/mL。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3. 0 T超导型MRI成像系统,腹部相控阵线圈,行前列腺轴位T1WI及轴位、矢状位、冠状位T2WI抑脂扫描。扫描参数:T1WI TR 600 ms,TE 11 ms,层厚3 mm,无间隔,FOV 25 cm×25 cm,矩阵230×320,NEX 4;T2WI TR 3760ms,TE 96ms,层厚3mm,无间隔,FOV 25 cm×25 cm,矩阵230×320,NEX 4,回波链19。MRS检查在平扫轴位抑脂T2WI的基础上行扫描定位。3D矩形ROI范围尽量包括前列腺组织,避开周围脂肪、静脉丛及直肠气体。ROI边缘加8条饱和带。扫描前行常规预扫描,包括自动匀场和抑制水信号。扫描参数:TR 3 800 ms,TE 85 ms,FOV 25 cm× 25 cm,翻转角90°,层厚3 mm,无间隔,NEX 4;体素2.5 mm×2.5 mm×2.5 mm。
1.3 数据测量 扫描完成后,软件行自动后处理。在癌结节内选取体素,计算出所有体素(胆碱+肌酸)/枸橼酸盐[(Cho+Cre)/Cit]值的平均值作为癌区的[(Cho+Cre)/Cit]值;选取中央腺体非癌区(肿瘤旁组织判断不明确者不用)每个可用体素,计算出所有体素(Cho+Cre)/Cit值的平均值作为非癌区(Cho+ Cre)/Cit值。选取体素标准:该体素完全位于ROI内;不包括尿道及尿道周围腺体;主要代谢物的波谱SNR≥5;主要代谢物的谱峰未受到脂质峰污染。
1.4 统计学方法 采用SPSS 16.0软件进行统计处理。前列腺中央腺体癌区与非癌区(Cho+Cre)/Cit值比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 组织病理学检查 本组11例,10例单发,1例为2枚癌结节。10例病灶位于中央腺体区,1例侵犯外周带。
2.2 MRI表现 11例均表现为中央腺体肥大,外周带受压。2例中央腺体区信号不均,见不规则低信号灶;8例示中央腺体区低、稍高混杂信号结节;1例示中央腺体区弥漫性低、等混杂信号结节,边界欠清,侵入外周带(图1a,2a)。
2.3 MRS检测结果 11例癌区的MRS与非癌区相比均表现为不同程度的Cho升高,Cit降低,Cit波峰低于Cho+Cre波峰(图1b,2b)。2例癌区Cho明显升高,结节内个别体素Cit波峰极低,降至噪声水平。癌区(Cho+Cre)/Cit值范围为1.12~5.67,平均2.75± 1.34;非癌区Cho及Cit波峰变化不明显,(Cho+Cre)/ Cit值范围为0.17~0.98,平均0.65±0.32。两者(Cho +Cre)/Cit值比较,差异有统计学意义(t=0.569,P<0.05)。
3 讨论
前列腺可分为前部纤维肌性基质、尿道周围腺体、移行带、中央带及周围带。MRI尚难区分前列腺各解剖带,因此将前列腺分成中央腺体(包括尿道周围腺体、移行带及中央带)及周围带。前列腺癌及前列腺增生是老年男性常见疾病,70%~75%的前列腺癌发生于外周带,25%~30%发生于中央腺体;前列腺良性结节性增生主要发生于移行带。
前列腺中央腺体癌的检出及与前列腺增生结节的鉴别诊断在临床上一直是个难题。T2WI上中央腺体癌因组织分化程度不同,可表现为由低到高不同的信号,与周围组织信号对比不明显。部分中央腺体癌病灶较小时,常规MRI检查常无法显示。同时,前列腺中央腺体多有不同程度的增生,当中央腺体癌呈结节状时,与前列腺增生常难区分[5]。中央腺体癌信号复杂多样,无特异性,只有侵犯至外周带及周围结构时才可诊断。李桂萍等[6]认为常规MRI难以从增生的中央腺体中明确前列腺癌的位置及受侵范围。部分发生于中央腺体的良性病变,如前列腺炎、出血等亦表现为低信号,易造成误诊。常规MRI对前列腺中央腺体的癌变检出率较低,在前列腺治疗后,一些非癌变区域和癌变区域均呈低信号,不利于术后追踪和评价[7]。
MRS是反映前列腺代谢、生化水平及化合物定量分析的无创性检查方法,能够提供前列腺代谢产物信息,主要是Cit、Cho及Cre的空间分布信息及其含量,可发现小而隐匿的前列腺癌灶,充分评价肿瘤大小及范围,有助于前列腺癌的定性[8]。Cho、Cre含量及(Cho+Cre)/Cit值是诊断前列腺癌的主要指标。欧美国家前列腺疾病发病率较高,因此较早开展了许多相关性工作,且3.0 T MRI在临床上已经广泛应用[9-12],国内目前仍以1.5 T MRI为主。近来,Keshari等[13]利用超极化13C标记的乳酸作为人前列腺癌组织切片的生物标记物进行MRS研究,认为可以用超极化13C标记的丙酮酸探测重组葡萄糖、标记乳酸来探索前列腺癌的代谢变化。Lagemaat等[14]利用超高场7.0 T MRI31P-MRS技术对前列腺癌进行研究,认为前列腺癌和正常组织中含P的代谢产物明显不同,此研究有助于前列腺良恶性病变的鉴别诊断。国内前列腺癌的MRS研究已有较多报道,但大多集中在外周带,针对中央腺体病变,尤其是中央腺体癌的研究较少。有学者[15-16]发现,中央腺体癌的(Cho+Cre)/Cit值大于非癌区且差异显著,但研究是在1.5 T MRI上进行的。1.5 T MRI检查前列腺具有图像SNR较低、检查时间长等缺点。直肠内线圈的应用,虽增加了SNR及对代谢物的敏感性,但易受脂质峰影响,干扰因素多(运动伪影、近场效应伪影等),且检查时间较长、操作繁琐,患者较难耐受,临床应用受到限制。
3.0 T MRI可进一步提高图像SNR、空间分辨力及对前列腺代谢物的敏感性,无需使用直肠内线圈,能更清晰地显示前列腺癌及其波谱变化,且与使用直肠内线圈的定性效能接近,临床应用具有可行性[8,17-19]。笔者应用3.0 T MRI,MRS显示中央腺体癌区与非癌区相比,均表现为不同程度的Cho升高,Cit降低,Cit波峰低于Cho+Cre波峰,(Cho+Cre)/Cit值大于非癌区。本研究中癌区Cho水平高于非癌区,且部分前列腺癌的个别体素Cit波峰极低,可降至噪声水平,与文献[1,4,19]报道一致,这对前列腺癌可能具有特异性诊断价值。
文献[20-21]报道,前列腺中央腺体的增生病理组织变异较大,其MRS特点也有较大差异。基质增生型前列腺增生的Cit水平较低,类似前列腺癌。增加了MRS对前列腺中央腺体癌的检测及定性难度。
本研究不足:①为回顾性分析,基于明确的中央腺体癌,而非前瞻性研究,缺乏不同阶段癌灶的代谢物研究;②对照组是中央腺体非癌区,不是前列腺增生结节;③样本数量较少,仅为初步研究,尚需进行大样本研究以获得最佳稳定可靠的结论。

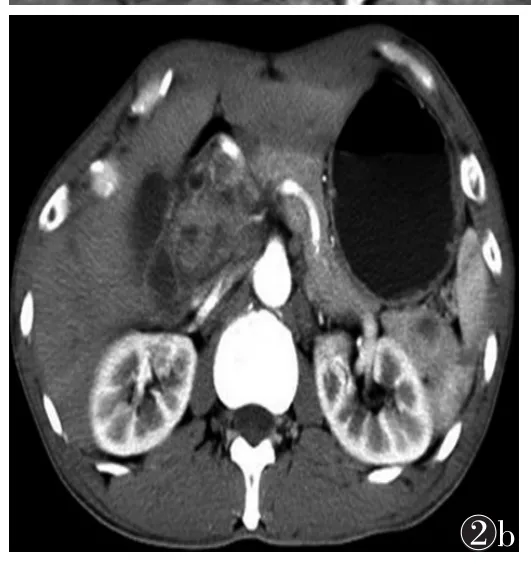
图1 男,68岁,前列腺癌 图1a 轴位T2WI抑脂序列示中央腺体弥漫性低等混杂信号,累及外周带 图1b MRS示Cho高耸,Cit峰降低,(Cho+Cre)/Cit值为1.92(Cho:胆碱;Cit:枸橼酸盐;Cre:肌酸) 图2 男,73岁,前列腺癌 图2a 轴位T2WI抑脂序列示中央腺体见低、稍高混杂信号结节 图2b MRS示Cho峰高耸,Cit峰降低,(Cho+Cre)/Cit值为1.79
[1]李飞宇,王霄英,丁建平,等.中国男性良性前列腺增生的MR波谱定量分析[J].中华放射学杂志,2005,39(4):390-393.
[2]Kurhanewicz J,Vigneron DB,Males RG,et al.The prostate:MR imaging and spectroscopy:Present and future[J].Radiol Clin North Am,2000,38:115-138.
[3]Wetter A,Engl TA,Nadjmabadi D,et al.Combined MRI and MR spectroscopy of the prostate before radical prostatectomy[J]. AJR Am J Roentgenol,2006,187:724-730.
[4]Westphalen AC,Coakley FV,Qayyum A,et al.Peripheral zone prostate cancer:accuracy of different interpretative approaches with MR and MR spectroscopic imaging[J].Radiology,2008,246:177-184.
[5]周康荣,陈祖望.体部磁共振成像[M].上海:复旦大学出版社,2008:1127-1134.
[6]李桂萍,刘剑羽.MRI对前列腺癌及增生性疾病的诊断价值及其与病理对照研究[J].实用放射学杂志,2008,24(6):793-795.
[7]Hricak H,Choyke PL,Eberhardt SC,et al.Imaging prostate cancer:a multidisciplinary perspective[J].Radiology,2007,243:28-53.
[8]Scheenen TW,Heijmink SW,Roell SA,et al.Three-dimensional proton MR spectroscopy of human prostate at 3.0T without endorectal coil:feasibility[J].Radiology,2007,245:507-516.
[9]Kitajima K,Kaji Y,Fukabori Y,et al.Prostate cancer detection with 3 T MRI:Comparison of diffusion-weighted imaging and dynamic contrast-enhanced MRI in combination with T2-weighted imaging[J].J Magn Reson Imaging,2010,31:625-631.
[10]Kim CK,Park BK,Kim B.High-b-value diffusion-weighted imaging at 3 T to detect prostate cancer:comparisons between b values of 1,000 and 2,000 s/mm2[J].AJR Am J Roentgenol,2009,194:33-37.
[11]Kim CK,Park BK,Park W,et al.Prostate MR imaging at 3T using a phased-arrayed coil in predicting locally recurrent prostate cancer after radiation therapy:preliminary experience[J]. Abdominal Imaging,2010,35:246-252.
[12]Mazaheri Y,Vargas HA,Nyman G,et al.Diffusion-weighted MRI of the prostate at 3T:comparison of endorectal coil(ERC)MRI and phased-array coil(PAC)MRI-the impact of SNR on ADC measurement[C].ISMRM,Salt Lake city,USA,2013:3396.
[13]Keshari KP,Sriram R,Van Criekinge M,et al.Validation of hyperpolarized 13C lactate as a prostate cancer biomarker using a human prostate tissue slice culture bioreactor[C].ISMRM,Salt Lake city,USA,2013:3429.
[14]Lagemaat MW,Vos EK,Mass MC,et al.31P MR spectroscopic imaging of patients with prostate cancer at 7 T[C].ISMRM,Salt Lake city,USA,2013:3403.
[15]王希明,白人驹,孙浩然,等.中央腺体内前列腺癌3D1H-MRSI的初步研究[J].临床放射学杂志,2006,25(4):332-226.
[16]陆健,王霄英,张学琴,等.前列腺中央腺体癌的MRS及DWI表现及误诊分析[J].临床放射学杂志,2012,31(3):390-393.
[17]Chen AP,Cunningham CH,Kurhanewicz J,et al.High resolution 3D MR spectroscopic imaging of the prostate at 3 T with the MLEV2-PRESS sequence[J].Magn Reson Imaging,2006,24:825-832.
[18]Heijmink SW,Futterer JJ,Hambrock T,et al.Prostate cancer:body-array versus endorectal coil MR imaging at 3T-comparison of image quality,localization,and staging performance[J].Radiology,2007,244:184-195.
[19]李新民,王霄英,郭雪梅,等.前列腺癌的MR波谱成像中体线圈与直肠内线圈的比较[J].中华放射学杂志,2009,43(11):1165-1169.
[20]Zakian KL,Eberhardt S,Hricak H,et al.Transition zone prostate cancer:metabolic characteristics at 1H-MR spectroscopic imaging--initial results[J].Radiology,2003,229:241-247.
[21]GarCia-Segura MJ,Sanchez-Chapado M,Ibarburen C,et al.In vivo proton magnetic resonance spectroscopy of diseased prostate:spectroscopic features of malignant versus benign pathology[J]. Magn Reson Imaging,1999,17:755-765.
Preliminary study of 3.0 T MRS features in prostatic central cancer.
AN Hongbin,ZHAO Yuedong.Division of CT,Tradi-tional Chinese Medicine Hospital of Tai’an City,Taian,271000,China.
Objective:To analyze the characteristics of 3.0 T MRS in prostatic central gland cancer and evaluate the value of MRS in diagnosis of prostatic central gland cancer.Methods:3.0 T MRI and MRS findings were reviewed retrospectively in 11 patients with pathologically-confirmed prostatic central gland cancer,and the(choline+creatine)/citrate[(Cho+Cre)/Cit]ratio of the central gland cancer regions and non-cancer regions were compared.Results:Enlargement of central gland was found in MRI of 11 cases.In 2 cases,the signal in central gland was uneven and irregular low signal was found;In 8 cases,low-slight high mixed signal nodular lesions were found;In 1 case,diffuse low-equal mixed signal nodule was found invading peripheral zone.The ratio of(Cho+Cre)/Cit and the range in cancerous and noncancerous regions were 2.75±1.34,1.12~5.67 and 0.65± 0.32,0.17~0.98,respectively.The difference in ratio between the two groups was statistically significant(P<0.05).Conclusion:3.0T MRI signal of prostatic central cancer is complicated.It is not easy to be detected and diagnosed by the routine MRI. MRS can provide the metabolic information of central gland cancer,which is very helpful for the diagnosis of central gland cancer.
Prostate neoplasms;Magnetic resonance spectroscopy
10.3969/j.issn.1672-0512.2015.05.001
安宏斌,E-mail:ctanhongbin2006@163.com。
2014-06-21)
