右旋糖苷修饰胰蛋白酶条件优化及性质研究
2015-03-20黄继红张龙飞王文
黄继红,张龙飞,王文
(1.河南工业大学生物工程学院,河南 郑州 450001;2.河南省食品工业科学研究所,河南 郑州 450003)
右旋糖苷修饰胰蛋白酶条件优化及性质研究
黄继红1,2,张龙飞1,王文1
(1.河南工业大学生物工程学院,河南 郑州 450001;2.河南省食品工业科学研究所,河南 郑州 450003)
由于天然酶其异源蛋白的抗原性、易受蛋白酶水解、酶活性较低、稳定性差等原因,严重影响胰蛋白酶的应用范围和效果。为了获取理化性质更稳定的胰蛋白酶,研究了右旋糖苷修饰胰蛋白酶的反应条件和胰蛋白酶修饰前后的酶学性质。结果表明右旋糖苷修饰胰蛋白酶的最优反应条件为:右旋糖苷与胰蛋白酶的摩尔比为1∶2,修饰反应最适pH为8.0,最适反应温度为35℃,最佳修饰时间为4 h,胰蛋白酶保留酶活力56.1%,修饰率为49.2%。修饰后的胰蛋白酶适合温度、pH值范围变大,热稳定性和酸碱稳定性明显的提高。因而右旋糖苷修饰胰蛋白酶能够增强胰蛋白酶的热稳定性和酸碱稳定性,为胰蛋白酶的修饰提供理论参考并扩展蛋白酶的工业应用价值。
胰蛋白酶;右旋糖苷;化学修饰;酶学性质
胰蛋白酶(EC 3.4.21.4)是丝氨酸蛋白水解酶类中的一种重要类型。在众多蛋白质水解酶中,胰蛋白酶的应用十分广泛,需求量十分大,年消耗量就占到了酶制品市场的3%左右,被广泛应用于食品业、医药业、纺织业和现代生物技术等领域[1-2]。但由于天然酶其异源蛋白的抗原性、易受蛋白酶水解、酶活性较低、稳定性差等原因,严重影响胰蛋白酶的应用范围和效果。通过化学修饰技术可以对酶分子的结构进行改造,弥补自然酶的不足,使酶发挥出更高的催化效能,以满足工业中对酶的各种需求。通过对酶蛋白分子主链或侧链上的基团进行改造,引入或除去某些化学基团,使酶蛋白的结构发生变化,以此改善酶的性质。目前应用最广泛的酶化学修饰技术就是大分子结合修饰技术,可获得具有工业应用价值的酶[3]。多糖类大分子在酶化学修饰中的应用十分广泛,常见的大分子修饰剂有右旋糖苷、蔗糖、肝素、环糊精及其衍生物[4]。蛋白酶的稳定性主要依赖于疏水相互作用以及热力学原理,在酶分子中引入多个共价键可强化蛋白质的构象,通过大分子遮蔽减少酶分子表面非极性基团增加其稳定性[5-6],多糖类大分子修饰剂最常用的活化方法是高碘酸钠氧化法[7-12]。用化学修饰技术增强酶的耐受性,改善酶的催化效能已成为国际上一个重要的研究热点[13]。国内在胰蛋白酶的固定技术和大分子修饰等方面做的研究比较多,尤其是随着新型材料的开发,这些研究技术也会越来越完善[14]。因此,进一步探索对提高工业生产用酶催化效能的化学修饰技术有重要的意义。
1 材料与方法
1.1 实验材料
北京北分瑞利分析仪器;冷冻干燥机(FD—1),北京博医康实验仪器;可见分光光度计(723N),上海精密科学仪器有限公司;胰蛋白酶(250 U/mg),北京鼎国昌盛生物;右旋糖苷(Aw 40000),Aladdin Industrial Corporation;酪蛋白(生物试剂),上海化学试剂;高碘酸钠、亚硫酸氢钠、盐酸羟胺、硼酸、L-赖氨酸等均为分析纯试剂。
1.2 实验方法
右旋糖苷的活化:称取右旋糖苷及等摩尔(相对于右旋糖苷分子上的小分子葡萄糖单位)的高碘酸钠适量,用蒸馏水溶解,避光,42℃水浴加热,振荡至黄色液体生成,滴加5%的NaHSO3溶液还原溶液中过量的NaIO4,继续震荡10 min,以纯化水为介质,以截留分子量为8 000~14 000的透析袋4℃透析4 h,得活化右旋糖酐溶液。
活化右旋糖苷化学修饰胰蛋白酶:在5.0 mg/ mL的酶液(用硼酸或磷酸缓冲液配制)中加入一定量活化的右旋糖苷,同时按质量浓度1 mg/L加入酪蛋白底物,在一定的条件下进行修饰反应,然后滴加1.0 mL NaBH4(50mg/mL)终止反应,水透析4 h,冷冻干燥既得修饰的胰蛋白酶。
活化右旋糖苷的醛基含量测定:精密称取一定量的活化右旋糖苷,加入并溶解于25mL 0.25 mol/L的盐酸羟胺溶液中(含甲基橙0.05%),室温下放置3 h,以标准氢氧化钠溶液(0.1mol/L)滴定,直至红色变为黄色,并作空白校正。一分子活化右旋糖苷含醛基的数量即为1 mol活化右旋糖苷含有的醛基摩尔数,公式为:
醛基数=(V1-V0)×N×M w/1 000W
式中:V1为样品液消耗氢氧化钠液的体积(L);V0为空白液消耗氢氧化钠液的体积(L);N为氢氧化钠的摩尔浓度;M w为葡聚糖链上葡萄糖单位的重量(160);W为葡聚糖的质量(g)。
胰蛋白酶修饰酶的酶活测定及修饰率的测定:
1)酶活的测定:设置温度为37℃,取2 mL酶液,加入5 mL 2%酪蛋白溶液,反应15 min后加入2mL 10%三氯乙酸溶液终止水解反应,静置10min后离心,取上清液稀释,测量280 nm处的吸光度。将每分钟催化酪蛋白水解生成1μg酪氨酸的量定义为一个活力单位[16]。修饰酶的残留酶活力:以未修饰自然酶的酶活力为100%,计算各修饰酶的残留酶活力(100%)。
残留酶活=修饰酶酶活/自然酶酶活×100%
2)修饰酶修饰率的测定:采用2,4,6-三硝基苯磺酸(TNBS)法测定胰蛋白酶的氨基修饰率。2,4,6-三硝基苯磺酸能够与胰蛋白酶表面的赖氨酸ε-氨基发生反应。该反应生成的三硝基苯衍生物在420 nm有特征吸收峰,通过该反应可以计算出胰蛋白酶的自由氨基数目。空白组:取2.0 mL TNBS至3.0 mL双蒸水中,混合均匀后,室温放置40min,再加入1 mol/L的盐酸0.5mL;自然酶组:取2.0 mL TNBS至3.0 mL自然酶中,混合均匀后,室温放置40 min,再加入1mol/L的盐酸0.5 mL终止反应,420 nm处测定吸光度值A0;修饰酶组:取2.0 mL TNBS至3.0mL修饰酶中,混合均匀后,室温放置40 min,再加入1 mol/L的盐酸0.5mL终止反应,420 nm处测定吸光度值A1修饰率=(A0-A1)/A0×100%
右旋糖苷对胰蛋白酶修饰条件的优化:
1)修饰剂与胰蛋白酶的摩尔比例:在37℃、pH 7.0的条件下,按照3∶1,2∶1,1∶1,1∶2,1∶3,1∶4的摩尔比例加入胰蛋白酶和活化右旋糖苷,同时按质量浓度为1mg/L的标准加入酪蛋白底物,反应3 h,然后滴加1.0 m L NaBH4(50 mg/mL)终止反应,水透析4 h,测定胰蛋白酶残留酶活和氨基修饰率。
2)pH值对修饰结果的影响:在37℃、pH值分别为5.0、6.0、7.0、8.0、9.0的条件下,按照上述实验所得的最优比例加入胰蛋白酶和活化右旋糖苷,同时按质量浓度为1mg/L加入酪蛋白底物,反应3 h,然后滴加1.0mLNaBH4(50mg/mL)终止反应,水透析4 h,测定并计算不同pH条件反应下的胰蛋白酶残留酶活和氨基修饰率。
3)修饰温度对修饰结果的影响:按照1)和2)所得的最佳修饰反应条件设置反应pH和加入胰蛋白酶与活化右旋糖苷,设置反应温度分别为25、30、35、40、45、50℃,同时按质量浓度为1mg/L加入酪蛋白底物,修饰3 h,然后滴加1.0mLNaBH4(50 mg/mL)终止反应,水透析4 h,测定并计算各温度条件下的胰蛋白酶残留酶活和氨基修饰率。
4)修饰时间对修饰结果的影响:平行取六组胰蛋白酶和活化右旋糖苷,按照实验1)、2)和3)所得的最佳修饰反应条件设置胰蛋白酶与活化右旋糖苷的比例、反应pH、温度,同时按质量浓度1 mg/L加入酪蛋白底物,反应时间分别为1、2、3、4、5、6 h,然后滴加1.0 mLNaBH4(50mg/mL)终止反应,水透析4 h,测定并计算各时间段胰蛋白酶的残留酶活和氨基修饰率。
1.3 胰蛋白酶修饰前后的性质研究
1)胰蛋白酶修饰前后最适反应温度的测定比较:设置22、26、30、34、38、42、46、50℃8个温度梯度,在各温度下将底物酪蛋白溶液保温5min后,分别加入胰蛋白酶与修饰酶(酶液pH为8.0),反应15 min,TCA沉淀未水解蛋白,然后在650 nm下测吸光度。定义各自最高的胰蛋白酶活力为100%,计算出不同温度条件下各自胰蛋白酶的相对活性,即剩余酶活占最高酶活力的百分比。
2)胰蛋白酶修饰前后最适pH范围的测定比较:设置6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10共8个pH梯度,取天然酶和修饰酶,以酪蛋白为底物,最适温度下,反应15min,TCA沉淀未水解蛋白,然后在650 nm下测吸光度。定义各自最高的酶活力为100%,计算出不同pH条件下各自胰蛋白酶的相对活性,即酶活占最高酶活力的百分比。
3)胰蛋白酶修饰前后热稳定性的比较:取适量胰蛋白酶天然酶和修饰酶,在80℃保温,取不同保温时间的胰蛋白酶,以酪蛋白为底物测定其胰蛋白酶活性。定义各自最初的酶活力为100%,计算不同保温时间的胰蛋白酶的相对活性,即酶活占最高酶活力的百分比。
4)胰蛋白酶修饰前后酸碱稳定性的比较:在25℃下,设定4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0共8个pH梯度,将胰蛋白酶天然酶与修饰酶分别在各pH条件保存30 min,以酪蛋白为底物测定其胰蛋白酶活性。定义各自最高的酶活力为100%,计算各pH条件下胰蛋白酶的相对活性,即酶活占最高酶活力的百分比。
2 结果与分析
2.1 胰蛋白酶修饰条件优化
修饰剂与胰蛋白酶最佳摩尔比例的确定:随着修饰剂与胰蛋白酶摩尔比例的降低,胰蛋白酶修饰后的残留酶活逐渐降低,胰蛋白酶的修饰率逐渐增加,当修饰剂与胰蛋白酶的比例小于1∶2时,胰蛋白酶的修饰率基本保持稳定,所以修饰剂与胰蛋白酶的最佳摩尔比例为1∶2,见图1。

图1 修饰剂与胰蛋白酶的比例对酶修饰的影响
修饰反应最佳pH值的确定:由图2可知,修饰反应的pH对修饰结果具有一定的影响,当pH 8.0时,胰蛋白酶具有较好的残留酶活和修饰率。因此在pH 8.0时,胰蛋白酶和活化右旋糖酐更容易发生连接反应。

图2 pH对酶修饰的影响
修饰反应最适温度的确定:由图3可知,随着反应温度的增加,修饰后的胰蛋白酶残留酶活逐渐降低,在35℃时,胰蛋白酶具有较高的修饰率。因此认为35℃为胰蛋白酶与活化右旋糖苷最优反应温度。

图3 温度对酶修饰的影响
修饰反应最佳时间的确定:图4显示随着修饰时间的延长,胰蛋白酶的残留酶活降低,氨基修饰率都逐渐升高,修饰时间为4 h时,胰蛋白酶的修饰率基本保持稳定。因此认为4 h为最佳反应时长。

图4 修饰时间对酶修饰的影响
综合以上因素实验结果,确定右旋糖酐修饰胰蛋白酶的最优反应条件为:右旋糖苷与胰蛋白酶的摩尔比为1∶2,pH 8.0,温度为35℃,修饰时间为4 h。在以上条件下,修饰后的胰蛋白酶保留酶活力56.1%,修饰率为49.2%。
2.2 胰蛋白酶修饰前后性质分析
胰蛋白酶修饰前后最适温度:由图5可知,以酪蛋白为底物时,胰蛋白酶的最适温度为38℃,经过活化右旋糖苷修饰后的胰蛋白酶修饰酶的最适温度未改变。由此可知,右旋糖酐修饰胰蛋白酶后,并没有引起胰蛋白酶的活化能发生变化。

图5 胰蛋白酶修饰前后适应温度比较
胰蛋白酶修饰前后最适pH范围:由图6可知,以酪蛋白为水解底物时,胰蛋白酶自然酶的最适pH范围为7.5~8.5,经过活化右旋糖苷修饰后的修饰酶的最适pH范围为8~9.5。这可能是因为右旋糖苷与胰蛋白酶表面的碱性氨基酸残基的侧链氨基发生共价结合反应,右旋糖苷的引入导致胰蛋白酶分子表面的电荷分布发生变化,从而影响胰蛋白酶的最适pH范围。

图6 胰蛋白酶修饰前后适应pH比较
胰蛋白酶修饰前后的热稳定性:由图7可知,随着热处理时间的增加,胰蛋白酶自然酶与修饰酶的酶活力均呈下降趋势。但是修饰酶的下降幅度较小,自然酶的下降幅度较大。保温30min后,胰蛋白酶自然酶与修饰酶的残留酶活分别为39.6%和60.4%,说明修饰酶的热稳定性比自然酶有明显提高。当酶受热时,酶分子内基团之间的相互作用会发生变化,原本的的平衡被破坏,酶分子的天然构象就向热力学上熵值高的方向变化,即从紧密有序趋于随机松散,折叠结构打开,最终导致了酶活性的降低甚至失活。而修饰剂含有多个活性反应基团,能够与酶形成多点交联,使酶的天然构象产生“刚性”,从而增强了酶的热稳定性。这表明氧化右旋糖苷修饰胰蛋白酶对提高胰蛋白酶的热稳定性有较为突出的作用。
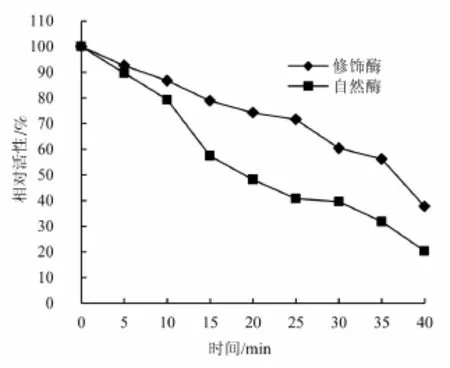
图7 胰蛋白酶修饰前后热稳定性
胰蛋白酶修饰前后的酸碱稳定性:由图8可以看出,胰蛋白酶自然酶与修饰酶的变化趋势大致相同。胰蛋白酶自然酶在pH 7~8.5范围内比较稳定,胰蛋白酶修饰酶在pH 7~10范围内比较稳定,残留酶活保持在90%以上,可见修饰酶保留较高酶活的pH范围明显比自然酶大;当pH高于10时,自然酶的酶活下降幅度比较大,而修饰酶的酶活下降趋势较平缓。这说明用右旋糖苷修饰胰蛋白酶对提高胰蛋白酶的酸碱稳定性有明显的作用。

图8 胰蛋白酶修饰前后酶酸碱稳定性
3 讨论
蛋白酶经过化学修饰其各种酶学性质通常会发生一定改变,本实验以高碘酸钠活化的右旋糖苷T-40对胰蛋白酶进行化学修饰后,胰蛋白酶最适温度没有改变,最适pH值、热稳定性和酸碱稳定性都有了较明显的提高。
大多胰蛋白酶经修饰后,其生物活性有一定程度的降低。影响因素有很多,主要取决于氨基修饰率及修饰胰蛋白酶构象和电荷的影响。本实验处于起步阶段,研究相对肤浅,修饰率也不高,下一步需要继续优化修饰条件,并通过电泳和红外扫描,验证修饰后的胰蛋白酶分子量和基团的变化。
[1]黎春怡,黄卓烈.化学修饰法在酶分子改造中的应用[J].生物技术通报,2011(9):39-43.
[2]李秀娟.胭脂鱼胰蛋白酶的分离纯化与化学修饰研究[D].重庆:重庆师范大学,2010.
[3]凌辉生.化学修饰血红素改良血红蛋白特性的研究[D].广东:暨南大学,2011.
[4]熊亚红,吴巧儿,苏健鸿.化学修饰木瓜蛋白酶的酶学性质研究[J].分子催化,2010(6):529-536.
[5]刘建忠,宋海燕,翁丽萍,等.化学修饰改进酶的催化特性研究进展[J].分子催化,2002,16(6):475-480.
[6]翟婵婵,苏忠亮,程江峰.酶化学修饰的研究进展[J].山东化工,2014,43(1):52-53.
[7]HAFSA K E,吴梧桐,刘景晶,等.右旋糖苷及PEG-2对大肠杆菌L-天冬酰胺酶的化学修饰[J].药物生物技术,1997,4(2):118-121.
[8]朱怡然.右旋糖酐修饰Savings蛋白酶及用于羊毛防毡缩整理[D].无锡:江南大学,2012.
[9]陈忍忍.蛋白酶的化学修饰及其在羊毛防毡缩整理中的应用[D].无锡:江南大学,2012.
[10]TREETHARNMATHUROT B,OVATLARNPORN C,WUNGSINTHAWEEKUL J,et al.Chemicalmodification and thermal stability study ofβ-cyclodextrin-and PAMAM-trypsin conjugates[C].4th IEEE International Conference,2009:954-959.
[11]DORMANTM,CHERIA,LACK I,et al.Stabilization of apsychotropic in aqueous organic solvents by chemical modification with organic acid hydroxides[J].Journal of Molecular Catalysis B-Enzymatic,2009,59(1/3):153-157.
[12]刘军平.聚乙二醇修饰对去折叠胰蛋白酶的影响[D].南昌:南昌大学,2012.
[20]朱怡然,范雪荣,王强,等.右旋糖酐对Savinase蛋白酶的化学修饰及酶学性质研究[J].中国生物工程杂志,2011,31 (10):45-49.
[13]张建萍,刘恩岐.右旋糖苷对生姜蛋白酶的化学修饰及其酶学性质影响[J].食品科学,2013,34(9):228-233.
[14]ELSNER C,GRAHN S,BAUER S,et al.Effects of chemical modification of lysine residues in trypsin[J].Journal of Molecular Catalysis B-Enzymatic,2000,8(4/6):193-200.
(责任编辑:朱小惠)
Optim ization and characteristics of trypsin modified by dextran
HUANG Jihong1,2,ZHANG Longfei1,WANGWen1
(1.College of Biological Engineering,Henan University of Technology,Zhengzhou 450001,China;2.Henan Institute of Food Industry Science,Zhengzhou 450003,China)
The application ofwild trypsin is severely limited due to the antigenicity of heterologous protein,degradation by protease,low activity and poor stability.In order to obtain a trypsin with stable physical and chemical properties,themodification conditions of the trypsin by dextran and its enzymatic characteristics before and after modification were studied in this paper.The results showed that the optimal modification conditions of the trypsin by dextran were as follows:the molar ratio of dextran and trypsin 1∶2,pH 8.0,temperature 35℃,reaction time 4 h.Under the optimized conditions,the trypsin retained 56.1%of its activity.The range of optimum temperature and pH of the modified trypsin became wider and the heat stability and acid stability were significantly improved.These results indicated that thermal stability and pH stability of the trypsin modified by dextran can be improved,which provides theoretical basis for the modification of trypsin and expands its industrial application.
trypsin;dextran;chemicalmodification;enzymatic properties
Q814
A
1674-2214(2015)04-0001-05
2015-05-31
2015年河南省国际科技合作与交流项目(152102410032);郑州市国际科技合作与交流项目(141PGJHZ546)
黄继红(1965—),女,河南郸城人,教授级高级工程师,博士,主要研究方向为发酵工程,E-mail:huangjih1216@126.com.
