HMGB1 RAGE蛋白在肝癌中的表达及临床意义*
2015-03-19庄利萍范方淑
庄利萍, 于 璐, 杨 倩, 范方淑, 余 洁
(1.四川省都江堰市中医医院病理科, 四川 都江堰 611830 2.云南省昆明市第一人民医院病理科, 云南 昆明 650031 3.南方医科大学附属南海医院病理科, 广东 佛山 528200)
侵袭和转移是威胁肿瘤患者生命的主要因素,也是恶性肿瘤的基本生物学特征[1]。近年研究发现,高迁移率蛋白 B1(high-mobility group box-B1,HMGB1)是一种肿瘤转移促进基因,其表达和肿瘤的侵袭与转移有密切的关系[2]。晚期糖基化终产物受体(receptor for advanced glycation end product,RAGE)是细胞表面分子中免疫球蛋白超家族的成员之一,RAGE参与多种肿瘤细胞增殖、浸润和转移[3,4]。而 RAGE 是HMGB1的唯一受体[5]。关于 HMGB1和 RAGE蛋白在原发性肝细胞癌中的表达情况,国内外鲜有报道。本研究采用免疫组织化学和计算机图像分析技术,检测了HMGB1、RAGE蛋白在30例原发性肝细胞癌患者癌灶组织中的表达情况,并与癌旁非癌组织进行了对比,分析了HMGB1、RAGE蛋白表达与患者临床病理的相关性,以期为肝癌治疗、预后提供一定参考。
1 资料与方法
1.1 一般资料:选择2008年1月至2011年3月昆明市第一人民医院肝胆外科收治的30例原发性肝癌患者作为研究对象,30例患者中男24例,女6例,年龄36~75岁,平均(59.6±10.5)岁。瘤体<5cm 者 16 例,≥5cm者14例。以距癌灶边缘5cm为界分别留取癌灶组织和非癌组织。所有标本均经病理组织学证实为原发性肝细胞肝癌。
1.2 免疫组织化学法:兔抗人HMGB1多克隆抗体、鼠抗人RAGE单克隆抗体及S-P免疫组化试剂盒分别购自美国PTG公司,美国Santa Cruz公司、北京中杉金桥生物技术有限公司。肝癌及癌旁组织免疫组化以经典的S-P法进行(HMGB1工作浓度1∶100,RAGE工作浓度1∶200每片滴加HMGB1一抗,4℃冰箱过夜)DAB显色,以PBS液代替一抗作为阴性对照,用已证实的HMGB1染色阳性肝癌标本作为阳性对照。
1.3 结果判断
1.3.1 免疫组化:每张切片在高倍镜下(×200)随机观察5个视野,计数200个细胞/视野阳性细胞百分比,细胞核和/或细胞浆出现棕黄色或棕褐色染色颗粒判定为阳性细胞。阳性细胞数<15%为表达阴性(-),阳性细胞数15%~50%为表达弱阳性(+),阳性细胞数51%~75%为表达中等强度阳性(++),阳性细胞数>75%为表达强阳性(+++),其中阳性细胞数大于50%为过表达。同时观察组织切片染色强度并计分:无色为阴性0分,淡黄色弱阳性1分,黄色阳性2分,棕黄色为强阳性记3分。阳性细胞百分比和组织切片染色强度两项分值相乘为每例切片染色总积分,0分为阴性(-),1~4分为弱阳性(+),5~8 分为阳性(++),9~12分为强阳性(+++)。
1.3.2 计算机图像分析:应用 HPIAS-1000高清晰度病理图文分析系统定量分析免疫组化结果。每组标本均在400×放大倍数下按照无偏采样原则取5个视野,每个视野均按照无偏采样原则取5个细胞进行测定。依据阳性单位(PU)结果来判断免疫组化染色强度的差异。PU值用均值±标准差(±s)表示。
1.4 统计学分析:应用SPSS11.5统计软件进行分析。RAGE阳性表达比较用χ2检验。RAGE蛋白表达强度采用(±s)表示,采用单因素方差分析进行比较,组间多重比较采用LSD-t检验,相关分析采用Spearman等级相关,检验水准 ɑ=0.05。
2 结 果
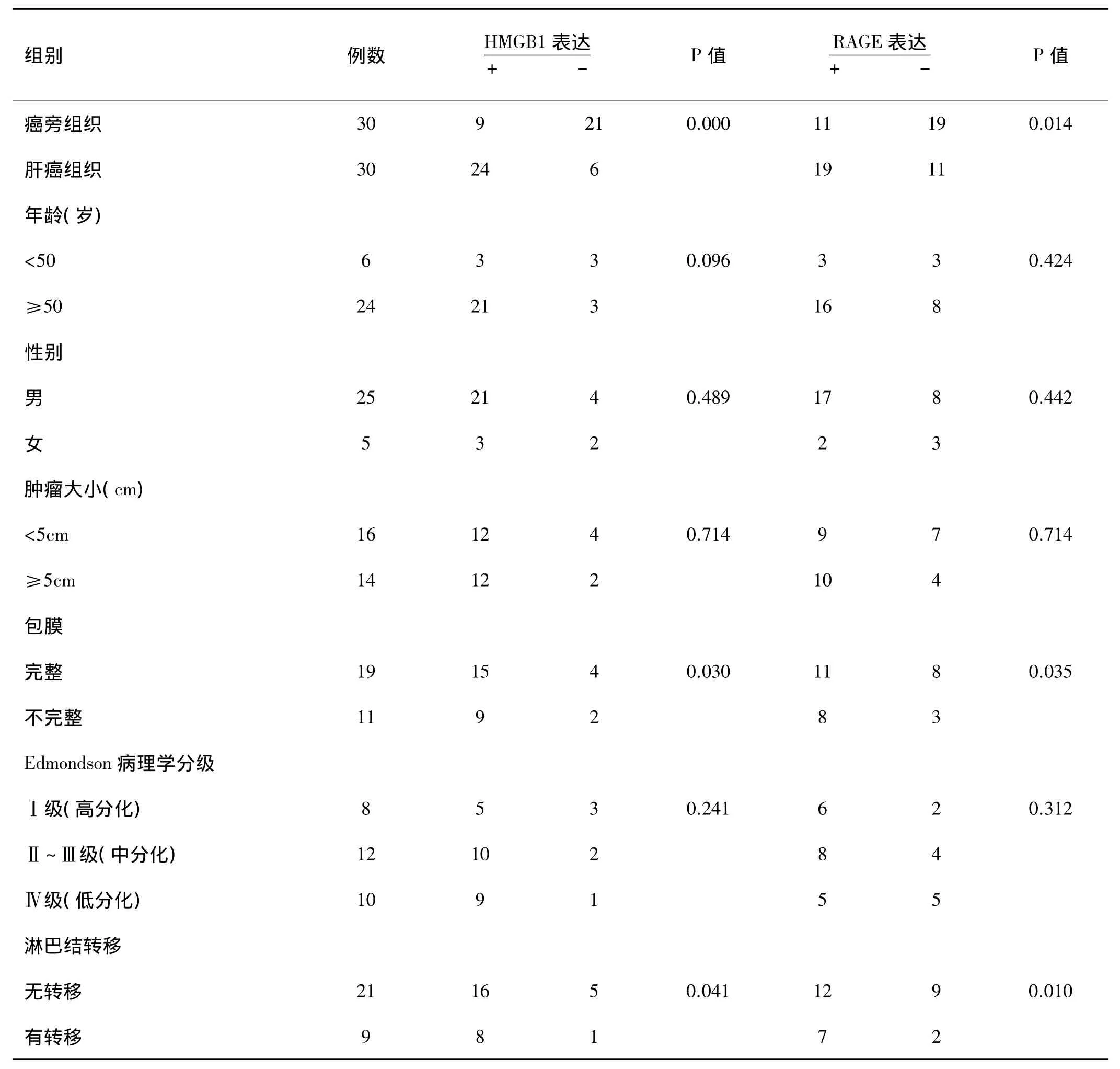
表1 HMGB1、RAGE的表达与肝癌临床病理特征的关系
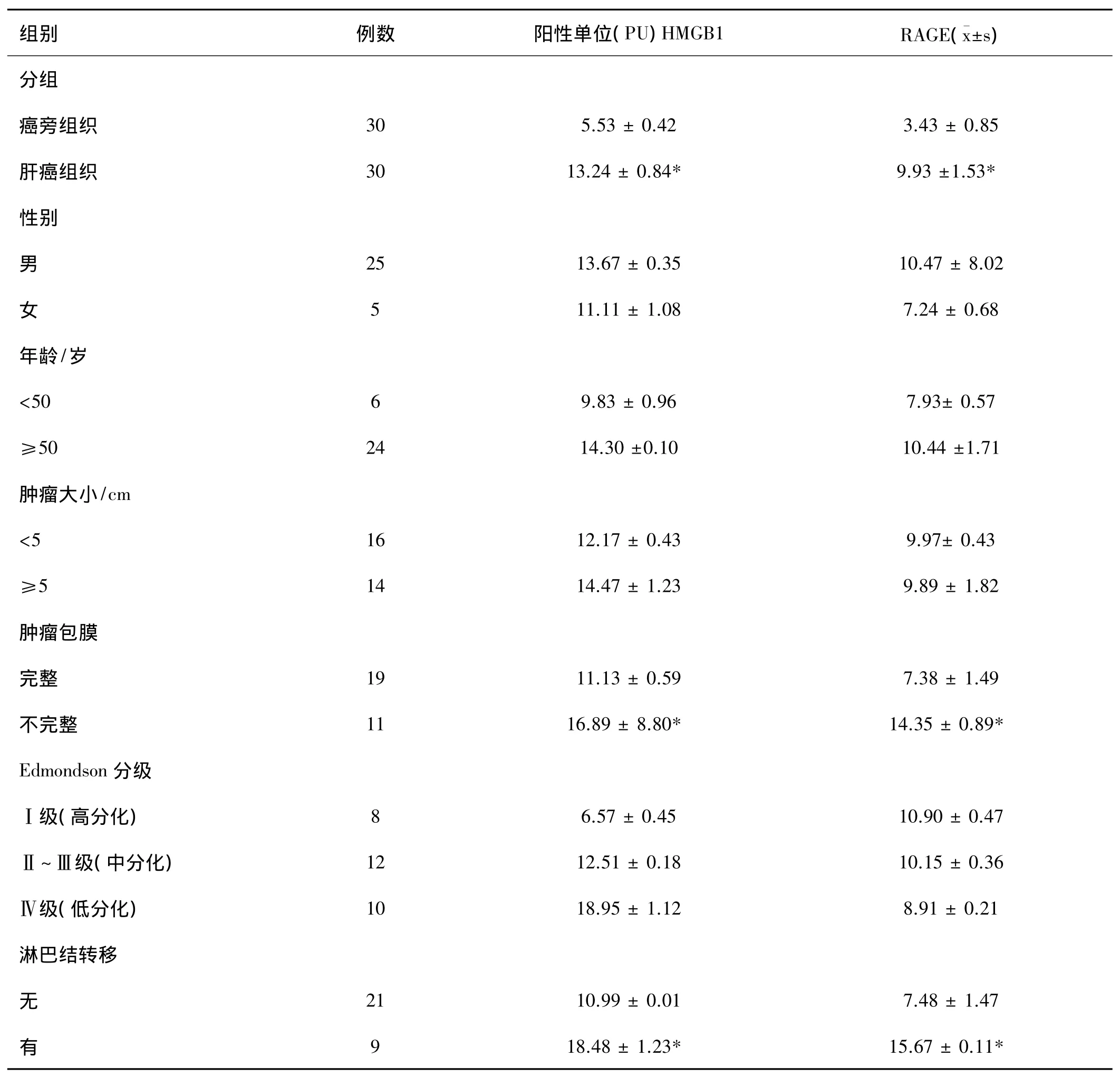
表2 HMGB1、RAGE的表达与肝癌临床病理特征的关系
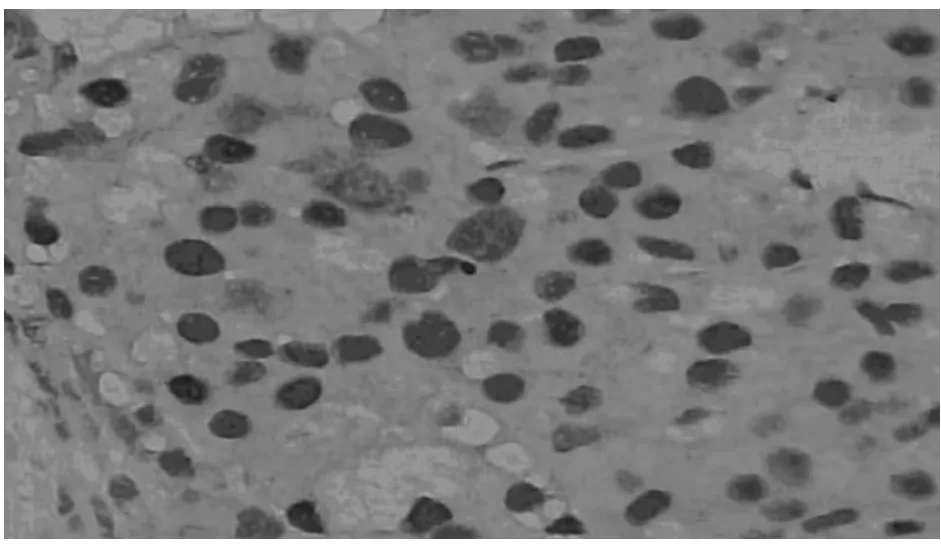
图1 HMGB1在淋巴结转移肝癌中呈阳性表达×400

图2 RAGE在淋巴结转移肝癌中呈阳性表达×400
HMGB1、RAGE的表达均与患者年龄、性别、肿瘤大小无关。肝癌伴淋巴结转移组HMGB1、RAGE的表达明显高于肝癌无淋巴结转移组,肝癌肿瘤组织包膜不完整者 HMGB1、RAGE的表达高于包膜完整者,HMGB1表达随 Edmondson分级的增加而增高,而RAGE与表达Edmondson分级无相关关系。HMGB1和 RAGE 之间的表达呈正相关(rS=0.470,P=0.000)(详见表1,2 图1)。
3 讨 论
高迁移率蛋白B1因分子量小(<30kD),在聚丙烯酰胺凝胶电泳快速迁移而被命名。HMGB1存在于绝大多数的真核细胞内,人HMGB1含215个氨基酸残基,编码基因定位于13号染色体长臂12区,其基因序列高度保守。小鼠与兔的氨基酸序列的同源性为100%,而人和啮齿动物的氨基酸序列同源性为99%。HMGB蛋白家族特征性的序列位于151~183位氨基酸,该区域可能含有结合HMGB1受体RAGE的基序[6]。HMGB1参与稳定核小体结构、DNA重组和修复、调节基因转录及类固醇激素调控等生命活动[7,8]。HMBG1广泛存在于心、脑、肾、肝、胃、脾等组织中。目前国内外研究广泛报道,HMGB1在多种肿瘤中呈过表达[2,9],如结直肠癌、乳腺癌、前列腺癌、胰腺癌、恶性黑色素瘤、头颈部鳞癌、膀胱癌等,可促进一系列转移调控基因的上调,参与肿瘤的侵袭和转移。且其配体晚期糖基化终产物受体(RAGE)在肿瘤细胞中也有相应表达[9],给予HMGB1或RAGE抑制剂,可以明显抑制肿瘤细胞的增殖[3]。RAGE[4,5]是侵袭相关基因家族的成员之一,RAGE是细胞表面分子中单跨膜蛋白,属于免疫球蛋白超家族跨膜受体,RAGE在人体内分布相当广泛,可表达于血管内皮细胞、平滑肌细胞、中性粒细胞、2型肺泡上皮细胞、肝星状细胞、多种干细胞及肿瘤细胞等,RAGE是一个与肿瘤侵袭和转移相关的蛋白,可在多种组织和细胞中表达,而且RAGE是HMGB1的唯一受体。HMGB1与RAGE有较高的亲和力,二者结合后,通过激活细胞内JNK、NF-κB、和p42/p44、Rac1/Cdc42等信号途径,进而激活MAPKs,PI3K/Akt,Rho GTP 酶,Jak/STAT,and Src family kinases(沉降红细胞家族激酶)等[10]信号传导通路,引起明胶酶A(MM P-2)和明胶酶B(MMP-9)的激活,引起纤维蛋白溶酶等系统激活,使细胞外基质降解,抑制肿瘤细胞的凋亡,促进肿瘤细胞浸润、转移,促进内皮细胞向肿瘤缺血区域移动和新生血管形成,加快肿瘤生长。因此,肝癌发病中HMGB1及其受体RAGE充当重要角色。
研究报道[11],HMGB1、RAGE 协同表达参与了多种肿瘤的侵袭及转移。Taguchi[12]等发现,HMGB1和RAGE相互作用介导C6神经胶质瘤的生长剂转移,阻断这一相互作用可以抑制神经胶质瘤的转移,减少增生、浸润,HMGB1和RAGE在结直肠癌、宫颈及食道鳞癌中的协同表达与肿瘤转移及预后不良有关。迄今为止,关于HMGB1、RAGE与肝癌相关研究的报道少见。Sakuraoka Y[13]等检测结果显示肝癌细胞株HepG2中有RAGE mRNA及其蛋白的表达,说明HMGB1能刺激人肝癌细胞株HepG2的生长、增殖。Cheng等[14]研究发现,肝细胞癌患者HMGB1的血清水平比慢性肝炎及肝硬化患者明显升高,血清HMGB1的表达与肝癌的TNM分期、病理学分级及淋巴结转移密切相关,由此可见血清HMGB1与肝细胞癌的发生、发展有关。本课题组前期的研究表明,HMGB1在肝癌组织中呈过表达,HMGB1在包膜不完整、有淋巴结转移肝癌中的表达分别高于包膜完整及无淋巴结转移者。HMGB1可能是原发性肝细胞癌的一种新的潜在的肿瘤特异性标志物。与以往学者的研究结果一致。本研究结果发现,RAGE在肝癌组织有阳性表达,而在癌旁组织中弱或无表达,统计分析发现,肝癌组织中的表达显著高于癌旁组织,差异有统计学意义(P<0.05)。以往学者研究也发现,RAGE mRNA和蛋白在肝癌组织中表达均明显升高,认为RAGE可能参与了肝细胞癌的发生和发展[4]。另外,本研究还发现,与无转移和包膜完整的肝癌患者相比,有淋巴结转移肝癌患者和肿瘤包膜不完整的肝癌患者RAGE蛋白表达均明显增加,结果表明,RAGE的高表达还与肝癌细胞的侵袭转移密切相关。其结果与过往学者研究发现RAGEmRNA的表达水平随着肝细胞性肝癌临床分期的增加而升高,患者预后越差的结果相似[6]。Spearman等级相关分析结果显示,HMGB1和RAGE蛋白的表达呈正相关关系(rS=0.470,P=0.000),二者在原发性肝细胞癌组织中存在协同高表达二者高表达与原发性肝细胞癌发生、发展及转移正相关。(P<0.05)。提示在原发性肝细胞癌分化、进展和转移进展中,HMGB1基因和RAGE基因有相互诱导或信息传递的条件关系。有学者[13]采用Westem印迹和RT-qPCR方法检测肝癌细胞株Huh7中HMGB1和RAGE的表达情况,研究结果显示二者的表达水平与肝癌转移密切相关,HMGB1可能通过其受体RAGE结合,从而激活NF-kB,促进肝癌细胞增殖、转移及侵袭。
[1] 费新雄.Survivin和MMP-2在老年宫颈癌的表达及与肿瘤侵袭转移的关系[J].临床和实验医学杂志,2013,12(10):778~779.
[2] Wang W,Jiang H,Zhu H,et al.Overexpression of high mobility group box 1 and 2 is associated with the progression and angiogenesis of human bladder carcinoma[J].Oncol Lett,2013,5(3):884~888.
[3] Pusterla T,Nèmeth J,Stein I,et a1.Receptor for advanced glycation endproducts(RAGE)is a key regulator of oval cell activation and inflammation-associated liver carcinogenesis in mice[J].Hepatology,2013,58(1):363~373.
[4] Gebhardl C,RiehI A,DurchdewaId M,et al.RAGE signaling sustains inflammation and promotes tumor deveIopment[J].Exp Med,2008,205(2):275~285.
[5] Hori O,Brett J,Slattery T,et a1.The receptor for advanced glycation end products(RAGE)is a cellular binding site for amphoterin mediation of neurite outgnmth and coexpression of rage and amphoterininthe developing nervous system[J].Biol Chem,1995,270(43):25752~25761.
[6] 秦庆新,肖正华,谢晓斌,等.晚期糖基化终产物受体在糖尿病足患者中的表达特征[J].河北医学,2012,18(6):716~718.
[7] 牛善利,黄友敏,周永勤,等.突发性耳聋患者HMGB1和VE-cadherin含量变化的意义[J].中华全科医学,2011,09(3):394~395,487.
[8] Naglova H,Bucova M.HMGB1 and its physiological and pathological roles[J].Bratisl Lek Listy,2012,113(3):163~171.
[9] Todorova J,Pasheva E.High mobility group B1 protein interacts with its receptor RAGE in tumor cells but not in normal tissues[J].Oncol Lett,2012,3(1):214~218.
[10] Kostova N,Zlateva S,Ugrinova I,Pasheva E.The expression of HMGB1 protein and its receptor RAGE in human malignant tumors[J].Mol Cell Biochem,2010,337(1~ 2):251~258.
[11] Kang R,Tang D,Schapiro NE,Loux T,et al.The HMGB1/RAGE inflammatory pathway promotes pancreatic tumor growth by regulating mitochondrial bioenergetics[J].Oncogene,2014,33(5):567~577.
[12] Taguchi A,Blood DC,Del Toro G,et a1.Blockade of RAGE-omphoterin signalling suppresses tumour growth and metastases[J].Nature,2000,405(6784):354~360.
[13] Sakuraoka Y,Sawada T,et al.MK615 decreases RAGE expression and inhibits TAGE-induced proliferation in hepatocellular carcinoma cells[J].World Gastroenterol,2010,16(42):5334~5341.
[14] Cheng BQ,Jia C Q,Liu CT,et al.Serum high mobility group box chromosomal protein 1 is associated with clinicopathologic features in patients with hepatocellular carcinoma[J].Dig Liver Dis,2008,40(6):446~452.
