S.aureus 诱导的小鼠亚临床型乳房炎乳腺病理变化试验
2015-03-18敬晓棋刘健鹏闫海龙
敬晓棋,刘健鹏,冯 平,闫海龙,屈 雷
(1.榆林学院生命科学学院,陕西 榆林719000 ;2.榆林市动物疫病预防控制中心,陕西 榆林 719000)
奶牛、奶山羊乳房炎的发生与饲养环境、营养水平、经营管理、动物的遗传、泌乳性能、胎次、传染性微生物以及非传染性环境微生物等多种因素有关的疾病,但微生物是导致动物乳房炎发生的最主要原因。奶山羊、奶牛乳房炎的乳腺内感染,以典型的乳腺炎症反应和病理学变化为特征,常导致产奶量下降和奶品质的降低。此外,持续较长时间的急性炎症常常造成泌乳性腺泡细胞损伤和组织的坏死,甚至永久性的产奶量下降。乳用动物乳房炎不仅严重影响奶产业发展,而且对人类的健康和食品安全造成巨大最威胁。
S.aureus是自然界广泛存在的一种能够引起人和动物多种疾病的病原微生物,是奶牛、奶山羊等乳用动物临床和亚临床型乳房炎最主要的病原菌之一[1]。由于S.aureus较弱的抗原性、耐药菌株的不断出现以及与乳腺之间复杂的相互作用等[2],使S.aureus乳房炎的防控和研究工作进展较为缓慢。通过动物模型进行S.aureus乳房炎发生、发展过程及乳腺免疫机制的研究,可为乳房炎的预防、治疗提供新的视角和有益的参考。
尽管奶牛、奶山羊是研究乳房炎和乳腺免疫机制的最佳模型动物,然而奶牛、奶山羊高昂的成本以及试验对生产管理的影响,使其难以在乳房炎免疫机制研究中大量的用作模型动物,因此小鼠成为此类研究合适的选择[2]。
本试验拟以亚临床乳房炎主要病原-S.aureus建立亚临床小鼠乳房炎模型,并通过病理组织切片进行鉴定,为将来进行乳腺免疫等的相关研究提供实验基础。
1 材料与方法
1.1 小鼠 6 周龄的C57BL/6 小鼠,购自第四军医大学实验动物中心,于西北农林科技大学动医学院动物中心饲养。小鼠饲养环境恒温(22°C)、恒湿,每天光照12 h,自由饮水和采食。小鼠适应新环境1 周后,雌雄合笼交配。分娩后1 周时,仔鼠不少于5 只的母鼠用于S.aureus乳房炎模型建立。
1.2 菌株 本试验所用金黄色葡萄球菌(Staphylococcus aureus)是从陕西关中地区患慢性乳房炎的关中奶山羊乳汁分离,经中国兽医药品监察所鉴定为金黄色葡萄球菌,并由西北农林科技大学动物免疫学实验室保存。
1.3S.aureus乳腺内注射 33 只泌乳7~12 日龄C57BL/6 的小鼠用于本次试验,其中30 只为试验组,其余3 只为生理盐水对照。参考Brouillette and Malouin[3]的实验方法进行小鼠乳腺内S.aureus注射,具体如下。乳腺内注射前2 h 将小鼠与仔鼠分离,小鼠按150~200 mg/kg 的剂量腹腔注射氯胺酮,待小鼠麻醉后进行乳腺内注射。将小鼠用纸胶带仰面固定于泡沫板上,对其腹部第4 对和第5 对乳腺用70%酒精消毒,用32G 针头通过乳导管将1×107CFU 的S.aureus缓慢注入乳腺,每个乳头50 μL。对照组注射等量的无菌生理盐水。小鼠放回笼子,自然苏醒。
1.4 感染小鼠状态观察 分别于感染后2,4,8,12,18,24,36,48,60,72 h 观察小鼠精神状态、采食、饮水、眼睛有无分泌物及腹部有无肿胀等。
1.5 组织切片制作与观察 制作好的组织切片在生物显微镜下观察,并通过Nikon DS-U2/L2 Controler成像系统和NIS-Elements F 3.22 成像软件(Nikon)拍照。
2 结果与分析
2.1 感染小鼠状态观察S.aureus感染乳腺组织后24 h 内,小鼠精神状态未见异常,采食、饮水表现正常;36 h 和48 h 时,小鼠精神略显沉郁,有正常的采食和饮水行为,腹部略有肿胀;60 h 时小鼠精神状态、饮水、采食均与正常小鼠无异,腹部中肿胀消失;72 h 时小鼠表现与60 h 相似,但腹部明显扁平。48 h 时剖检小鼠,乳腺呈淡粉红色,切开乳腺组织后有少量乳汁渗出。
2.2 乳腺组织形态观察 组织切片显示,对照组小鼠乳腺结构完整,连接紧密,腺泡腔充满乳汁,除了乳腺上皮细胞外,乳腺组织内无其他细胞存在(图1)。乳腺感染S.aureus的小鼠,在感染后2 h 时乳腺组织结构与对照相似,腺泡结构完整,连接紧密,腺泡腔内乳汁中可见个别淋巴细胞浸润(图2);4 h 时腺泡腔淋巴细胞增多,腺泡壁可见向乳汁迁移的淋巴细胞(图3);8 h 时大量淋巴细胞向腺泡腔内迁移,乳汁中出现较多淋巴细胞(图4);12 h(图5)、18 h(图6)时,乳腺形态与8 h相似,但出现大量淋巴细胞向腺泡腔内迁移,乳汁中出现大量淋巴细胞;24 h(图7)、36 h(图8)时腺泡腔出现大量的淋巴细胞,但少数细胞形态不完整,可能是衰老或死亡的细胞;48 h 时乳腺质存在大量免疫细胞浸润(图9);60 h 时乳腺质存在大量免疫细胞浸润,部分乳腺上皮被脂肪组织所替代(图10);72 h 时,乳腺组织加剧退化,腺泡萎缩、裂解,较多上皮被脂肪组织替代(图11)。
3 讨论
3.1 小鼠乳房炎模型 尽管反刍动物和啮齿动物类在乳腺上存在一些差异,但小鼠仍然是研究乳腺免疫和病理反应的最理想的模型动物,也是最为经济的研究模型。目前,小鼠模型已逐渐应用于多种不同病原菌或菌体成分诱导的乳房炎的乳腺病理、免疫反应机制及乳房炎控制等方面的研究,特别是S.aureus和E.coli等病原性乳房炎的研究[3-4]。Chandler[5]首次成功的建立了小鼠S.aureus乳房炎模型,并进行了病理组织学等鉴定和研究。此后,小鼠乳房炎模型开始逐渐应用于S.aureus乳腺内感染的病理组织学[6]、细菌毒力因子作用[7]、乳房炎疫苗免疫保护[8]及抗生素治疗[9]等研究。
S.aureus主要引起奶牛和奶山羊的慢性、亚临床型乳房炎,而以小鼠为模型的乳房炎研究多是建立急性型模型,检测时间也基本上在24 h 以内。Tuchscherr,Buzzola,Alvarez,Caccuri,Lee and Sordelli[10]等建立了慢性的小鼠乳房炎模型,试验在感染后持续进行了12 d 的指标检测,但他们所用的菌株为缺失CP5 和CP8 嚢膜多糖的S.aureus株,并不能完全反映乳腺对S.aureus正常的免疫应答。本试验所用菌株为陕西省关中地区奶山羊亚临床型乳房炎乳汁分离所得,经鉴为正常的S.aureus,并成功建立亚临床型的小鼠乳房炎模型。

图1 对照组小鼠乳腺结构完整,上皮细胞连接紧密,腺泡内充满乳汁

图2 S.aureus感染后2 h,腺泡结构完整,乳汁中可见个别免疫细胞

图3 S.aureus感染后4 h,腺泡腔内存在少量淋巴细胞,腺泡壁上看见迁移的免疫细胞
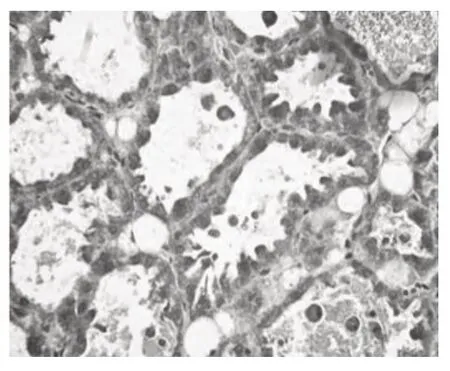
图4 S.aureus感染后8 h,腺泡腔有较多淋巴细胞浸润,腺泡壁大量迁移免疫细胞

图5 S.aureus感染后12 h,腺泡腔有大量淋巴细胞浸润,腺泡壁存在大量迁移免疫细胞
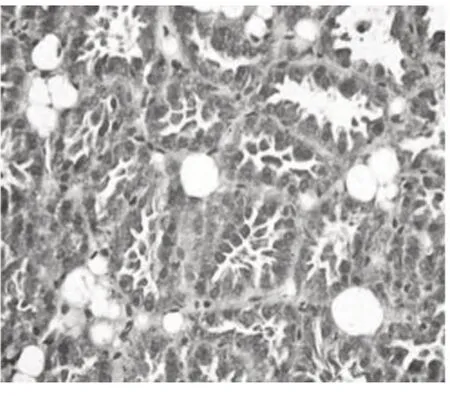
图6 S.aureus感染后18 h,腺泡腔有较多淋巴细胞浸润,腺泡壁大量迁免疫细胞

图7 S.aureus感染后24 h,腺泡腔出现大量的免疫细胞

图8 S.aureus感染后36 h,腺泡腔出现大量的免疫细胞

图9 S.aureus感染后48 h,腺泡间质出现大量的免疫细胞浸润

图10 S.aureus感染后60 h,腺泡间质有免疫细胞浸润,腺泡腔存在免疫细胞

图11 S.aureus感染后72 h,乳腺组织萎缩、退化,部分乳腺上皮被脂肪组织所替代
3.2 金黄色葡萄球菌性乳房炎 引起奶牛、奶山羊乳房炎的微生物包括革兰阴性肠杆菌属、葡萄球菌属、链球菌属、诺卡菌属、克莱伯菌属及支原体等137 种[11],但大肠杆菌、金黄色葡萄球菌是临床中最为常见病原。乳房炎病原调查显示,乳腺内感染大肠杆菌时一般表现为急性的临床型乳房炎,具有典型的乳房肿胀、发热、疼痛、乳汁黏稠、变黄等局部炎症反应,严重的还表现全身性症状[12]。而S.aureus的乳腺内感染既可以引起急性的、临床型乳房炎,但大多数情况下为慢性的、亚临床型的隐性乳房炎。亚临床型乳房炎除乳中体细胞数增多、乳品质改变外,一般无明显的乳腺局部或全身性炎症反应,只有通过实验室检测才能够确诊。临床中以S.aureus性隐性乳房炎多见,且由于其无明显的临床和病理学变化以及长期的抗生素治疗,而导致养殖场巨大的经济损失,并对人的食品安全和健康构成巨大的威胁。
本试验以S.aureus为乳腺感染病原,利用C57BL/6 小鼠建立了小鼠S.aureus性亚临床乳房炎模型。小鼠乳腺内注射S.aureus后24 h 内,小鼠精神状态未见异常,采食、饮水表现正常;36 h和48 h 时,小鼠精神略显沉郁,有正常的采食和饮水行为,腹部略有肿胀;60 h 时小鼠精神状态、饮水、采食均与正常小鼠无异,腹部中肿胀消失;72 h 时小鼠表现与60 h 相似,但腹部明显扁平。整个试验期间,小鼠未出现腹部明显肿胀、发红、精神沉郁等临床乳房炎的局部和全身症状,在一定程度上表明我们成功的建立了小鼠S.aureus性亚临床乳房炎模型。
病理组织切片结果显示,对照组小鼠乳腺结构完整,连接紧密,腺泡腔充满乳汁,除乳腺上皮细胞外,乳腺内未见其他细胞存在(图3)。感染后2 h 无对照小鼠乳腺组织结构完整,但乳汁中以可见个别免疫细胞(图4),表明S.aureus感染乳腺2 h 即有免疫细胞趋化进入组织。乳腺内注射S.aureus后4 h、8 h、12 h 和18 h 可见腺泡腔内免疫细胞逐渐增多,且有大量的细胞突出于腺泡壁内(图5,6,7,8),可能是正在迁移的免疫细胞,表明感染S.aureus18 h 内,乳腺的天然免疫防御启动并逐渐加强。感染S.aureus后24 h、36 h 腺泡腔内可见到大量的免疫细胞(图9,10),48 h、60 h 乳腺间质出现明显的免疫细胞浸润,部分乳腺组织开始萎缩(图11,12),这可能是细菌感染后天然免疫反应完全启动,免疫细胞清除侵入的病原微生物和死亡细胞。S.aureus乳腺内注射后72 h,乳腺组织继续退化、萎缩,此时不能够从组织切片区分出上皮细胞和免疫细胞(图1)。
本试验中,S.aureus感染乳腺组织后72 h 内,小鼠外观无明显改变,仅有轻微的局部症状,也无全身症状出现,组织切片显示2 h 即开始有免疫细胞进入乳腺,并随时间浸润细胞逐渐增多,表明我们成功建立起S.aureus性小鼠亚临床型乳房炎,可用于乳房炎早期天然免疫和其后适应性免疫及其他的相关研究。
[1]Watts JL.Etiological agents of bovine mastitis[J].Veterinary Microbiology,1988,16(1):41-66.
[2]Virdis S,Scarano C,Cossu F,et al.Antibiotic Resistance in Staphylococcus aureus and Coagulase Negative Staphylococci Iso-lated from Goats with Subclinical Mastitis[J].Vet Med Int,2010.2010:517060.
[3]Notebaert S,Meyer E .Mouse models to study the pathogenesis and control of bovine mastitis.Areview[J].Vet Q,2006,28(1):2-13.
[4]Chandler R.Ultrastructural pathology of mastitis in the mouse.Astudy of experimental staphylococcal and streptococcal infections[J].Brit JExper Path,1970.51:639-645.
[5]Brouillette E,Grondin G,Shkreta L,et al.In vivo and in vitro demonstration that Staphylococcus aureus is an intracellular pathogen in the presence or absence of fibronectin-binding proteins[J].Microbial Pathogenesis,2003,35(4):159-168.
[6]Brouillette E,Talbot BG,Malouin F .The fibronectin-binding proteins of Staphylococcus aureus may promote mammary gland colonization in a lactating mouse model of mastitis[J].Infection and immunity,2003,71(4):2292.
[7]Tuchscherr L P,Buzzola F R,Alvarez L P,et al.Antibodies to capsular polysaccharide and clumping factor Aprevent mastitis and the emergence of unencapsulated and small-colony variants of Staphylococcus aureus in mice[J].Infection and immunity,2008.76(12):5738-5744.
[8]Brouillette E,Grondin G,Lefebvre C,et al.Mouse mastitis model of infection for antimicrobial compound efficacy studies against intracellular and extracellular forms of Staphylococcus aureus[J].Veterinary Microbiology,2004.101(4):253-262.
[9]Tuchscherr L P,Buzzola F R,Alvarez L P,et al.Capsule-negative Staphylococcus aureus induces chronic experimental mastitis in mice[J].Infection and immunity,2005.73(12):7932-7937.
[10]Ranjan R,Swarup DPatra R,et al.Bovine protothecal mastitis:a review[J].History,2005(27).
[11]Blum JW,Dosogne H,Hoeben D,et al.Tumor necrosis factor-α and nitrite/nitrate responses during acute mastitis induced by Escherichia coli infection and endotoxin in dairy cows[J].Domest Anim Endocrinol,2000,19(4):223-235.
[12]Sears P M,McCarthy K K.Management and treatment of staphylococcal mastitis[J].The Veterinary clinics of North America.Food animal practice,2003,19(1):171.
[13]Rainard P,Riollet C.Innate immunity of the bovine mammary gland[J].Vet Res,2006,37(3):369-400.
