菱角萤叶甲雄性竞争策略的可塑性反应
2015-03-15王璐瑶范海江李建洪王永模
王璐瑶,范海江,李建洪,王永模
(华中农业大学植物科学技术学院,武汉,430070)
一般来说,单个精子产生所需要的能量远远低于单个卵子产生所需要的能量,然而越来越多的研究表明,大量精子产生的代价也是高昂的[1~3]。在聚集生活条件下,雄性面临着激烈的竞争,包括交配前的求偶竞争以及交配后的精子竞争[4]。对于有多次交配习性的种类,精子竞争主要指不同来源的精子在雌性体内对受精机会的争夺,而受精机会是有限的,这会使竞争失利的雄虫付出较高代价[5]。
雄性会根据竞争者数量来对未来精子竞争的激烈程度做出预测,并相应改变交配行为和生殖生理的现象称作雄性竞争可塑性[6]。例如雄性会改变精子数量或者生殖附腺分泌物的量[7,8];在一种果蝇(Drosophila melanogaster)中,当出现多个雄虫时,雄虫会增大对射精物质的投资并获得较高的生殖成功率[9];Garbaczewska 等[10]报道了这种果蝇雄性个体在预判到竞争时,会提高射精物质中的精子数量。雄性在交配时输送给雌性的生殖附腺分泌物能够延长雌性再次交配的时间,并且加快雌性的产卵速率[11~14],这大大增加了雄性精子与卵子结合的几率。雄性果蝇在遇到其他竞争者时会加大附腺蛋白的量来延长雌虫再次交配的时间间隔[8];在面临竞争时,雄虫也会主动改变交配时长,通常情况下,有其他雄性在旁边时,雄性的交配时长会延长,然而无其他雄虫存在时交配时长会缩短,这在几种果蝇当中都有报道[8,9,15]。其他生物种类中也存在交配延长的现象,如家鼠遭遇精子竞争时,雄性的交配时长会明显延长[16]。但是一些种类中却有相反的报道,如另一种果蝇(Drosophila bifasciata),当其暴露给其他雄性时,雄性的交配时长没有被延长[6]。大多数雄虫生殖竞争可塑性反应的研究起始于羽化到交配之前这一阶段,然而,有研究发现粘虫成虫和幼虫生活的密度会影响到其成虫阶段的精子配置[17,18],这表明交配行为可塑性可能发生于更早的幼虫时期,且可能会受到幼虫生活密度的影响。
菱角萤叶甲Galerucella birmanicaJacoby 属鞘翅目(Coleoptera),叶甲科(Chrysomelidae),主要分布于中国、印度等亚洲国家[19]。由于该虫食性单一,几乎只取食菱角,所以是菱角最重要的害虫之一,被害株率能够达到30%~65%,大暴发可为害整个植株的水上部,并显著降低菱角的质量和产量[20,21]。野生菱角来自北美的一种为害严重的入侵杂草[22],这使得菱角萤叶甲成为了其潜在的有效天敌。
目前为止,关于菱角萤叶甲的研究主要集中于基本生物学的描述和化学防治方法介绍[20,21,23,24],对该虫的交配行为研究比较少。研究该虫的繁殖行为学对于预测菱角萤叶甲种群增长有着重要作用,同时可为今后雄性不育防治方法研发提供指导;另外作为生防作用物,了解其交配行为能给大规模饲养提供理论依据。本文在幼虫期以及随后的成虫期设置了不同饲养密度,以交配时长、交配反应时间、精子数量和附腺分泌物量为指标,研究菱角萤叶甲雄虫竞争是否存在可塑性,探索雄虫竞争可塑性是形成于幼虫阶段还是成虫阶段。
1 材料与方法
1.1 供试虫源
2014 年4 月于湖北武汉市野芷湖(E 114°3',N 30°50'),将采集到的完整卵块放入到直径为15 cm的塑料培养皿中,卵块在(28±0.5)℃、光照条件L∶D=10∶14 和相对湿度(80±5)%的条件下孵化。待卵块孵化后,将初孵幼虫放入装有新鲜菱角叶片的培养皿中,每个培养皿放入20 头幼虫,培养皿中放入湿润的海绵保湿。每隔2 d 换1 次叶片,用细毛笔轻轻将幼虫挑到新鲜的叶片上,待其化蛹。当成虫羽化后,将成虫放入到上述环境条件下饲养,每个培养皿10 头成虫。连续饲养4 代,将第4 代成虫的卵块收集后放在同样的条件下培养,孵化的幼虫作为以下试验的供试虫源。
1.2 幼虫和成虫饲养密度设置
将初孵幼虫按高低2 种密度接入直径15 cm塑料培养皿中,每个培养皿1 头初孵幼虫为低密度(用L 表示);每个培养皿20 头初孵幼虫为高密度(用H 表示)。将不同密度下刚羽化后的成虫在显微镜(Nikon,SMZ745T)下进行雌雄分离,得到未交配的雌雄虫。将分离出的雄虫又分为高低2 种密度饲养,每个培养皿1 头成虫为低密度(用S 表示),每个培养皿5 头成虫为高密度(用M 表示)。这样就形成了4 个处理,即幼虫低密度成虫低密度(LS)、幼虫低密度成虫高密度(LM)、幼虫高密度成虫低密度(HS)、幼虫高密度成虫高密度(HM)。成虫3 d左右达到性成熟,为了让雄虫有足够时间感受到其他雄虫的存在,将雄成虫在培养皿中饲养5 d 后进行下一步试验。
1.3 交配行为观察及生殖腺分泌物测量
随机选择1 头不同处理的雄虫,放入装有1 头未交配雌虫的培养皿中,雌虫日龄与雄虫相同,让雄虫与雌虫发生交配。记录雄虫的交配反应时长(从放入到开始交配的时长)、交配持续时长、雌虫交配后开始产卵时长。交配后饲养条件参见供试虫源中的叙述。每个处理15 次重复。
另外在不同处理中取出未交配的5 日雄虫,测量雄虫精子数量和生殖附腺蛋白含量。精子数量的测定参考Katsuki 等[25]方法,将雄虫杀死后在显微镜下解剖,将解剖出来的生殖组织放入到20 μL 的磷酸缓冲液中,取出精囊后放入装有500 μL 生理缓冲液的离心管中,使用昆虫针将精囊弄碎,之后加入10 μL 的DAPI 荧光染色溶液(0.05 g/mg),在遮光摇床上振荡10 min。当充分染色后,取5 μL 样品滴在盖玻片上(滴成圆形,测量其面积),在200 倍荧光显微镜(OLYMPUS SZX16)下统计数量。利用血细胞基数板测出200 倍视野下的面积为0.96 mm2。在一个视野面积中观察精子的数量,为了统计精确,随机选取3 个视野进行数量统计,然后取平均值,10 次重复。精子数量=(200 倍视野面积精子个数×5 μL 样品面积)/(200 倍视野下的面积×溶液总量),其中溶液总量为510 μL。
附腺蛋白含量的测定参见曲春香等[26]的方法,将雄虫杀死后在显微镜下解剖,将解剖出来的生殖组织放入20 μL 的磷酸缓冲液中,取出生殖附腺后放入500 μL 的生理盐水中(0.65%),用昆虫针扎破后使蛋白充分流入到生理盐水中,之后在酶标仪中(BIORAD XMarkTM)测定蛋白含量,10 次重复。蛋白含量测定采用南京建成蛋白定量测试盒 (货号:A045-2)。
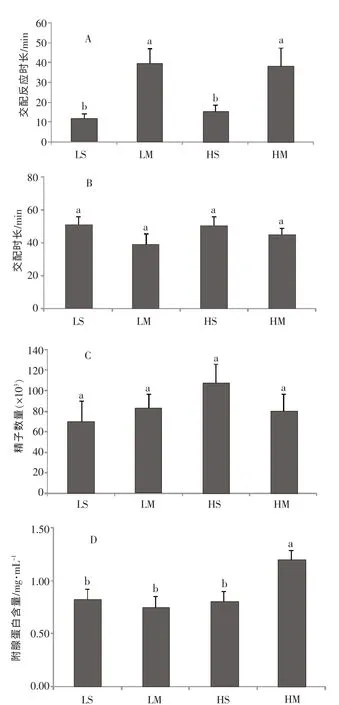
图1 不同处理下的雄性交配反应时长(A),交配时长(B),精子数量(C),附腺蛋白含量(D)
1.4 数据处理
试验数据用SPSS 19.0 软件进行统计分析。雄性交配反应时长、交配持续时长、精子数量以及附腺蛋白含量采用双因素方差分析,处理组合的多重比较采用LSD 法,雌虫交配后到产卵时长数据处理 采 用 单 因 素 方 差 分 析 。
2 结果与分析
2.1 交配反应时长
交配反应时长受到成虫阶段饲养密度的影响,幼虫阶段饲养密度对交配时长没有显著影响,幼虫密度和成虫密度对交配反应时长的影响没有交互作用。LS 处理下的交配反应时长(11.89±2.21)min,LM处理下的交配反应时长(39.50±7.39)min,两者之间存在极显著差异;HS 处理下的交配反应时长(15.93±2.82)min,HM 处 理 下 的 交 配 反 应 时 长(38.87±8.54)min,两者之间也存在极显著差异(图1A)。
2.2 交配持续时长
交配持续时长未受到成虫阶段密度的影响,幼虫阶段密度对交配持续时长也没有显著影响,幼虫密度和成虫密度两因素之间没有交互作用。LS 处理的交配时长(51.32±4.95)min,LM 处理的交配时长(39.50±5.94)min,它们之间没有显著性差异,HS处理的交配时长(15.93±2.82)min,HM 处理的交配时长(38.87±8.54)min,两者不存在显著差异(图1B)。
2.3 精子数量
精子数量未受到雄成虫密度的影响,LS 处理的精子数量为 (7.03±1.95)×104,LM 处理的精子数量(8.31±1.38)×104,两者之间没有显著性差异;HS处理的精子数量(10.80±1.80)×104,HM 处理的精子数量(8.07±1.63)×104,也不存在极显著差异。幼虫密度对精子数量无显著影响,幼虫密度及雄成虫密度两因素对精子数量的影响没有交互作用(图1C)。
2.4 附腺蛋白含量
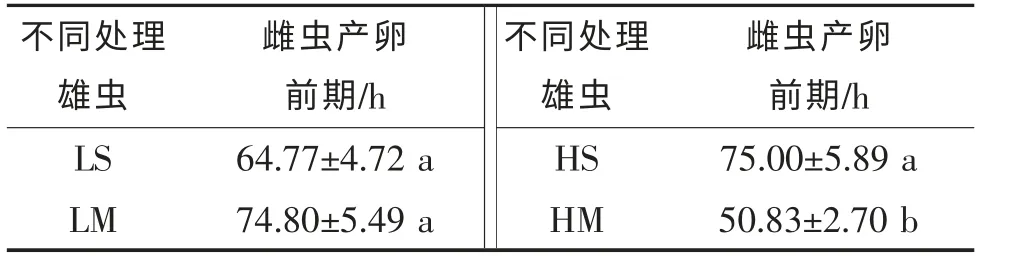
表1 雌虫与不同处理雄虫交配后产卵前期的变化
附腺蛋白含量受到幼虫密度的影响,LS 处理的附腺蛋白浓度(0.83±0.09)mg/μL,LM 处理的附腺蛋白浓度(0.75±0.10)mg/μL,两者存在极显著差异,HS 处理的附腺蛋白浓度(0.80±0.09)mg/μL,HM 的附腺蛋白浓度(1.20±0.08)mg/μL,两者之间不存在极显著差异。而雄成虫密度对附腺蛋白的含量没有显著影响,幼虫密度及雄成虫密度两因素对附腺蛋白含量的影响存在交互作用(图1D)。
2.5 雌虫交配之后到产卵的时长
雌虫与不同处理的雄虫交配后,从交配到产卵的时长存在显著差异。LS、LM、HS 处理之间差异不显著,但都与HM 处理存在显著差异。HM 处理的交配后到产卵时长比HS 的缩短了24.17 h(表1)。
3 讨论与结论
本试验结果表明,菱角萤叶甲雄虫在面临竞争时会改变自己的竞争对策,包括交配反应时长的延长以及附腺物质含量的增多,这表明雄虫处在竞争条件下的交配行为和生理反应是可塑的。幼虫的生活密度引起了附腺蛋白含量的改变,说明雄虫交配行为的可塑性可能起始于幼虫阶段;幼虫生活密度以及成虫密度都增加了附腺蛋白的分泌,表明二者在雄性的竞争可塑性中同时起作用。
雄性会根据视觉、触觉或者听觉来感知竞争者的存在及数量[7,15],并通过之前的生活经历来改变其交配行为。当遭遇到多个竞争者时,雄虫表现出对雌虫不敏感,具体表现为对雌虫的求偶变得迟缓(图1A)。当感受到多个雄虫存在时,雄虫会认为当前的精子竞争压力比较大,为了避免浪费能量进而使自身的生殖利益最大化,雄虫选择雌虫交配时会比较谨慎。之前的很多研究表明,雄性在遭遇到精子竞争时会改变交配时长,在几种果蝇当中都有这种行为的发生[8,9,15];而我们的研究发现,雄虫在面临竞争时,交配时长未表现出明显的差异(图1B)。一方面,前人研究表明雄虫在遇到竞争时会改变其交配行为和生理,例如求偶行为的改变[7],精子数量和质量的改变[2],以及附腺蛋白含量的改变[8]等,交配时长的改变只是其交配行为和生理改变的一部分,因此这种改变不一定会表现为交配时长的变化。另一方面, 之前的研究表明在一种果蝇(Drosophila melanogaster)中,雄虫的交配时长与暴露给其他竞争者的时长正相关,而与竞争者的数量没有关系[27],在我们的试验中没有考虑到暴露时长这一因素,在菱角萤叶甲中暴露时长与交配时长的关系还有待进一步研究。另外,Bretman[28]认为对交配时长的控制是雌雄共有性状,性状的变化由雌雄虫共同控制,并不是由雄虫单方面控制,而本文雄虫在交配时长中没有差异,很可能是雌雄虫双方共同控制的。
在感受到激烈竞争的情况下,雄虫在交配中会提高附腺蛋白含量,本文的研究结果与前人相似,但之前的研究阶段是在羽化到交配这一时段,而本研究表明幼虫生活密度对附腺蛋白含量的改变起到了关键作用(图1D),这是一个新的发现。虽然成虫竞争者数量没有对附腺蛋白含量起到影响,但是幼虫密度/成虫竞争者数量与附腺蛋白含量的提高间具有交互作用,至于二者之间的交互作用机理还不清楚。雌虫交配到产卵的时间存在显著差异(表1),分析是附腺蛋白含量不同所致,因为之前的研究表明,雄性在交配时输送给雌性的生殖附腺分泌物能够延长雌性再次交配的时间,并且可加快雌虫产卵。本研究还发现,精子数量没有受到幼虫生活密度以及成虫竞争者数量的影响(图1C),这表明在竞争中,雄性没有通过改变精子数量来获取竞争力。
[1]Dewsbury D A.Ejaculate cost and male choice[M].American Naturalist,1982:601-610.
[2]Wedell N,Gage M G,Parker G A.Sperm competition,male prudence and sperm limited females[J].Trends in Ecology and Evolution,2002,17(7):313-320.
[3]Tang-Martinez Z,Ryder T B.The problem with paradigms:Bateman's worldview as a case study [J].Integrative and Comparative Biology,2005,45(5):82-830.
[4]Parker G A,Pizzari T.Sperm competition and ejaculate economics[J].Biological Reviews,2010,85(4):897-934.
[5]Simmons L W.Sperm competition and its evolutionary consequences in the insects [M].Princeton University Press,2001.
[6]Lizé A,Price T,Marcello M,Smaller E A,et al,Hurst GDD.Males do not prolong copulation in response to competitor males in the polyandrous fly Drosophila bifasciata[J].Physiological Entomology,2012,37(3):227-232.
[7]Bretman A,Gage M J G,Chapman T.Quick-change artists:adult behavioural plasticity at mating[J].Trends in Ecology and Evolution,2011,26:467-473.
[8]Wigby S,Sirot L K,Linklater J R,et al.Seminal fluid protein allocation and male reproductive success[J].Current Biology,2009,19(9):751-757.
[9]Bretman A,Fricke C,Chapman T.Plastic responses of maleDrosophila melanogasterto the level of sperm competition increase male reproductive fitness [J].Proceedings of the Royal Society: Biological Sciences, 2009, 276(1 662):1 705-1 711.
[10]Garbaczewska M,Billeter J C,Levine J D.Drosophila melanogastermales increase the number of sperm in their ejaculate when perceiving rival males[J].Journal of Insect Physiology,2013,59(3):306-310.
[11]Eberhard WG.Female control:sexual selection by cryptic female choice[J].Princeton University Press,1996.
[12]Wolfner M F.Tokens of love:functions and regulation ofDrosophilamale accessory gland products[J].Insect Biochemistry and Molecular Biology,1997,27(3):179-192.
[13]Cameron E,Day T,Rowe L.Sperm competition and the evolution of ejaculate composition[J].The American Naturalist,2007,169(6):158-172.
[14]Avila F W,Sirot L K,Laflamme B A,et al.Insect seminal fluid proteins:identification and function[J].Annual Review of Entomology,2011,56:21-40.
[15]Kim,W J,Jan L Y,Jan Y N.Contribution of visual and circadian neural circuits to memory for prolonged mating induced by rivals [J].Nature Neuroscience,2012,15(6):876-883.
[16]Klemme I,Firman R C.Male house mice that have evolved with sperm competition have increased mating duration and paternity success[J].Animal Behaviour,2013,85(4):751-758.
[17]Cook P A,Gage M.Effects of risks of sperm competition on the numbers of eupyrene and apyrene sperm ejaculatedby the mothPlodia interpunctella(Lepidoptera:Pyralidae)[J].Behavioral Ecology and Sociobiology,1995,36(4):261-268.
[18]He Y,Miyata T.Variations in sperm number in relation to larval crowding and spermatophore size in the armyworm,Pseudaletia separata[J].Ecological Entomology,1997,22(1):41-46.
[19]Pemberton R W.Natural enemies ofTrapaspp in northeast Asia and Europe[J].Biological Control,1999,14(3):168-180.
[20]陆自强,朱建,祝树德,等.菱角莼菜害虫——菱角萤叶甲的研究[J].中国农业科学,1984(5):73-76.
[21]司升云,吴仁锋.菱角萤叶甲的识别与防治[J].长江蔬菜,2008(4):26.
[22]Patidar D C,Thakur G S,Yadav J S,et al.Feeding capacity ofSinghara beetle,Galerucella birmanicaJacoby[J].Journal of Insect Science,1994,7(1):102-103.
[23]郑福山,杜予州,卢艳阳,等.菱角萤叶甲种群空间格局研究[J].中国生态农业学报,2006(4):171-175.
[24]Ding J,Blossey B,Du Y,Zheng F.Galerucella birmanica(Coleoptera:Chrysomelidae)a promising potential biological control agent of water chestnutTrapa natans[J].Biological Control,2006,36(1):80-90.
[25]Katsuki M,Miyatake T.Effects of temperature on mating duration,sperm transfer and remating frequency in Callosobruchus chinensis [J].Journal of Insect Physiology,2009,55(2):113-116.
[26]曲春香,沈颂东,王雪峰,等.用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究[J]. 苏州大学学报:自然科学版,2006(4):83-85.
[27]Bretman A,Westmancoat J D,Gage M J,et al.Individual plastic responses by males to rivals reveal mismatches between behaviour and fitness outcomes[J].Proceedings of the Royal Society B:Biological Sciences,2012,279(1 739):2 868-2 876.
[28]Bretman A,Westmancoat J D,Chapman T.Male control of mating duration following exposure to rivals in fruitflies[J].Journal of Insect Physiology,2013,59(8):824-827.
