那西肽预混剂组分HPLC检测方法的建立
2015-03-10韩宁宁徐嫄于丽娜郝利华赵晖
韩宁宁,徐嫄,于丽娜,郝利华,赵晖
(中国兽医药品监察所,北京,100081)
那西肽预混剂组分HPLC检测方法的建立
韩宁宁,徐嫄,于丽娜,郝利华,赵晖*
(中国兽医药品监察所,北京,100081)
为了建立那西肽预混剂组分测定的高效液相检查法,采用十八烷基键合硅胶为填充剂,以0.025%磷酸水溶液-乙腈(50∶50)为流动相,检测波长为241 nm,并以该色谱条件对来自7个厂家的14批不同规格的那西肽预混剂进行了测定。综合结果给出组分的建议限度为:那西肽组分A的峰面积不得少于那西肽组分A与组分B峰面积之和的88.0%。该方法具有专属性强、耐用性好、操作简便等优点。
那西肽预混剂;组分;高效液相色谱法
那西肽是一种含硫多肽类抗生素,我国于1998年批准其为国家三类新兽药,被农业部列为可在饲料中长期添加使用的饲料药物添加剂,对猪鸡有促进生长和提高饲料转化率的作用[1-2]。那西肽预混剂工艺早期是由那西肽原料药与玉米淀粉、碳酸钙等配制而成,其质量标准收载于《兽药国家标准化学药品、中药卷》(第一册)[3]。随着技术发展,国内那西肽预混剂生产厂家的生产工艺均已变更为那西肽发酵液的菌丝体干燥后与碳酸钙等配制而成。而目前缺少针对发酵而得的那西肽预混剂的相关国家质量标准,相应的市场监督与质量控制也呈空白状态。
经文献检索,那西肽中含有一主组分A,同时含有一副组分B[4]。《兽药国家标准化学药品、中药卷》(第一册)中收载的那西肽预混剂质量标准对组分B并没有相关的控制规定[3]。根据兽药协会提供的资料,对国内7家那西肽预混剂生产企业内部控制标准中关于组分的相关规定进行了汇总,结果发现其中3家企业并无相关规定,剩余4家企业对组分B的限度规定从不得大于12%至不得大于15%不等。由此可见,不同企业对组分B的控制缺乏一致性。因此,根据文献中那西肽预混剂HPLC含量测定方法[5],经过方法优化与验证,建立了那西肽预混剂组分的HPLC测定法。
1 仪器与试剂
高效液相色谱仪(HPLC),配紫外检测器(UV)和二极管阵列检测器(PDA)(Waters 2695-2487/996);XS205分析天平(Mettler Toledo);色谱柱(COSMOSIL C18,5μm,250 mm×4.6 mm)。色谱纯乙腈(Merck公司);分析纯磷酸(国药集团);去离子水(Millipore纯水机过滤)。那西肽标准品由中国兽医药品监察所提供,批号K0431212,每1mg相当于928那西肽单位,以那西肽A组分计,含量为88.6%。那西肽预混剂供试品共14批,由7家国内生产厂家提供,具体信息见表1。
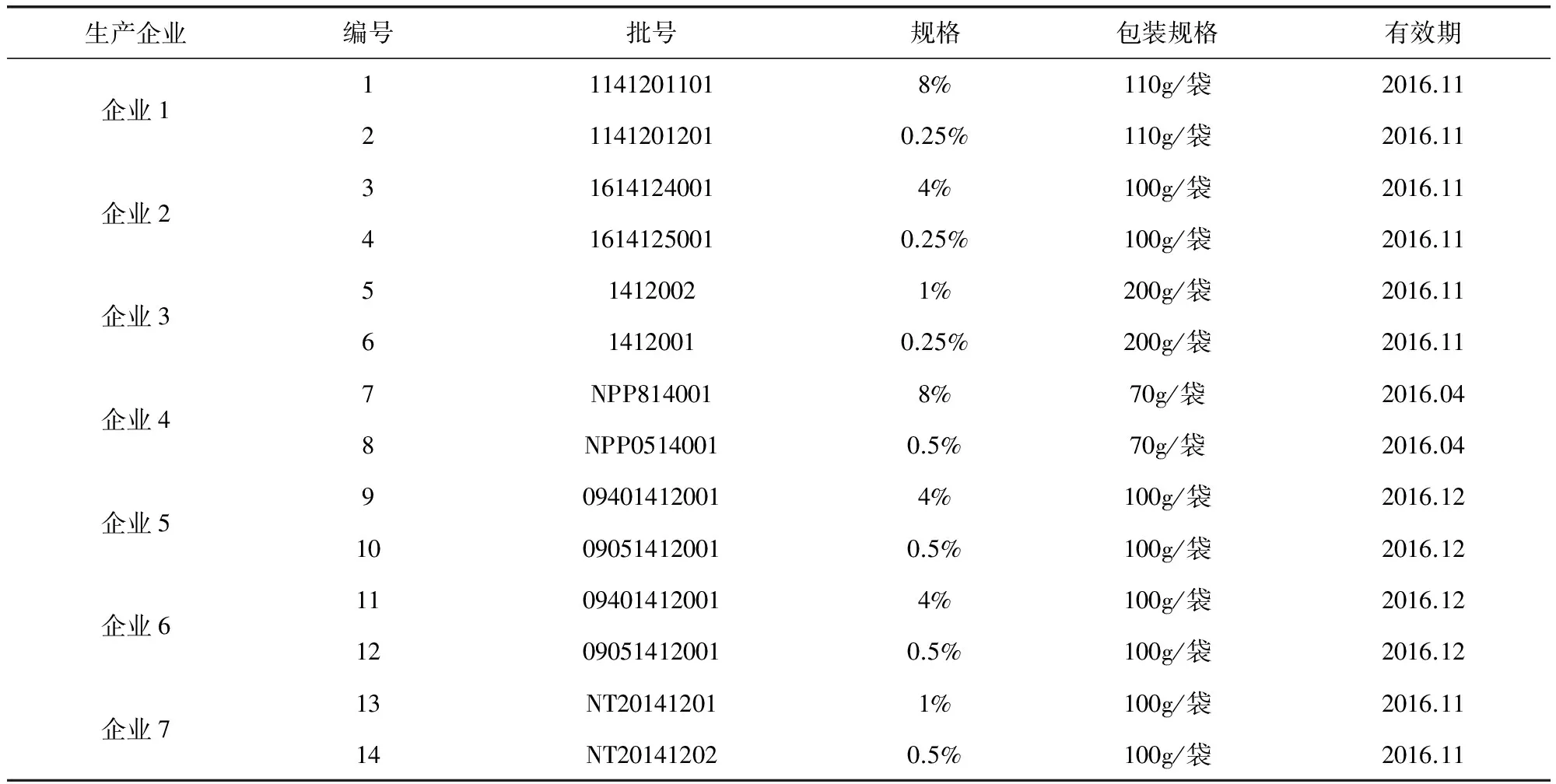
表1 那西肽预混剂供试品信息表
2 方法与结果
2.1 色谱条件 用十八烷基键合硅胶为填充剂,以乙腈-0.025%磷酸溶液(50∶50)为流动相,检测波长为241 nm,取标准品溶液20 μL,注入液相色谱仪,记录色谱图,出峰顺序为那西肽组分B、那西肽组分A。理论板数按那西肽组分A峰计算不低于3000,主成分与相邻杂质峰的分离度应大于1.5。
2.2 对照品溶液与供试品溶液的制备 取供试品适量,精密称定,置具塞锥形瓶中,精密加入磷酸盐缓冲溶液5 mL、二甲基甲酰胺50 mL,超声处理20 min,每隔5 min强力振摇一次,放至室温,制成每1 mL约含1000单位(规格:8%、4%、2%)或125单位(规格:1%、0.5%、0.25%)的溶液,滤过,精密量取续滤液适量,加二甲基甲酰胺 4 mL,加磷酸盐缓冲液-乙醇(85∶15)稀释至刻度,制成每1 mL约含25单位的溶液。对照品溶液同法配制。供试品溶液应现配先用。
2.3 方法学验证
2.3.1 专属性 采用PDA检测器,在拟定方法下检测,获得标准品溶液和供试品溶液的那西肽组分光谱指数图(图1-图2)。由图可见,溶剂峰对组分A与B均无干扰。
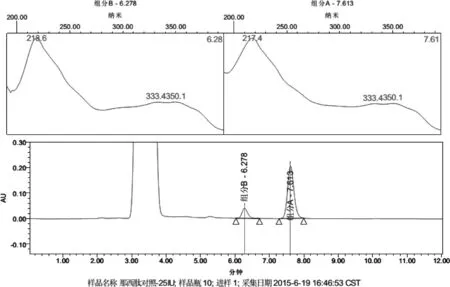
图1 那西肽标准品溶液光谱指数图
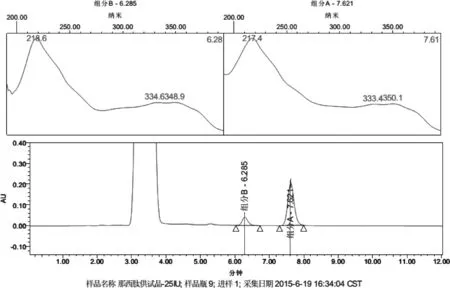
图2 供试品溶液光谱指数图
2.3.2 检测限 取0.5单位/ mL的标准品溶液7 μL注入液相色谱仪,组分A的信噪比S/N=3。
以组分A的量(0.5单位/928单位/mg)×(7 μL/1000 μL)×88.6%×1000=0.003 μg作为该方法的检测限(LOD)。
2.3.3 耐用性 取那西肽标准品溶液,采用不同品牌色谱柱以及在不同柱温、不同流速、不同pH值下进行测定,对该方法的耐用性进行考察。
2.3.3.1 采用三款不同品牌色谱柱,流速为1.0 mL/min,柱温为30℃,考察方法耐用性,结果三款色谱柱均可满足方法系统适用性要求,参见表2。
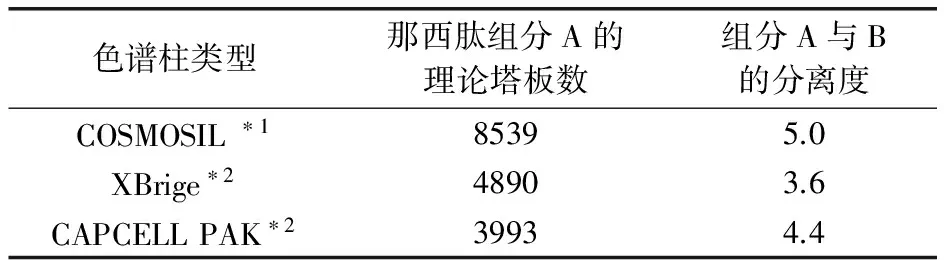
表2 三款不同品牌色谱柱的柱效比较
*1:C18,5μm,4.6 mm×250 mm
*2:C18,5μm,4.6 mm×150 mm
2.3.3.2 用COSMOSIL C18(5 μm,4.6 mm×250 mm)色谱柱,流速为1.0 mL/min,分别设定25℃、30℃和35℃的柱温,考察不同柱温的影响。结果随着柱温升高,组分A与B的保留时间均略有提前,但组分A的理论塔板数及组分A与B的分离度基本不受影响,参见表3。

表3 不同柱温的影响结果表
2.3.3.3 用COSMOSIL C18(5 μm,4.6 mm×250 mm)色谱柱,柱温为30℃,分别设定0.8、1.0、1.2 mL/min的流速,考察不同流速的影响。结果见表4。由结果可知,随着流速升高,组分A与B的保留时间均提前,组分A的理论塔板数及组分A与B的分离度均略有下降,但均仍符合拟定方法的要求。
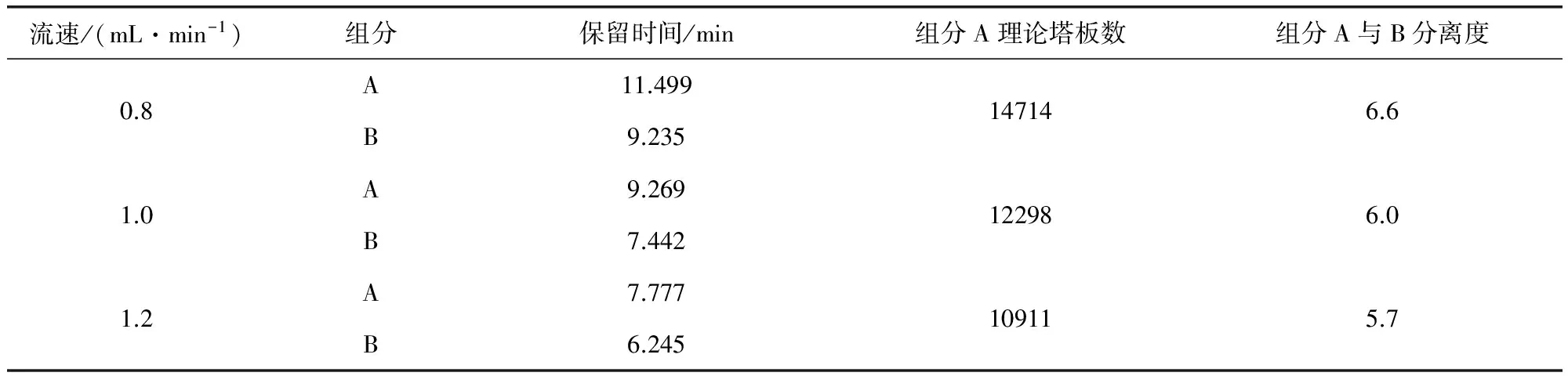
表4 不同流速的影响结果表
2.3.3.4 用COSMOSIL C18(5 μm,4.6 mm×250 mm)色谱柱,柱温为30℃,流速为1.0 mL/min,将流动相中的水相分别设定为0.0125%磷酸溶液、0.025%磷酸溶液、0.05%磷酸溶液,考察不同pH值的影响。结果三种不同浓度磷酸溶液的流动相对组分A的理论塔板数及组分A与B的分离度基本没有影响,参见表5。
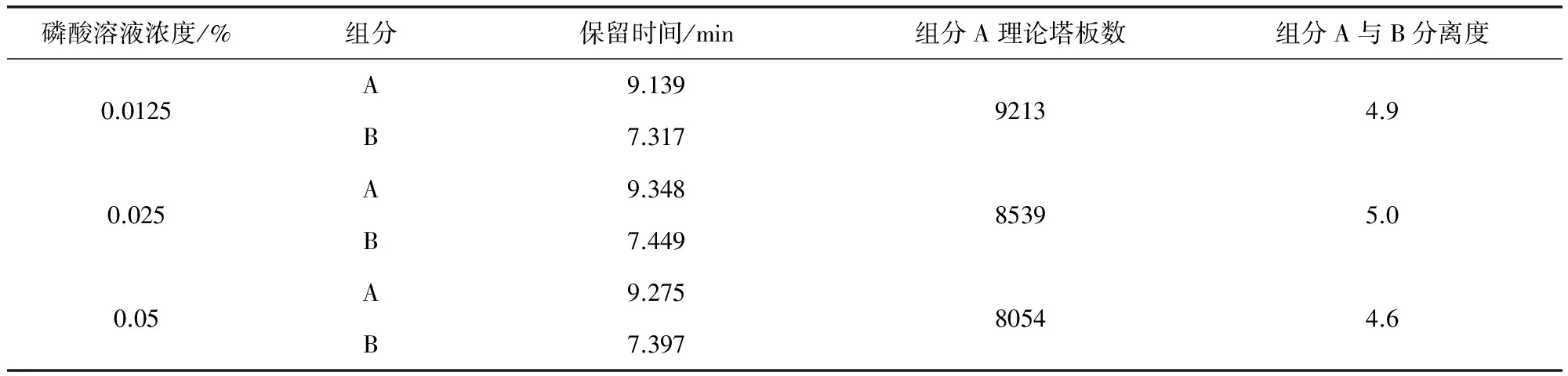
表5 不同pH值的影响结果表
2.3.4 被测溶液的稳定性 取一份每1 mL约含25单位的供试品溶液,在室温放置0、1、2、4、8、12和24 h进样,考察供试品稳定性,结果见表6。结果显示,随着室温放置时间的延长,组分A与B的峰面积均在逐渐减小,放置24 h后,二者峰面积均减少10%以上。由于每1 mL约含25单位的供试品溶液稳定性较差,我们又另取一份每1 mL约含1000单位的供试品溶液,在室温放置0、1、2、4、8、24和48 h进样,考察其稳定性,结果见表6。结果显示,随着室温放置时间的延长,虽然组分A的峰面积变化不大,二者总面积也变化不大,但是组分B的峰面积逐渐增大(增大了60%左右)。因此,在拟定方法中规定供试品溶液现配现用。

表6 供试品溶液稳定性测定结果表
2.4 供试品测定 采用拟定方法对14批不同规格那西肽预混剂的组分进行测定。测定结果见表7。
2.5 结果分析 由结果可知,不同生产企业组分A的差距较大,从98.3%至83.9%不等,根据中国兽药协会提供的相关资料可查,企业内各批次间的组分也有较大差异,但约90%的产品均可符合组分A不小于88.0%这一限度,再结合各企业的内部控制标准相关规定,拟将那西肽预混剂组分A的限度规定为不小于88.0%。

表7 14批那西肽预混剂组分测定结果统计表
3 讨论
3.1 溶媒的选择 文献方法[5]中,供试品溶液配制第一步溶解与提取过程与效价含量测定方法基本一致,而第二步稀释过程采用甲醇。将第二步也更改为与效价测定方法一致,即采用二甲基甲酰胺4 mL及磷酸盐缓冲液-乙醇(85:15)稀释。这一改变可以使组分测定直接采用效价测定项下每1 mL约含25单位的供试品溶液,简化实验操作,节省试剂消耗。将溶媒更改前与更改后的那西肽标准品色谱进行了比较,发现除溶剂峰稍有差别外,那西肽组分A的理论塔板数及A与B的分离度均不受影响。
3.2 色谱柱的选择 文献方法中,填充剂类型有苯基键合硅胶[4,6]和十八烷基键合硅胶[5]2种。将2种色谱柱类型进行了比较,结果发现那西肽组分A的理论塔板数及A与B的分离度均可符合要求,因此拟采用实验室更为通用的十八烷基键合硅胶柱进行测定。
3.3 检测波长的选择 采用PDA检测器对那西肽组分A与B进行了全波长扫描,结果发现二者均在217和333 nm附近有最大吸收。我们尝试将检测波长更改为217 nm,结果发现溶剂峰影响增强,甚至将组分B部分覆盖。而将检测波长更改为333 nm,虽然溶剂峰的影响会大大降低,但会使组分A与B的响应均减弱。因此仍采用241 nm作为检测波长。
3.4 流动相的选择 尝试将流动相中的乙腈更换为甲醇,结果发现在100 min内那西肽组分A与B均未出峰,将甲醇换回乙腈后才可将组分A与B冲出。这表明甲醇对组分A与B保留过强,不适宜作本方法的流动相。而后尝试将0.025%的磷酸水溶液更换为水,结果发现会导致组分A与B的分离度显著降低(其他色谱条件相同的情况下,组分A与B的分离度由5.0降低至2.3)。因此仍采用参考方法[5]中的流动相:乙腈-0.025%磷酸水溶液(50∶50)。
3.5 那西肽组分B与组分A相对保留时间的确定 考察了不同品牌色谱柱及不同流速那西肽组分B相对A的保留时间。结果组分B相对A的保留时间为0.80或0.74。考虑到不同品牌色谱柱对相对保留时间的影响较大,因此采用标准品溶液定位的方法确定组分B相对A的保留时间。
[1] 沈顺新,任银娥. 那西肽对猪生长性能的影响[J]. 中国畜牧兽医,2008, 35(11): 151-152.
[2] 孙小青,宋代军. 那西肽的饲用性质及其应用[J]. 饲料研究,2007(12): 36-38.
[3] 中国兽药典委员会. 兽药国家标准化学药品、中药卷(第一册),那西肽预混剂[S].
[4] 张秀英,陆连寿,温芳,等. 国家那西肽标准品的研制与建立[J]. 中国兽药杂志,2014,48(12): 50-53.
[5] 段红,翟科峰,刘瑞华,等. HPLC测定那西肽预混剂中那西肽的含量[J]. 光谱实验室,2012, 29(2): 836-839.
[6] 张秀英,陆连寿,温芳,等. 高效液相色谱法测定那西肽的纯度[J]. 中国兽药杂志,2013,47(7): 22-24.
(编辑:陈希)
The Establishment of The HPLC Method to Determine Component in Nosiheptide Premix
HAN Ning-ning, XU Yuan, YU Li-na, HAO Li-hua, ZHAO Hui*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
The HPLC method of component determination for Nosiheptide premix was established. The operation conditions were performed on C18 column with a mobile phase of 0.025% phosphoric acid solution-acetonitrile (50∶50). The detection wavelength was 241 nm. According to this method, the component of 14 batches of Nosiheptide premix from 7 manufacturers was determined. Based on the results, a proposed limitation of the component was given: the peak area of Nosiheptide component A can not less than 88.0% of the total peak area of component A and B.This method has special property, good durability and simple operation.
Nosiheptide premix; component; HPLC method
韩宁宁,硕士,从事抗生素检验及检测方面工作。
赵晖。E-Mail:171977364@qq.com
2015-08-19
A
1002-1280 (2015) 10-0027-05
S859.796
