微生态制剂治疗2型糖尿病临床随机对照研究的meta分析及系统评价
2015-03-09马建伟徐丽梅孟庆扬
陈 硕,马建伟,徐丽梅,孟庆扬,韩 琦
·论著·
微生态制剂治疗2型糖尿病临床随机对照研究的meta分析及系统评价
陈硕,马建伟,徐丽梅,孟庆扬,韩琦
[摘要]目的应用meta分析系统评价微生态制剂对2型糖尿病(diabetes mellitus, DM)患者糖化血红蛋白、空腹血糖、空腹胰岛素水平、氧化应激指标及炎性指标的影响。方法计算机检索Cochrane图书馆、PubMed、EMBASE、Wiley、SCI、CNKI、VIP、CBM数据库,按照Cochrane系统评价方法查找微生态制剂治疗2型DM的所有随机对照试验(RCT)文献,对符合纳入标准的文献进行数据提取和质量评价后,采用Rev-Man 5.0软件进行meta分析。结果最终共纳入7篇RCT,研究质量相对较高,偏倚风险较低。meta分析结果显示:①微生态制剂疗程≥8周可有效降低2型DM患者糖化血红蛋白水平[SMD=-0.60,95%CI(-1.05,-0.15)];微生态制剂能有效降低2型DM患者空腹血糖[SMD=-0.46,95%CI(-0.86,-0.05)]及空腹胰岛素水平[SMD=-1.01,95%CI(-2.00,-0.02)]。②微生态制剂可提高2型DM患者谷胱甘肽过氧化物酶水平[SMD=2.77,95%CI(0.05,5.48)]、降低超敏C反应蛋白(hs-CRP)水平[SMD=-2.89,95%CI(-5.04,-0.74)]。6篇RCT研究均报道微生态制剂治疗期间无不良反应事件发生,1篇无描述。结论现有证据支持微生态制剂作为辅助治疗可在一定程度上有效控制2型DM患者血糖,改善机体的氧化应激状态,降低全身低度炎性反应,且安全性较好,但其远期疗效及安全性有待开展更多高质量、大样本、长期随访的RCT研究加以验证。
[关键词]微生态制剂;糖尿病,2型;Meta分析;系统评价;随机对照试验
[DOI]10.3969/j.issn.2095-140X.2015.08.009
糖尿病(diabetes mellitus, DM)的发病率急剧增加,我国2010年DM横断面调查显示≥18岁居民DM患病率高达9.65%,较1980年增加了10倍[1]。DM防治已成为我国最主要的公共卫生问题之一。虽然目前有大量治疗DM的药物,但长期血糖控制仍不理想,导致大量DM并发症发生,严重影响人们的生活质量[2]。近年来关于肠道微生态失衡学说作为2型DM发生发展的可能机制引起了人们的广泛重视。研究发现,DM患者和健康人的肠道菌群在种类和数量上都存在显著的差异[3]。在2型DM患者中肠道细菌与维生素和辅因子合成相关的菌群,产生丁酸、硫酸还原以及黏液素降解相关的菌群均发生了显著变化,使得宿主的异生物质代谢和氧化应激发生改变[4]。此外,肠道细菌通过激活脂多糖,导致代谢性内毒素血症,形成全身低度炎性状态[5-8],引起2型DM的发生。因此,肠道微生态治疗策略作为2型DM控制和预防的新方法引起了人们的广泛关注。微生态制剂又称为微生态调节剂,是利用对宿主有益无害的正常菌群或促进物质制成的制剂,具有调整微生态失调、促进肠道有益菌群的增长、调节肠道菌群活性及组成、保持微生态平衡的作用,包括益生菌、益生元和合生元[9]。虽然国外关于微生态制剂对血糖、血脂等代谢性指标影响的临床试验已经展开(国内暂无相关临床研究),但现有研究结果不尽相同,且目前针对此类研究的循证医学评价国内外鲜有报道。鉴于此,本研究旨在采用meta分析的方法对微生态制剂治疗2型DM的有效性和安全性进行系统评价,以期为临床用药提供依据,以及更好地指导临床研究。
1资料与方法
1.1纳入与排除标准
1.1.1纳入标准:①随机对照试验,盲法采用双盲或三盲,文种限于中文或英文。②18岁以上2型DM患者,DM诊断标准符合WHO或美国糖尿病协会(ADA)标准,患者种族、性别及DM病程不限。③试验组给予微生态制剂治疗(可以是单一制剂或复合制剂,试验菌株、合并用药、给药时间、剂量均不限,疗程≥4周);对照组给予安慰剂或单纯常规治疗。④主要结局指标为糖化血红蛋白水平、空腹血糖水平,次要结局指标为空腹胰岛素水平、氧化应激及炎性反应指标。
1.1.2排除标准:①描述性研究、重复发表、未获得全文的文献;②文献重要资料不全,排除有严重心、肺、肝、肾等脏器功能不全以及妊娠糖尿病患者,且联系作者未回复者;③动物实验及非原始文献。
1.2文献检索计算机检索Cochrane图书馆(2015年第2期)、PubMed(1978年1月—2015年5月)、EMBASE(1974年1月—2015年5月)、Wiley(1807年1月—2015年5月)、SCI(1961年1月—2015年5月)、CNKI(1978年1月—2015年5月)、VIP(1989年1月—2015年5月)、CBM(1978年1月—2015年5月)。英文检索词:“probiotics”、“prebiotics”、“synbiotics”、“lactobacillus”、“bifidobacterium”、“clostridium butyricum”、“streptococcus thermopbilus”、“fermented”、“sour milk”、“inulin” 、“FOS”,以上检索词以OR相连,再以AND与检索词“diabetes”、“glucose”(以上4个检索词以OR相连)相连,最后以AND与检索词“randomized controlled trial”、“random”相连;中文检索词:“益生菌”、“益生元”、“合生元”、“乳酸菌”、“双歧杆菌”、“乳酸菌”、“酪酸菌属”、“丁酸梭菌”、“嗜热链球菌”等,以上检索词为“或”、“或含”关系,再以“与”、“和”关系与检索词“糖尿病”相连,最后以“与”、“和”的关系与检索词“治疗”以及“随机对照”相连,采用自由词检索。同时手工检索综述或纳入研究的参考文献,以期减少漏检。
1.3数据提取与方法学质量评价由2名评价员独立进行文献筛选、数据提取和质量评价。首先各自独立阅读文献题目及摘要,若是随机对照试验(RCT)并出现微生态制剂治疗字样的文献则阅读全文,提取内容包括第一作者、发表年份、干预措施、疗程及反映临床疗效的相应指标等,而后交叉核对,必要时联系原文作者确定试验的实施过程,如有分歧讨论解决或由第三者判定。采用Cochrane系统评价员手册(5.1.0版)中RCT的偏倚风险评价标准评价纳入研究的方法学质量,具体内容包括:①随机分配方法;②分配方案隐藏;③盲法;④结局数据的完整性;⑤选择性报告研究结果;⑥其他偏倚来源。针对上述6项采用“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的评价。
1.4统计学方法meta分析采用Cochrane协作网提供的Rev-Man 5.0软件进行分析。对于二分类变量使用相对危险度(relative risk,RR),连续性变量中采用相同标准计算的结局变量应用均差(mean difference,MD)和均差标准误(standard error of mean difference,SEMD)对结局变量进行比较,对连续性变量中采用不同标准进行计算的结局变量采用标准均差(standard mean difference,SMD)进行比较,区间估计采用95%可信区间(CI)。采用χ2检验分析其统计学异质性,若P>0.10,可认为多个同类研究具有同质性,采用固定效应模型计算合并统计量,反之采用随机效应模型,并尽量分析异质性的来源及原因,再进行亚组分析和敏感性分析。如果纳入研究数量≥9个,采用漏斗图分析是否存在发表偏倚。
2结果
2.1文献检索结果数据库检索及手工检索共获得556篇文献,剔除重复发表、不符合要求的文献,最终纳入7篇RCT[10-16]。文献筛选流程及结果见图1,纳入研究文献的基本特征见表1。

图1微生态制剂治疗2型糖尿病纳入文献筛选流程及结果

表1 微生态制剂治疗2型糖尿病纳入研究文献基本特征
注:T为试验组,C为对照组;X:Lactobacillus acidophilus (2×109CFU), L. casei (7×109CFU), L. rhamnosus (1.5×109CFU), L. bul-garicus (2×108CFU), Bifidobacterium breve (2×1010CFU),B. longum (7×109CFU), Streptococcus thermophilus (1.5×109CFU), and 100 mg fructo-oligosaccharide;Y与X同等剂量,但不含益生菌。

2.2方法学质量评价7篇纳入研究文献的质量相对较高,均采用随机方法,盲法采用双盲或三盲,其中1篇[12]研究分配隐藏方案未做具体描述。所有纳入研究综合评价,偏倚风险较低。见表2。
2.3meta分析结果
2.3.1微生态制剂对2型DM糖化血红蛋白、空腹血糖及胰岛素水平的影响:
2.3.1.1糖化血红蛋白:本研究纳入的7篇RCT中5篇[10-13,16]观察了微生态制剂干预前后患者糖化血红蛋白变化情况,3篇文献[10-12]认为微生态制剂可明显降低2型DM患者糖化血红蛋白水平,与对照组相比差异有统计学意义(P<0.05);2篇文献[13,16]认为该类制剂对2型DM患者糖化血红蛋白无明显降低作用。1篇RCT[16]存在明显的发表偏倚,故4篇[10-13]RCT纳入meta分析,共189例患者,试验组94例,对照组95例,4篇研究间存在异质性(P=0.08,I2=55%),采用随机效应模型合并统计量,meta分析显示微生态类制剂对2型DM患者糖化血红蛋白无明显降低作用[SMD=-0.18,95%CI(-0.59,0.22)]。而根据疗程进行亚组分析显示,疗程≥8周亚组给予微生态制剂可降低2型DM患者糖化血红蛋白水平[SMD=-0.60,95%CI(-1.05,-0.15)];疗程<8周亚组给予微生态制剂对2型DM患者糖化血红蛋白的影响与对照组相比无显著性差异[SMD=0.11,95%CI(-0.21,0.42)]。见图2。

表2 纳入研究方法学/偏倚评价±s)
注:T为试验组,C为对照组;ITT分析为意向性分析



图2 4篇纳入文献微生态制剂对2型糖尿病糖化血红蛋白水平影响的meta分析
2.3.1.2空腹血糖:本研究纳入的7篇RCT[10-16]均报道了微生态制剂干预前后空腹血糖水平,其中5篇RCT[10-12,15-16]认为微生态制剂可明显降低2型DM患者空腹血糖,与对照组相比差异有统计学意义(P<0.05)。7篇RCT[10-16]均纳入meta分析,共387例患者,其中试验组193例,对照组194例。各研究间存在异质性(P=0.002,I2=72%),采用随机效应模型合并统计量,meta分析显示微生态制剂可有效降低2型DM患者空腹血糖水平,差异有统计学意义[SMD=-0.46,95%CI(-0.86,-0.05)]。见图3。


图3 7篇纳入文献微生态制剂对2型糖尿病空腹血糖水平影响的meta分析
2.3.1.3空腹胰岛素:本研究纳入文献中5篇[10-11,13-14,16]观察了微生态制剂干预前后空腹胰岛素水平变化情况,仅有1篇文献[14]认为微生态制剂可明显降低2型DM患者空腹胰岛素水平(P<0.05)。此5篇文献[10-11,13-14,16]均行meta分析,共307例患者,试验组153例,对照组154例,各研究间存在明显异质性(P<0.01,I2=93%),采用随机效应模型合并统计量,meta分析结果显示微生态制剂能有效降低2型DM患者空腹胰岛素水平[SMD=-1.01,95%CI(-2.00,-0.02)]。见图4。


图4 5篇纳入文献微生态制剂对2型糖尿病空腹胰岛素水平影响的meta分析
2.3.2微生态制剂对2型DM患者氧化应激指标超氧化物歧化酶(SOD)、丙二醇(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、总抗氧化能力(TAS)及超敏C反应蛋白(hs-CRP)的影响:
2.3.2.1SOD、MDA水平:本研究纳入文献中2篇[10-11]报道了对SOD、MDA的影响,均认为微生态制剂可明显提高2型DM患者的SOD水平、降低MDA水平(P<0.05)。而meta分析结果显示:目前证据不支持微生态制剂可提高2型DM患者SOD水平[MD=38.11,95%CI(-26.60,102.81)],降低MDA水平[MD=-0.74,95%CI(-2.29,0.80)]。见图5、图6。
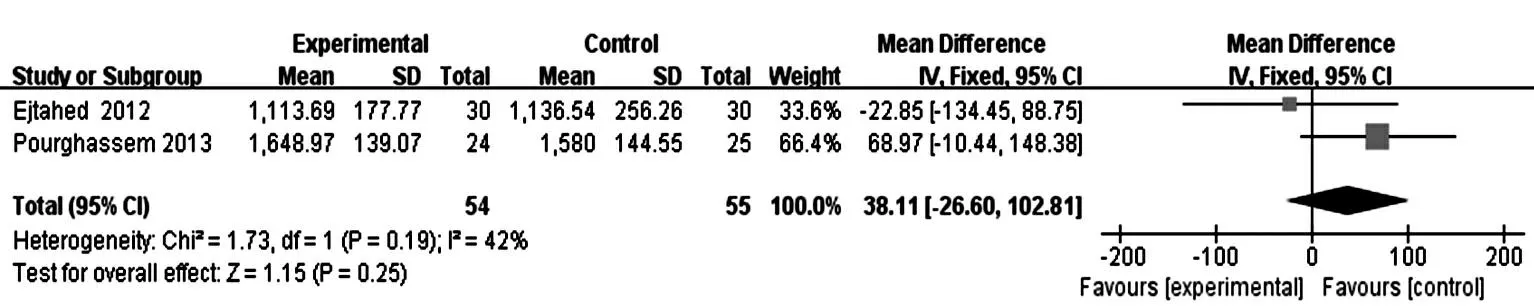

图5 2篇纳入文献微生态制剂对2型糖尿病超氧化物歧化酶水平影响的meta分析
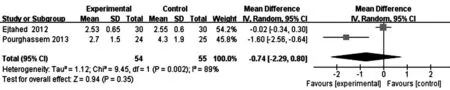

图6 2篇纳入文献微生态制剂对2型糖尿病丙二醇水平影响的meta分析
2.3.2.2GSH-Px水平:本研究纳入文献中4篇[10-11,14,16]报道了对GSH-Px的影响,其中3篇[10,14,16]认为微生态制剂可升高2型DM患者GSH-Px水平(P<0.05),1篇[11]认为该类制剂对2型DM患者GSH-Px无显著升高作用(P>0.05)。各研究间存在明显异质性(P<0.01,I2=98%),采用随机效应模型合并统计量,meta分析结果显示微生态制剂可以有效提高2型DM患者GSH-Px水平[SMD=2.77,95%CI(0.05,5.48)]。见图7。
2.3.2.3TAS水平:本研究纳入文献中4篇[10-11,14,16]报道了对TAS的影响,2篇[10-11]认为微生态制剂可明显提高2型DM患者TAS(P<0.05),2篇[14,16]认为该类制剂较对照组相比对TAS无明显提升作用(P>0.05)。各研究间存在明显异质性(P=0.002,I2=85%),采用随机效应模型合并统计量,meta分析结果显示:目前证据不足以证明微生态制剂可提高2型DM患者TAS水平[SMD=0.56,95%CI(-0.08,1.19)]。见图8。


图7 4篇纳入文献微生态制剂对2型糖尿病谷胱甘肽过氧化物酶水平影响的meta分析


图8 4篇纳入文献微生态制剂对2型糖尿病总抗氧化能力水平影响的meta分析
2.3.2.4hs-CRP水平:本研究纳入文献中2篇[14,16]报道了对hs-CRP的影响,均认为微生态制剂可明显降低2型DM患者hs-CRP水平(P<0.05)。研究间存在明显异质性(P<0.01,I2=96%),采用随机效应模型合并统计量,meta分析结果显示:微生态制剂可以有效降低2型DM患者hs-CRP水平[SMD=-2.89,95%CI(-5.04,-0.74)]。见图9。
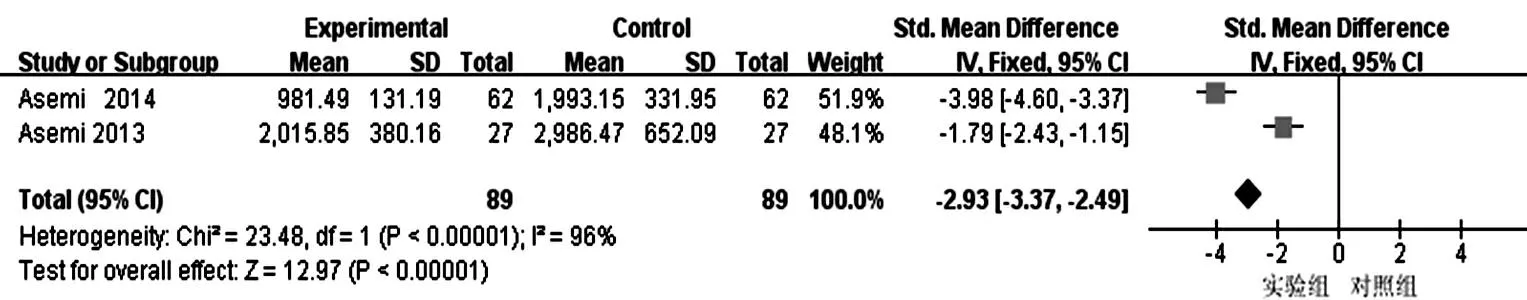

图9 2篇纳入文献微生态制剂对2型糖尿病超敏C反应蛋白水平影响的meta分析
2.3安全性分析本研究纳入文献中6篇[10-14,16]报道了试验组和对照组不良反应的发生情况,在应用微生态制剂治疗过程中均无不良反应发生,认为微生态制剂有较好的安全性;1篇[15]对不良反应的发生与否未做报道。
3讨论
本文系统评价了微生态制剂对2型DM患者糖化血红蛋白、空腹血糖、空腹胰岛素水平及氧化应激、炎性指标的影响,结果显示,目前证据支持微生态制剂可降低2型DM患者的血糖水平,改善胰岛素抵抗及氧化应激状态,并具有较好的安全性。
2型DM的发生、发展与体内能量代谢异常密切相关。失衡的肠道菌群通过促进短链脂肪酸(SCFAs)的生成[17]、分泌肠衍生肽[18]、减少禁食脂肪诱导因子(Fiaf)表达及增加脂蛋白酶活性[19]共同影响糖、脂代谢,使机体能量摄入增加,导致肥胖和胰岛素抵抗。此外,失衡的肠道菌群使血液内毒素水平升高,通过激活TLR4路径形成低度炎性反应[5-6],从而导致系统形成显著的氧化应激状态[4,20]。氧化应激通过破坏细胞的线粒体结构、诱导细胞凋亡、激活核转录因子κB (nuclear transcription factor κB, NF-κB)信号通路、引起细胞炎性反应、抑制胰十二指肠同源盒因子1 (pancreatic and duodenal homeobox 1, PDX-1)的核质易位等多种途径,导致β细胞功能衰退[21-23],通过干扰胰岛素信号传递通路的多个元件,引起胰岛素抵抗[24-25],最终共同促使2型DM的发生、发展。
微生态制剂与2型DM相关的作用机制主要包括改善肠道菌群、调节代谢[26]、改善肠道屏障[27]以及调节免疫炎性反应等[28-29],各作用机制之间相互关联,从而改善机体的代谢紊乱状态。国外一项meta分析评价了微生态制剂对肥胖患者血糖、胰岛素及血脂的影响,结果显示微生态制剂可降低患者总胆固醇、甘油三酯、低密度脂蛋白、空腹血糖及胰岛素水平,提高高密度脂蛋白水平,改善糖、脂代谢[30-31]。本系统评价研究发现微生态制剂可降低2型DM患者空腹血糖及胰岛素水平,对糖化血红蛋白水平的影响经亚组分析显示,微生态制剂治疗疗程≥8周,可降低2型DM患者的糖化血红蛋白水平,与对照组相比差异显著,与上述研究结果基本一致。目前,国外多项实验研究认为,微生态制剂具有调节人体氧化应激水平的潜能。D'Souza等[32]发现微生态制剂能调节SOD、GSH-Px等氧化应激调节因子的基因信使RNA表达水平,提高机体的抗氧化应激能力。根据现有证据,本系统评价认为微生态制剂可改善2型DM患者氧化应激及低度炎性反应状态。
尽管本系统评价纳入的7篇研究均为随机、对照、双盲或三盲试验,研究质量相对较高,所得结论较可靠。但在研究设计上存在以下局限性:微生态制剂种类的多样性,有益生菌[10,12],益生元[11,13]及二者的混和制剂合生元[14-16],且菌株种类、用药剂量、用药时机及组合方式上均缺乏统一规范;部分RCT观察疗程不足[10,13,15]。本系统评价因原始研究的数量、设计及报告等原因,尚存在一些缺陷:未能对微生态制剂的治疗进行亚组分析,例如微生态制剂的给予方式、益生菌组成成分的差异等;检索文种仅为中文和英文,可能存在发表偏倚;本次研究纳入文献样本量较小,降低了检验效能;因原始研究发表数量的局限,未做发表偏倚分析。
综上所述,目前证据支持微生态制剂能一定程度降低2型DM患者血糖水平、改善胰岛素抵抗及氧化应激状态,且安全性较好。应用于我国2型DM患者的辅助治疗,对糖尿病患者可能带来潜在的益处。但因此次研究纳入文献数量有限,研究设计质量的局限性,研究人群的异质性,干预措施中各种微生态制剂种类、形式和数量的不同,以及试验持续时间的长短差异均增加了本研究的难度,使证据强度级别受限。
[参考文献]
[1]Yang W, Lu J, Weng J,etal. Prevalence of diabetes among men and women in China[J].N Engl J Med, 2010,362(12):1090-1101.
[2]Ryden L, Standl E, Bartnik M,etal. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD)[J].Eur Heart J, 2007,28(1):88-136.
[3]Larsen N, Vogensen F K, van den Berg F W,etal. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].PLoS One, 2010,5(2):e9085
[4]Qin J, Li Y, Cai Z,etal. A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature, 2012,490(7418):55-60.
[5]Shi H, Kokoeva M V, Inouye K,etal. TLR4 links innate immunity and fatty acid-induced insulin resistance[J].J Clin Invest, 2006,116(11):3015-3025.
[6]Cani P D, Amar J, Iglesias M A,etal. Metabolic endotoxemia initiates obesity and insulin resistance[J].Diabetes, 2007,56(7):1761-1772.
[7]Amar J, Burcelin R, Ruidavets J B,etal. Energy intake is associated with endotoxemia in apparently healthy men[J].Am J Clin Nutr, 2008,87(5):1219-1223.
[8]Cani P D, Possemiers S, Van de Wiele T,etal. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2-driven improvement of gut permeability[J].Gut, 2009,58(8):1091-1103.
[9]Roberfroid M, Gibson G R, Hoyles L,etal. Prebiotic effects: metabolic and health benefits[J].Br J Nutr, 2010,104(Suppl 2):S1-S63.
[10]Ejtahed H S, Mohtadi-Nia J, Homayouni-Rad A,etal. Probiotic yogurt improves antioxidant status in type 2 diabetic patients[J].Nutrition, 2012,28(5):539-543.
[11]Pourghassem Gargari B, Dehghan P, Aliasgharzadeh A,etal. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes[J].Diabetes Metab J, 2013,37(2):140-148.
[12]Ostadrahimi A, Taghizadeh A, Mobasseri M,etal. Effect of probiotic fermented milk (kefir) on glycemic control and lipid profile In type 2 diabetic patients: a randomized double-blind placebo-controlled clinical trial[J].Iran J Public Health, 2014,44(2):228-237.
[13]Luo J, Van Yperselle M, Rizkalla S W,etal. Chronic Consumption of Short-Chain Fructooligosaccharides Does Not Affect Basal Hepatic Glucose Production or Insulin Resistance in Type 2 Diabetics'[J]. J Nutr, 2000, 130(6): 1572-1577.
[14]Asemi Z, Khorrami-Rad A, Alizadeh S A,etal. Effects of synbiotic food consumption on metabolic status of diabetic patients: a double-blind randomized cross-over controlled clinical trial[J].Clin Nutr, 2014,33(2):198-203.
[15]Moroti C, Souza Magri L F, de Rezende Costa M,etal. Effect of the consumption of a new symbiotic shake on glycemia and cholesterol levels in elderly people with type 2 diabetes mellitus[J].Lipids Health Dis, 2012,11:29.
[16]Asemi Z, Zare Z, Shakeri H,etal. Effect of multispecies probiotic supplements on metabolic profiles, hs-CRP, and oxidative stress in patients with type 2 diabetes[J].Ann Nutr Metab, 2013,63(1-2):1-9
[17]Layden B T, Angueira A R, Brodsky M,etal. Short chain fatty acids and their receptors: new metabolic targets[J].Transl Res, 2013,161(3):131-140.
[18]Samuel B S, Shaito A, Motoike T,etal. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J].Proc Natl Acad Sci U S A, 2008,105(43):16767-16772.
[19]Backhed F, Ding H, Wang T,etal. The gut microbiota as an environmental factor that regulates fat storage[J].Proc Natl Acad Sci U S A, 2004,101(44):15718-15723.
[20]Donath M Y, Boni-Schnetzler M, Ellingsgaard H,etal. Islet inflammation impairs the pancreatic beta-cell in type 2 diabetes[J].Physiology (Bethesda), 2009,24:325-331.
[21]Kajimoto Y, Kaneto H. Role of oxidative stress in pancreatic beta-cell dysfunction[J].Ann N Y Acad Sci, 2004,1011:168-176.
[22]Valko M, Leibfritz D, Moncol J,etal. Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Biochem Cell Biol, 2007,39(1):44-84.
[23]Drews G, Krippeit-Drews P, Dufer M. Oxidative stress and beta-cell dysfunction[J].Pflugers Arch, 2010,460(4):703-718.
[24]Henriksen E J, Diamond-Stanic M K, Marchionne E M. Oxidative stress and the etiology of insulin resistance and type 2 diabetes[J].Free Radic Biol Med, 2011,51(5):993-999.
[25]Rains J L, Jain S K. Oxidative stress, insulin signaling, and diabetes[J].Free Radic Biol Med, 2011,50(5):567-575.
[26]Yadav H, Jain S, Sinha P R. Antidiabetic effect of probiotic dahi containing Lactobacillus acidophilus and Lactobacillus casei in high fructose fed rats[J].Nutrition, 2007,23(1):62-68.
[27]Madsen K, Cornish A, Soper P,etal. Probiotic bacteria enhance murine and human intestinal epithelial barrier function[J].Gastroenterology, 2001,121(3):580-591.
[28]Collado M C, Meriluoto J, Salminen S. Role of commercial probiotic strains against human pathogen adhesion to intestinal mucus[J].Lett Appl Microbiol, 2007,45(4):454-460.
[29]Samuel B S, Shaito A, Motoike T,etal. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J].Proc Natl Acad Sci U S A,2008, 105(43):16767-16772.
[30]Beserra B T, Fernandes R, do Rosario V A,etal. A systematic review and meta-analysis of the prebiotics and synbiotics effects on glycaemia, insulin concentrations and lipid parameters in adult patients with overweight or obesity[J].Clin Nutr, 2014,10(1):1-14.
[31]段力园,刘晨曦,赵静,等.胰岛素抵抗状态下脂代谢和炎性反应相互关系研究进展[J].解放军医药杂志,2014,26(9):101-106.
[32]D'Souza A, Fordjour L, Ahmad A,etal. Effects of probiotics, prebiotics,and synbiotics on messenger RNA expression of caveolin-1,NOS,and genes regulating oxidative stress in the terminal ileum of formula-fed neonatal rats[J].Pediatr Res, 2010,67(5):526-531.
(收稿时间:2015-07-06修回时间:2015-07-25)
A Meta-analysis and System Assessment of Micro-ecologic Agents in Treatment of Type 2 Diabetes Mellitus Patients by Randomised Control Trial
CHEN Shuo, MA Jian-wei, XU Li-mei, MENG Qing-yang, HAN Qi
(Department of Traditional Chinese Medicine, General Hospital of Air Force, Beijing 100142, China)
[Abstract]ObjectiveTo evaluate the effects of micro-ecologic agents on levels of glycated hemoglobin (HbA1c), fasting plasma glucose (FPG) and fasting serum insulin, and oxidative stress and inflammatory indexes in patients with type 2 diabetes mellitus (DM) using meta-analysis. MethodsThe papers of randomized controlled trials (RCT) were searched from Cochrane Library, PubMed, EMbase, Wiley, SCI, CNKI, VIP and CBM databases. The data extraction and quality evaluation were performed for the selected papers, and then meta-analysis was performed using Rev-Man 5.0 software. ResultsA total of 7 RCTs were included in this study with good study quality and little misregistration risk. The results of meta-analyses,showed that the HbA1c levels of patients with type 2 DM significantly decreased when the therapeutic time was equal or more than 8 weeks [SMD=-0.60, 95%CI(-1.05 to -0.15)], and levels of FPG [SMD=-0.46, 95%CI(-0.86 to -0.05)] and fasting serum insulin [SMD=-1.01, 95%CI(-2.00 to -0.02)] could be also effectively decreased after treatment of micro-ecologic agents. The levels of glutathion peroxidase [SMD=2.77,95%CI(0.05 to 5.48)] of patients with type 2 DM effectively increased, and hs-CRP levels [SMD=-2.89, 95%CI(-5.04 to -0.74)] were effectively decreased after treatment of micro-ecologic agents. There was no adverse events in 6 RCTs during the treatment, and there was no report about adverse events in 1 RCT. ConclusionThe adjunctive therapy with micro-ecologic agents may effectively control blood glucose, improve the oxidative stress state and decrease the systemic low-grade inflammatory reaction in a certain extent with good safety for patients with type 2 DM, but long-term efficacy and safety need to be verified by more RCTs with better quality, larger samples and long-term follow-up.
[Key words]Micro-ecologic agents; Diabetes mellitus, type 2; Meta-analysis; System assessment; Randomized controlled trial
[文献标志码][中国图书资料分类号]R587.1A
[文章编号]2095-140X(2015)08-0039-08
[通讯作者]马建伟,E-mail:mjw8166@163.com
[基金项目]首都医学发展基金(SF-2009-I-13);首都临床特色应用研究课题(Z121107001012011)
[作者单位]100142 北京,空军总医院中医科
