细粒棘球蚴14-3-3重组抗原诱导小鼠体液免疫应答的研究
2015-03-09李宗吉
李宗吉,赵 巍
(1.宁夏医科大学 临床检验与血液检验教研室,宁夏 银川 750004;2.宁夏医科大学 科技中心,宁夏 银川 750004)
包虫病是由棘球绦虫的幼虫感染并寄生于人畜体内引发的一种呈世界性分布的人畜共患寄生虫病,该病严重危害人类的健康和农牧业经济的发展,是全球性的公共卫生问题[1]。我国是包虫病发病率最高的国家之一,该病被列为我国重点防治的寄生虫病[2]。目前研制包虫病新型疫苗,进行免疫预防是预防和控制包虫病传播的最为理想的方法[3]。
本实验室前期已经构建并表达了细粒棘球绦虫原头蚴(Echinococcus granulosus,Eg)14-3-3 重组蛋白(rEg14-3-3),初步免疫学研究表明该重组蛋白具有良好的抗原性和免疫原性,并可以诱导小鼠产生较高的免疫保护力,其中体液免疫应答在免疫保护中起重要作用[4]。此外,滤泡辅助性T 细胞(Tfh)在体液免疫应答中也具有重要作用。其主要功能是促进B 细胞的活化、增殖和分化,生成抗原特异性浆细胞及维持长效免疫应答的记忆B 细胞,并参与抗体类别的转化。而Tfh 在寄生虫感染的体液免疫应答中的作用鲜有报道[5-7]。本实验通过免疫前后及原头蚴攻击感染前后小鼠血清中特异性IgG、IgE 及其抗体亚型的动态观察,并检测Tfh 细胞的主要效应分子IL-21 的表达情况,为研究重组疫苗免疫机理和Tfh 细胞在细粒棘球蚴感染及重组疫苗诱导的抗感染免疫应答中的作用提供实验依据。
1 材料和方法
1.1 主要实验材料 rEg14-3-3 由本实验室经原核表达并纯化;Eg 为从宁夏医科大学附属医院肝胆外科包虫病患者手术摘除的完整包囊中无菌条件下抽取囊液,分离原头蚴,采用5 g/L 伊红染色计数原头蚴的着色率及形态,原头蚴的存活率>95 %,经PBS 稀释为1.5×107个/L 悬液,用于攻击感染ICR小鼠。40 只6 周龄~8 周龄雄性ICR 小鼠(体质量为18 g±2 g)购自宁夏医科大学实验动物中心;HRP 标记的山羊抗小鼠IgG、IgG1、IgG3、IgG2a、IgG2b及IgE 均购自华美生物工程公司北京分公司;IL-21检测试剂盒购自上海自信裕生物科技有限公司。
1.2 实验设计 将ICR 小鼠随机分为rEg14-3-3 免疫组和佐剂对照组,每组20 只。于0、2 周、4 周背部皮下多点注射各免疫1 次,共3 次,免疫组首免注射rEg14-3-3 10 μg/只和等量弗氏完全佐剂,以后2 次为加强免疫均采用10 μg/只的rEg14-3-3和等量弗氏不完全佐剂。佐剂对照组免疫方案相同,只注射弗氏佐剂和PBS,注射量为100 μL/只。于0、1 周、2 周、4 周、6 周、9 周、10 周、18 周、30 周和36 周尾部采血,分离血清,-85 ℃保存。
1.3 攻击感染 将收集得到的活的原头蚴立即注射到实验组和对照组末次免疫4 周后小鼠的腹腔,每组每只小鼠腹腔注射2 000 只活的原头蚴。
1.4 血清收集 在小鼠免疫rEg14-3-3 后的0、2周、4 周、6 周以及攻击感染后2 周(初次免疫后10周)、10 周(初次免疫后18 周)、16 周(初次免疫后24 周)及36 周分别从尾部静脉采血,每次每组5只,室温静置6 h,3 000 r/min 离心10 min,收集8个时间点的血清,-85 ℃冻存待测。
1.5 IL-21、IgG及其亚型和IgE抗体水平的检测按照试剂盒说明对IL-21 进行检测。采用终浓度为10 mg/L rEg14-3-3 PBS 缓冲液(pH9.6)包被96 孔酶标板,100 μL/孔,4 ℃过夜;50 g/L 脱脂奶粉37 ℃封闭2 h;加1∶100 稀释的蛋白免疫组或对照组小鼠血清,100 μL/孔,37 ℃反应2 h;分别加入1∶1 000稀释的山羊抗小鼠IgG、IgG1、IgG2a、IgG2b、IgG3 或IgE-HRP,100 μL/孔,37 ℃反应2 h;TMB底物显色后测定每孔OD490nm值。检测免疫及攻击感染前后8 个时间点小鼠血清中IgG、IgG1、IgG3、IgG2a、IgG2b 和IgE 水平的动态变化。
1.6 免疫保护力的计算 原头蚴攻击感染24 周后迫杀两组小鼠,检查并计数肝脏及肠系膜处的棘球蚴包囊,计算免疫保护力:免疫保护力(%)=(1-免疫组平均包囊数/对照组平均包囊数)×100 %
1.7 统计学分析 采用SPSS11.0 软件进行分析,组间比较采用单因素方差分析(ANOVA)。
2 结果
2.1 IgG 抗体检测结果 对rEg14-3-3 免疫前后和攻击感染后实验组小鼠及对照组小鼠血清抗体IgG进行检测,结果显示,实验组小鼠在rEg14-3-3 免疫后IgG 抗体水平随着时间和免疫次数的增加迅速升高,在首免2 周后rEg14-3-3 免疫组小鼠IgG 抗体与对照组即有显著性差异(p<0.05);原头蚴攻击感染后2 周(初次免疫后10 周)两组抗体水平均显著升高,实验组抗体水平在10 周达到峰值,对照组小鼠抗体水平在18 周达到峰值,此后两组小鼠抗体在较长时间内维持较高水平(图1)。
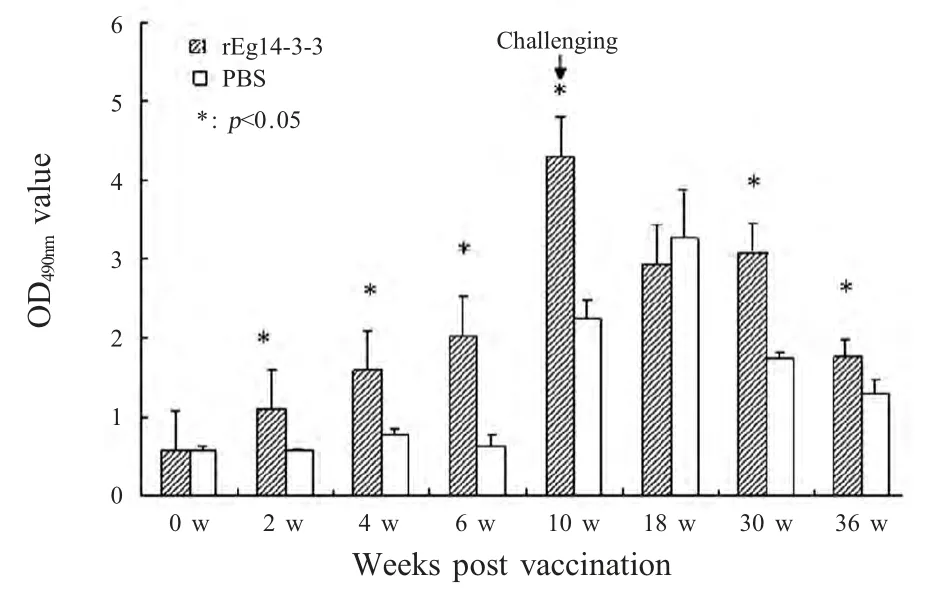
图1 小鼠免疫和感染后IgG 水平动态变化Fig.1 Dynamic changes of IgG in sera of ICR mice vaccination and challenge
2.2 IgG1、IgG2a、IgG2b及IgG3动态变化 对rEg14-3-3 免疫前后和攻击感染后实验组小鼠及对照组小鼠血清IgG 抗体亚型进行检测,结果显示,实验组小鼠在rEg14-3-3 免疫后IgG 各亚型抗体水平随着时间和免疫次数的增加迅速升高,其中IgG1、IgG2b、IgG3 在18 周抗体水平达到峰值,IgG2a 抗体水平在第10 周达到峰值,此后两组小鼠抗体在较长时间内维持在较高水平。在原头蚴攻击感染后IgG 各亚型抗体水平迅速升高,其中IgG1、IgG2a、IgG2b、IgG3 分别在30 周、10 周、18 周、18 周抗体水平达到峰值,随后抗体水平逐步降低。在首免后的2 周、4 周、6 周实验组小鼠IgG 各亚型抗体与对照组均具有显著性差异(p<0.05),在原头蚴攻击感染后对照组小鼠抗体水平迅速增高,实验组与对照组小鼠各亚型抗体水平组间差异逐渐减小,除IgG1 外IgG2a、IgG2b、IgG3 在第36 周抗体水平无显著性差异。此外,对照组小鼠IgG1 与IgG2a 的比值在0、2 周、4 周、6 周、10 周、18 周、30 周、36 周分别为1.41、1.71、1.36、1.41、1.09、1.90、1.71、1.07 均大于1,rEg14-3-3 免疫组IgG1 与IgG2a 的比值分别为1.21、0.94、0.62、0.63、0.72、1.46、1.69、1.16,在免疫18 周内IgG1/IgG2a<1,18 周之后IgG1/IgG2a>1(图2)。
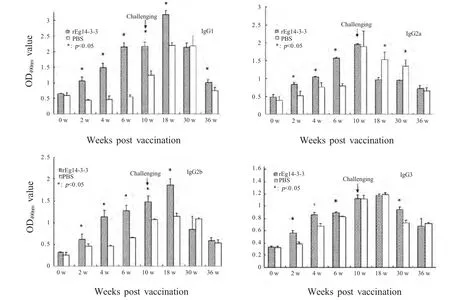
图2 rEg14-3-3 免疫前后和攻击感染后小鼠血清IgG 抗体亚型检测Fig.2 Dynamic changes of IgG subclass in sera of mice post vaccination and challenge
2.3 IgE抗体检测结果 对rEg14-3-3 免疫前后和攻击感染后实验组小鼠及对照组小鼠血清抗体IgE进行检测,结果显示,实验组小鼠在rEg14-3-3 免疫后IgE 抗体水平在免疫后比免疫前水平有所升高,但实验组与对照组小鼠在攻击感染前无显著性差异,实验组小鼠在18 周抗体水平达到峰值,此时实验组与对照组小鼠抗体水平具有显著性差异(p<0.05),此后抗体水平有所降低。对照组小鼠在原头蚴攻击感染后IgE 抗体水平升高,在18 周达到峰值,此后两组小鼠抗体在较长时间内维持在较高水平(图3)。
2.4 IL-21检测结果 对rEg14-3-3 免疫前后和攻击感染后实验组小鼠及对照组小鼠血清IL-21 水平进行检测,结果显示:rEg14-3-3 免疫1 周后实验组小鼠IL-21 水平即迅速升高,在第9 周(原头蚴攻击感染后1 周)达到峰值,对照组小鼠IL-21 水平在第9 周迅速升高,第18 周达到峰值,实验组和对照组IL-21 水平在1 周、9 周、18 周有显著性差异(p<0.05),此后两组IL-21 细胞因子水平逐渐降低,相对免疫前小鼠在较长时间内维持在相对较高水平(图4)。
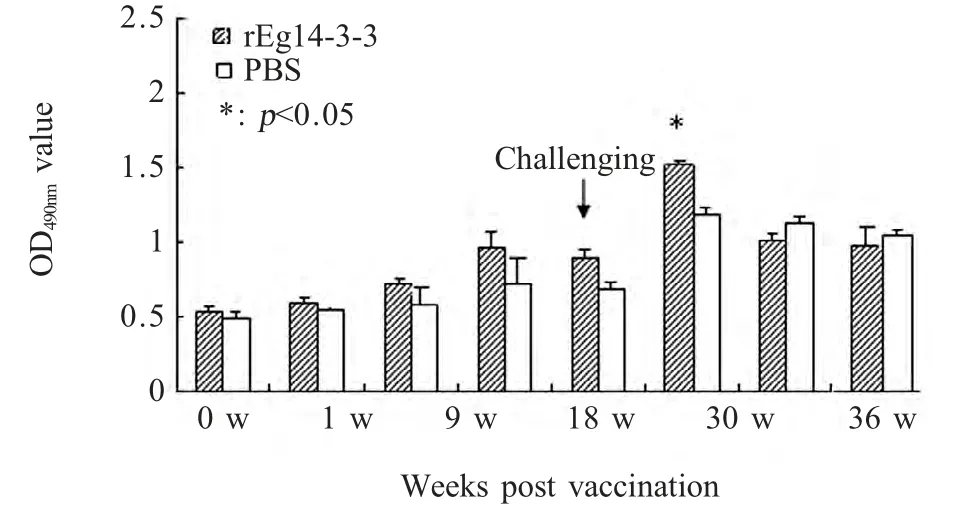
图3 rEg14-3-3 免疫前后和攻击感染后小鼠血清抗体IgE 检测Fig.3 Dynamic change of IgE in sera of mice post vaccination and challenge
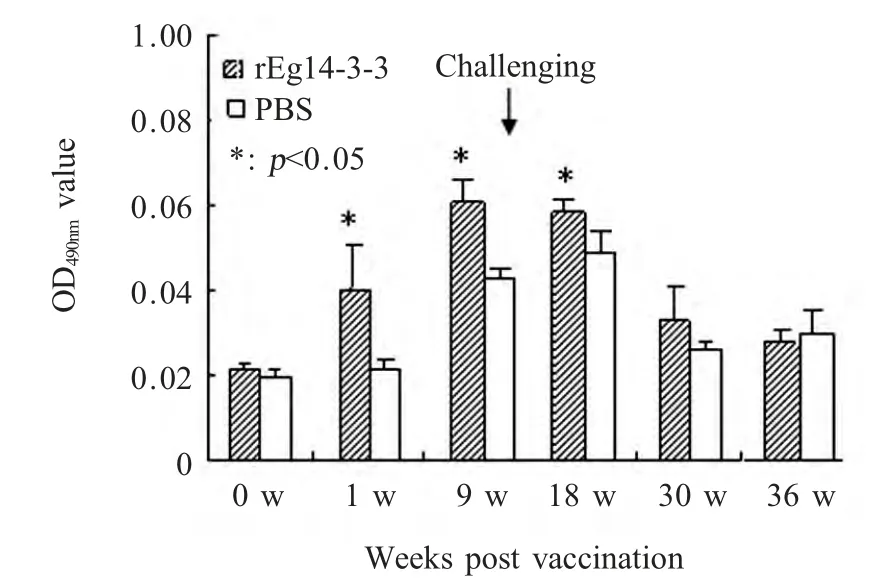
图4 IL-21 水平的ELISA 检测Fig.4 The detection of cytokine IL-21 level by ELISA
2.5 小鼠抗包虫感染保护力的测定结果 原头蚴攻击感染24 周后迫杀两组小鼠,检查并计数肝脏及肠系膜处的棘球蚴包囊,rEg14-3-3 蛋白免疫组和佐剂对照组的棘球蚴包囊平均直径分别为2.2±0.15 mm和8.5±0.63 mm,包囊数目分别为0.60±0.787 个和3.86±3.141 个,同时rEg14-3-3 免疫ICR 小鼠可获得84.47 %的免疫保护力(表1)。

表1 rEg14-3-3 蛋白免疫组和对照组包囊数目和保护力Table1 Numbers of hydatid cysts and protective immunity induced by vaccinated and control mice
3 讨论
在本实验室前期表达、纯化rEg14-3-3 的基础上,本研究对其进行进一步免疫学特性研究[8]。14-3-3 蛋白是近年来寄生虫疫苗和药物靶蛋白研究的热点,在血吸虫属和棘球虫属中均对其进行了研究[9-12]。血吸虫14-3-3 疫苗免疫小鼠后尾蚴攻击感染得到达45 %的免疫保护力[13],Sm14-3-3-1 重组蛋白也诱导出达到46 %的免疫保护力[14]。对于棘球虫属而言,多囊棘球蚴14-3-3 免疫小鼠后,虫卵攻击感染,可产生达78.5 %~82.9 %减囊率[15],本实验室前期研究表明细粒棘球蚴14-3-3 在小鼠中可诱导84%以上的免疫保护力。对疫苗诱导免疫保护机理的深入研究,是该疫苗能够最终应用的理论基础。
研究表明体液免疫反应在抗包虫感染中起关键性作用。在体液免疫反应产生的抗体中,人体血清免疫球蛋白IgG 是初级免疫应答中最持久、最重要的抗体,它在抗感染中起到主力军作用。IgE 在寄生虫感染中可与嗜酸性粒细胞协同,对寄生虫的感染具有防御作用,IgE 抗体的产生是在寄生虫感染的情况下能够看到的具有特征性的免疫反应。并且,体液免疫的保护效力不仅与IgG、IgE 水平相关而且和IgG 抗体亚型相关[12-13]。IgG 及其亚型的动态变化反应了重组疫苗在小鼠体内可诱导Th1/Th2 混合型免疫反应,感染早期以Th1 型免疫应答和IGg2a 和IGg2b 抗体反应占优势的抗感染免疫,感染慢性期逐步趋向于Th2 型免疫应答和IGg1 和IG3抗体占优势的免疫反应,该疫苗分子诱导的免疫方式有利于在寄生虫感染早期启动强效的Th1 型细胞免疫应答杀灭寄生虫,而在感染慢性期趋向Th2 型体液免疫为主的免疫应答发挥长效免疫保护效应,该疫苗分子诱导的免疫应答方式为后续疫苗的构建、优化、应用提供了可借鉴的经验和依据。rEg14-3-3 疫苗免疫及原头蚴攻击感染后实验组和对照组小鼠IgE 抗体水平虽有上升但组间无显著性差异,表明重组疫苗主要诱导以IgG 为主的体液免疫反应,IgG 及其亚型在重组疫苗的抗感染免疫反应中发挥主要的免疫保护作用。目前已有大量研究证明Tfh 细胞在诱导抗原特异性B 细胞活化、增殖、分化为分泌高亲和力抗体的浆细胞及维持长效免疫的记忆性B 细胞及抗体类型转化中起关键作用。本研究检测了Tfh 细胞的主要效应分子IL-21 在疫苗免疫组及对照组不同免疫及感染阶段的表达水平,观察到IL-21 细胞因子在疫苗免疫后及细粒棘球蚴虫感染后表达迅速升高,初步表明分泌IL-21 的Tfh细胞参与细粒棘球蚴感染及重组疫苗诱导的抗感染体液免疫应答及抗体类型转换,详细作用机制还需后续进一步深入研究。
由于寄生虫结构复杂、抗包虫的免疫保护机制也较为复杂,并且重组疫苗所诱导的免疫反应的类型与强度与免疫佐剂密切相关,本研究室后续将会进一步对重组疫苗诱导的免疫机理尤其是Tfh 在体液免疫中的免疫作用及机理进行深入研究,并且不断优化免疫方案及选择更为安全有效的佐剂来提高疫苗的免疫效果及安全性,为抗包虫疫苗的最终应用提供理论和实验资料。
[1]Craig P S,Mcmanus D P,Lightowlers M W,et al.Prevention and control of cystic echinococcosis[J].Lancet Infect Dis,2007,7(6):385-394.
[2]Donald P M,Zhang Wen-bao,Li Jun.Echinococcosis[J].Lancet,2003,362(9):1295-1304.
[3]Brunetti E,Junghanss T.Update on cystic hydatid disease[J].Curr Opin Infect Dis,2009,22(5):497-502.
[4]Li Zong-ji,Zhao Wei.Analysis on protoscoleces specific antigens from Echinococcus granulosus with proteomics combined with western blot[J].Biomed Environ Sci,2012,25(6):718-723.
[5]Spolski R,Leonard W J.IL-21 and T follicular helper cells[J].Int Immunol,2010,22(1):7-12.
[6]King I L,Mohrs M.IL-4-producing CD4+T cells in reactivelymphnodes during helminth infection are T follicular helper cells[J].J Exp Med,2009,206(5):1001-1007.
[7]Xu He-ping,Li Xuan-ying,Liu Dan,et al.Follicular T-helper cell recruitment governed by bystander B cells and ICOS-driven motility[J].Nature,2013,496(7446):523-527.
[8]黄瑾,李宗吉,张静,等.细粒棘球蚴重组14-3-3 基因的表达、纯化及免疫学鉴定[J].中国病原生物学杂志,2007,1(4):253-256.
[9]Siles L M,Gottstein B.The 14-3-3 protein:a key molecule in parasites as in other organisms[J].Trends Parasitol,2003,19(1):575-581.
[10]Matsumoto J,Muller N,Hemphill A,et al.14-3-3 and II/3-10-gene expression as molecularmarkers to address viability and growth activity of Echinococcus multilocularis metacestodes[J].Parasitology,2006,132(1):83-94.
[11]Zhang Y,Bickle Q D,Taylor M G.Cloning of Schistosoma japonicum 14-3-3 epsilon(Sj14-3-31),a new member of the 14-3-3 family of proteins from schistosomes[J].Int J Parasitol,2000,30(1):991-994.
[12]McGonigle S,Loschiavo M,Pearce E J.14-3-3 proteins in Schistosoma mansoni:identification of a second epsilon isoform[J].Int J Parasitol,2002,32(1):685-693.
[13]Siles L M,Merli M,Mackenstedt U.The Echinococcus multilocularis 14-3-3 protein protects mice against primary but not secondary alveolar echinococcosis[J].Vaccine,2003,21(1):431-439.
[14]Lightowlers M W,Heath D D.Immunity and vaccine control of Echinococcus granulosus infection in animal and intermediate hosts[J].Parassitologia,2004,46(1-2):27-31.
[15]Khabiri A R,Bagheri F,Assmar M.Analysis of specific IgE and IgG subclass antibodies for diagnosis Echinococcus granulosus[J].Parasite Immunol,2006,18(8):57-62.
