猪伪狂犬病病毒HeN1株全基因组测序及感染和毒力相关基因的变异特征分析
2015-03-09郭金潮姜成刚常晓博王淑杰王同云彭金美蔡雪辉田志军安同庆
叶 超,赵 款,郭金潮,姜成刚,常晓博,王淑杰,王同云,彭金美,蔡雪辉,田志军,安同庆
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150001)
猪伪狂犬病(PR)是由PR 病毒(PRV)引起的一种烈性传染病,该病在世界范围内广泛分布,随Bartha-K61 等疫苗以及鉴别诊断方法的应用,在欧美一些国家PRV 已经得到净化。然而从2011 年底开始,我国多个省份免疫过Bartha-K61 疫苗的猪场发生PRV,造成了严重的经济损失[1]。
研究表明,PRV 感染相关基因gC 通过与硫酸乙酰肝素结合介导病毒入侵[2];gB、gD、gH 介导膜融合促进病毒衣壳和内间质进入细胞质[3]。gE 和gI通过将新生病毒粒子分配到细胞连接,促进病毒在细胞间的扩散。gE、gI 和TK 基因的缺失可以使PRV 的毒力和感染力显著降低[4-5]。核苷酸还原酶(RR)由RR1 和RR2 两个亚基组成,缺失RR 会降低病毒的生长速度[6]。PK 为PRV 增殖的非必需基因,但缺失PK 基因后也导致PRV 毒力下降[7]。微卫星序列(SSR)在疱疹病毒基因组中广泛存在,并与病毒的遗传变异具有紧密联系。SSR 是由几个1 bp~6 bp 的核苷酸序列作为重复单元,串联重复形成的一类DNA 序列。以往对于欧美PRV 株的研究表明,不同PRV 株间的SSR 变异较大[8]。为研究2011 年以来我国PRV 流行株的变异情况,本研究对本实验室分离的流行株HeN1 株进行了全基因组测序,并对其感染或毒力相关基因进行序列分析,为PR 的有效防制提供实验依据。
1 材料和方法
1.1 病毒株及细胞 于2011 年分离自Bartha-K61疫苗免疫过的猪场出现神经症状死亡仔猪的PRV HeN1 株及Vero-E6 细胞由本实验室保存。
1.2 主要试剂 LA Taq DNA 聚合酶、DL2000 DNA Marker 及pMD18-T 载体均购自TaKaRa 公司。
1.3 病毒培养与核酸提取 将HeN1 株接种于Vero-E6 细胞,待病变率达到80%时收获病毒液。按照常规方法提取PRV 基因组DNA。
1.4 引物设计合成、病毒基因组分段克隆及测序参照GenBank 中登录的Kaplan 全基因序列(KJ717942)设计96 对特异性引物(如读者需要,作者可以提供相关的引物序列信息),以HeN1 株基因组DNA 为模板进行PCR 扩增,相邻引物扩增区域保证至少重叠100 bp,引物由博仕生物科技有限公司合成。PCR 产物经1 %琼脂糖凝胶电泳后回收纯化,克隆于pMD18-T 载体中,构建重组质粒,由北京华大基因研究中心进行测序。
1.5 PRV感染和毒力相关基因的比对分析 将HeN1 株的测序结果进行拼接,获得全基因组序列,并与GenBank 中登录的PRV 相关基因序列进行同源性比对。
1.6 PRV序列的进化树分析 参照文献[9]方法,选取PRV 各病毒株gC 基因部分序列,采用MEGA5.1 软件根据neighbor-joining 方法绘制无根系统发生树,比对值为1 000 次重复。
2 结果
2.1 PRV HeN1株与参考病毒株的核苷酸同源性分析 PRV HeN1 株(KP098534)全长141 803 bp,GC含量为73.7 %,UL 区占70.2 %,US 区占9.6 %,内部重复区和末端重复区均占11.3 %。HeN1 株与国外参考病毒株(Kaplan、Bartha 和Becker)全基因组序列同源性为89.9 %~93.3 %,与中国病毒株TJ(KJ789182)同源性为96.9 %。各基因同源性分析结果显示新流行株之间(HeN1、TJ 和BJ/YT)同源性最高,与中国早期的Fa 株和Ea 株同源性较高,与国外代表病毒株同源性最低(表1)。

表1 HeN1 株与国内外参考病毒株的基因核苷酸同源性比较Table 1 The identity of different genes between HeN1 and reference isolates
2.2 PRV感染和毒力相关蛋白的变异特征 国内分离株和国外分离株间存在一些特有的突变氨基酸,这些突变在国内外分离株间是高度保守且大量存在的。除TK、RR2 外,其他8 个蛋白均存在插入或缺失(图1)。其中RR1、gB、gC、gE、gI 的插入/缺失是国内分离株与国外分离株间特有的差异,以国内分离株在gC 蛋白连续插入7 个氨基酸(63AAASTPA69)最为显著。RR2、TK、PK、gH 在国内外分离株之间的同源性较高,而表现为较少的特有氨基酸突变。这表明各相关蛋白在分离株间的保守性存在差异。另外分析显示在RR1 序列中,欧美分离株在GCC 重复单元中插入了9 个碱基形成3 个丝氨酸的插入。在PK 和gH 的序列中,由于SSR重复单元(GGCGAC 和GAG)的增加,病毒株Becker分别比其他分离株多编码了2 个氨基酸。在gD 序列中,欧洲病毒株Kaplan 和Bartha 由于SSR 重复单元的减少而缺少了2 个氨基酸。在gE 序列中存在的两处天冬氨酸插入现象也是由于SSR 重复单元(GAC)数量的变异引起的(图1)。表明大部分插入/缺失的产生与SSR 的变异相关。至于这些缺失/插入及突变对各毒力蛋白结构和功能的影响,还有待进一步研究。

图1 PRV 感染和毒力相关蛋白的缺失/插入区域比对结果Fig.1 Comparative alignment analysis of PRV proteins
2.3 基于gC基因的PRV遗传进化分析 选取PRV 各病毒株gC 基因部分序列,进行进化树分析表明,国内外分离株进化具有显著差异,处于两个独立的遗传分支。中国新分离株在相对集中的小分支上,亲缘关系紧密。与早期的PRV Fa 株(1964 年分离)在不同的遗传分支上,但与以往病毒株Ea(1999 年分离)在一个大的分支中(图2)。表明新分离株可能是中国早期的分离株逐渐演变而来。
3 讨论
余秋颖等对河南省2012 年~2013 年的PRV 流行株gE、TK 和gD 基因进行过比对分析[10],但目前对PRV 新流行株的分子特征还知之甚少。本研究进一步对新流行株HeN1 株的感染和毒力相关基因进行了序列分析,并与GenBank 中登录的国内外分离株进行比较分析,以研究PRV 新流行株相关基因的变异情况。结果表明,以HeN1 为代表的2011 年以来的流行株具有相似的突变和缺失/插入特征。与国内早期分离株相比,它们之间具有较高的同源性和很近的遗传关系,属于同一个大的遗传分支。国内外分离株间却存在显著遗传差异,在进化关系上处在两个独立的遗传分支。欧美等国外分离株与中国的分离株在各感染和毒力相关蛋白氨基酸编码上存在较多特征氨基酸的突变和特异性缺失/插入。最为显著的是中国分离株相对于国外分离株在gC蛋白第63~69 位连续插入7 个氨基酸(AAASTPA),该插入突变可以进一步作为鉴定国内外PRV 的分子特征。另外本研究首次发现有些缺失/插入与SSR的变异直接相关,而且是由于SSR 重复单元数量的变化造成的。至于这些缺失/插入及突变对各毒力蛋白结构和功能的影响,还有待进一步研究。
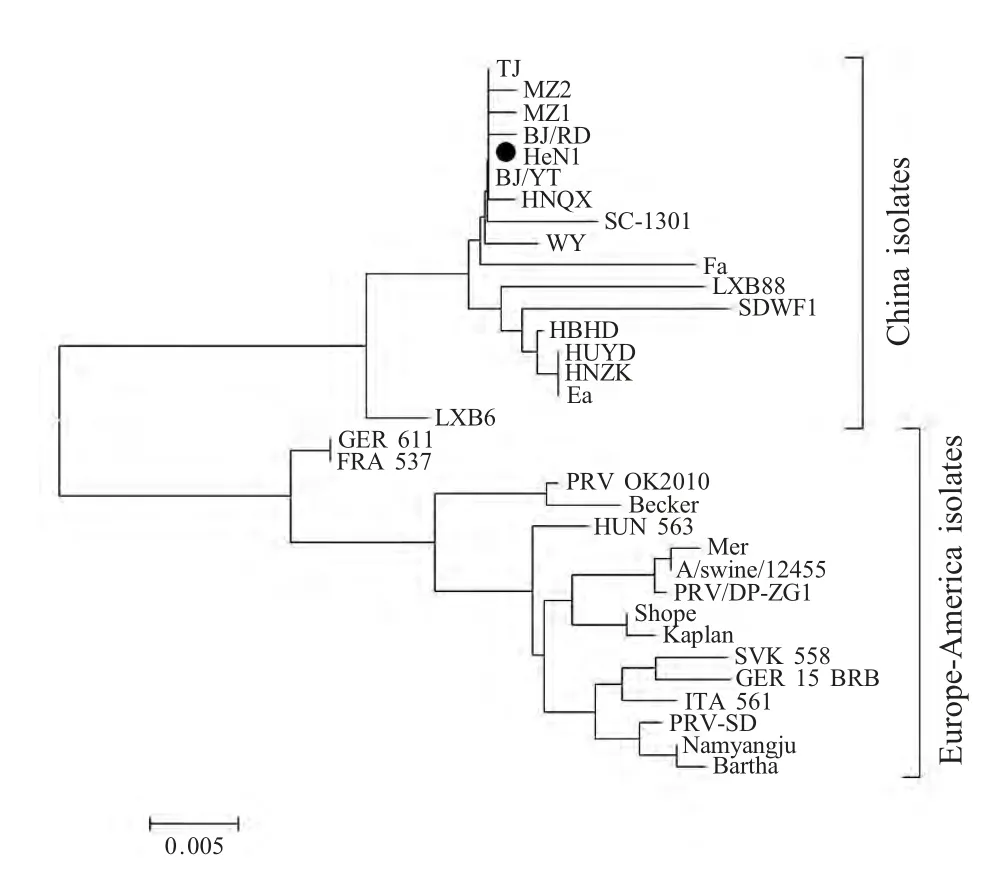
图2 基于gC 基因的PRV 进化树分析Fig.2 Evolutionary analysis of PRV based on gC sequences
以上研究表明,2011 年以来不同地区分离的PRV 流行株的感染和毒力相关基因具有相似的缺失/插入分子特征,在进化树上处于单独的小分支。我国早期PRV 与2011 年以来流行株之间,各感染和毒力相关基因的同源性较高,二者有很近的亲缘关系。而国外病毒株与国内病毒株间各相关基因有较大突变和缺失/插入,二者进化关系很远。
[1]An Tong-qing,Peng Jin-mei,Tian Zhi-jun,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19(11):1749-1755.
[2]Mettenleiter T C,Zsak L,Zuckermann F,et al.Interaction of glycoprotein gIII with a cellular heparinlike substance mediates adsorption of pseudorabies virus[J].J Virol,1990,64(1):278-286.
[3]Atanasiu D,Whitbeck J C,Cairns T M,et al.Bimolecular complementation reveals that glycoproteins gB and gH/gL of herpes simplex virus interact with each other during cell fusion[J].P Natl Acad Sci USA,2007,104(47):18718-18723.
[4]Mettenleiter T C,Zsak L,Kaplan A S,et al.Role of a structural glycoprotein of pseudorabies in virus virulence[J].J Virol,1987,61(12):4030-4032.
[5]Kit S,Sheppard M,Ichimura H,et al.Second-generation pseudorabies virus vaccine with deletions in thymidine kinase and glycoprotein genes[J].Am J Vet Res,1987,48(5):780-793.
[6]Heineman T C,Cohen J I.Deletion of the varicella-zoster virus large subunit of ribonucleotide reductase impairs growth of virus in vitro[J].J Virol,1994,68(5):3317-3323.
[7]Kimman T G,De wind N,De bruin T,et al.Inactivation of glycoprotein gE and thymidine kinase or the US3-encoded protein kinase synergistically decreases in vivo replication of pseudorabies virus and the induction of protective immunity[J].Virology,1994,205(2):511-518.
[8]Szpara M L,Tafuri Y R,Parsons L,et al.A wide extent of inter-strain diversity in virulent and vaccine strains of alphaherpesviruses[J].Plos Pathog,2011,7(10):e1002282.
[9]Sozzi E,Moreno A,Lelli D,et al.Genomic characterization of pseudorabies virus strains isolated in Italy[J].Transbound Emerg Dis,2014,61(4):334-340.
[10]余秋颖,常洪涛,陈文定,等.2012-2013 年新流行猪伪狂犬病病毒的分离鉴定及其gE、TK、gD 基因序列分析[J].中国兽医学报,2014,10:1573-1578.
