富血小板凝胶促软骨细胞增殖的体外实验研究
2015-03-08常正奇孙海宁于秀淳济南军区总医院骨病科山东济南5003上海长征医院骨科上海00003
康 健,袁 文,常正奇,孙海宁,于秀淳 (.济南军区总医院骨病科,山东 济南 5003;.上海长征医院骨科,上海 00003)
富血小板凝胶促软骨细胞增殖的体外实验研究
康健1,袁文2,常正奇1,孙海宁1,于秀淳1(1.济南军区总医院骨病科,山东 济南 250031;2.上海长征医院骨科,上海 200003)
[摘要]目的利用二次离心法制备富血小板凝胶,将其与软骨细胞复合,观察软骨细胞增殖与表达,为组织工程软骨构建提供良好支架材料。 方法将兔静脉血使用二次离心法制备富血小板血浆,检测其中多种生长因子浓度,并与分离培养的兔软骨细胞混合后以激活剂激活,培养并以MTT法观察软骨细胞增殖情况,使用realtime-PCR方法检测软骨细胞蛋白聚糖、Ⅱ型胶原和SOX-9基因表达,并与普通培养软骨细胞比较,明确富血小板凝胶与软骨细胞混合后软骨细胞增殖表达情况。 结果富血小板凝胶萃取液中PDGF-AB、TGF-β1、IGF-1、VEGF生长因子浓度明显高于全血(P<0.05)。富血小板凝胶与软骨细胞复合培养,软骨细胞增殖速度明显高于普通培养软骨细胞(P<0.05)。培养7 d后检测软骨细胞中蛋白聚糖、Ⅱ型胶原和SOX-9基因表达明显高于普通软骨细胞(P<0.05)。结论富血小板凝胶与软骨细胞共培养,可明显促进软骨细胞增殖和表达,是优良的组织工程软骨构建方案。
[关键词]富血小板凝胶;软骨细胞;组织工程;生长因子
关节软骨损伤是较为常见的关节病变,亦是骨性关节炎重要的病理改变之一,由于软骨自我修复能力很差,关于软骨修复的研究是目前骨科及组织工程学研究的热点和难点。通过有效途径进行软骨修复,可在软骨损伤早期对软骨病变进行及时干预,防止进一步的骨性关节炎的发生,避免患者由于骨性关节炎影响日常生活甚至不得不选择接受关节置换。随着组织工程技术的发展,软骨修复技术取得了巨大的进步。借助于多种生长因子及组织工程支架,结合软骨细胞及各种干细胞,通过组织工程技术及有效的细胞诱导,制备出多种用于软骨修复的组织工程软骨,富血小板凝胶(platelet-rich plasma gel, PRG)是近年来使用较多的组织工程支架之一。富血小板凝胶是将新鲜全血离心得到的含高浓度血小板的富血小板血浆加入激活剂后凝固形成的胶冻物,在激活形成凝胶过程中,通过血小板的脱颗粒作用,可释放多种高浓度的细胞生长因子,如转化生长因子β2(TGF-β2)、血小板衍生生长因子(PDGF)、胰岛素样生长因子(IGF)、转化生长因子β1(TGF-β1)和血管内皮生长因子(VEGF)等[1]。这些生长因子能有效促进细胞增殖和细胞外基质的合成[2],对组织创伤后修复具有极其重要的作用。本研究分离培养兔软骨细胞,并与富血小板凝胶复合,观察富血小板凝胶中软骨细胞的增殖及细胞外基质分泌情况,为此种组织工程软骨的构建方法提供理论支持。
1材料与方法
1.1实验材料
1.1.1试剂及仪器胎牛血清,双抗溶液(10 000 U/mL青霉素和10 000 U/mL链霉素溶液),DMEM-HG培养基,0.05%的胰蛋白酶,EDTA,PBS缓冲液,MTT,DMSO,Ⅱ型胶原酶,二甲基亚砜,牛凝血酶,PDGF-AB试剂盒(96T),TGF-β1试剂盒(96T),无水氯化钙,扫描电镜,酶联免疫检测仪,PCR仪。
1.1.2实验动物新西兰大白兔,购于上海生旺实验动物养殖有限公司。合格证号码:SCXK(沪)2012-0007。
1.2实验方法
1.2.1软骨细胞的分离和培养取2月龄的兔,麻醉后取部分耳廓软骨,剥去软骨膜,切成1 mm3大小组织团块。PBS冲洗、Ⅱ型胶原酶37 ℃消化8 h,过滤离心后弃去上清,PBS洗涤沉淀细胞,重悬细胞接种于100 mm培养皿中,置37 ℃、CO2体积分数0.05,饱和湿度的条件下培养。
1.2.2富血小板凝胶的制备抗凝注射器抽取兔耳缘静脉血10 mL,以200 rpm离心10 min,吸取全部上清至交界面下3 mm,移至另一离心管,平衡后以200 rpm再次离心10 min,此时离心管中液体分为2层,吸取约3/4上清弃掉,轻轻振荡混匀,得到富血小板血浆(PRP)。将PRP和激活剂(1 000 U牛凝血酶溶于1 mL 10%的氯化钙)按照10∶1比例混合,轻摇混匀,室温静置30 min,形成凝胶。
1.2.3富生长因子萃取液的提取与检测将激活凝固的富血小板凝胶在室温下静置1 h,以3 000 r/min离心10 min,吸取全部上清,以针头式滤器过滤除菌后即可得富生长因子萃取液。以ELISA法检测其中PDGF-AB、TGF-β1、IGF-1、VEGF的浓度。
1.2.4富血小板凝胶与软骨细胞复合及检测将第3代软骨细胞以0.25%的胰酶消化,PBS洗涤后加入新鲜培养液,轻微振荡形成细胞悬液,调整细胞浓度至1×106/mL。将PRP与软骨细胞悬液以4∶1比例混合,轻摇振荡混匀,按照细胞悬液与激活剂10∶1的比例加入激活剂,室温静置30 min凝固,加入10%胎牛血清DMEM-HG培养基培养,每2 d换液。
1.2.5扫描电镜观察将制成的富血小板凝胶软骨细胞复合体以生理盐水反复冲洗,以扫描电镜观察其微观结构,明确软骨细胞在富血小板凝胶中分布情况。
1.2.6MTT法检测软骨细胞增殖情况将第3代软骨细胞和富血小板凝胶软骨细胞复合体分别接种至96孔板,于培养的0、1、3、5、7 d分别取出部分样本,MTT法处理细胞,酶联免疫检测仪测定490 nm吸光度值(A值)。
1.2.7realtime-PCR方法检测软骨细胞基因表达情况将培养7 d的单纯培养软骨细胞和富血小板凝胶共培养的软骨细胞行realtime-PCR反应,检测软骨细胞内蛋白聚糖、Ⅱ型胶原及SOX-9基因的表达情况。
1.3统计学分析
采用SPSS 16.0软件对所得数据进行统计学分析,采用LSD-t检验,P<0.05为差异具有统计学意义。
2结果
2.1富血小板凝胶大体外观观察
通过Lendersberg法离心制得的富血小板血浆经过激活制得胶冻状的富血小板凝胶(图1)。

图1 离心激活后所获得的富血小板凝胶
2.2富血小板凝胶萃取液中多种生长因子浓度测定
通过对富血小板凝胶萃取液中多种生长因子浓度检测发现,其中的关键生长因子浓度较全血中生长因子浓度明显增高,差异有统计学意义(P<0.05),见表1。

表1 兔全血和富血小板凝胶中生长因子浓度的比较
2.3富血小板凝胶及复合软骨细胞后电镜观察
将富血小板凝胶及与软骨细胞复合后的组织工程软骨处理后行扫描电镜观察(图2),可以看到示凝胶内部结构呈纤维交织的立体网状结构,网状结构的孔隙直径大小不等,且有大量软骨细胞附着于支架孔隙中。除此之外还有大量的血小板附着于支架上,并可见少量红细胞。
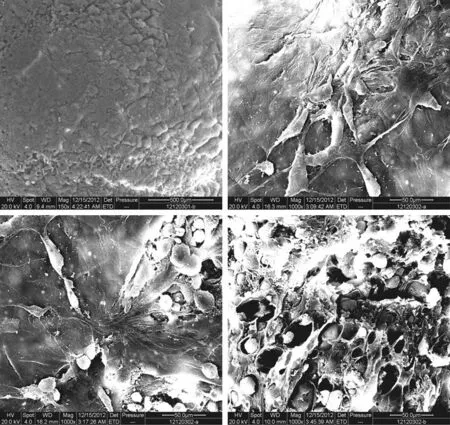
图2 富血小板凝胶复合软骨细胞扫描电镜照片
2.4富血小板凝胶复合软骨细胞对软骨细胞增殖影响
通过对普通培养软骨细胞和与富血小板凝胶复合培养的软骨细胞进行MTT法对比分析发现,随着培养时间的延长,富血小板凝胶组软骨细胞明显表现出了更强的增殖能力,二者之间比较差异具有统计学意义(P<0.05)(图3)。

图3 软骨细胞细胞增殖MTT检测
2.5不同条件培养下软骨细胞基因表达检测
对培养7 d后的不同软骨细胞行realtime-PCR检测,结果显示:与富血小板凝胶复合后的软骨细胞蛋白聚糖、Ⅱ型胶原和SOX-9基因表达与普通培养软骨细胞相比明显上调,差异有统计学意义(P<0.05)(图4)。基因引物设计见表2。

表2 基因引物设计

图4 软骨细胞相关基因检测
3讨论
富血小板血浆在激活剂的作用下,通过血小板脱颗粒作用,使多种高浓度生长因子由α颗粒中释放出来,其中很多因子具有促进软骨细胞增殖和特异基质分泌的作用,如TGF-β、PDGF、VEGF、bFGF等[3-5]。富血小板凝胶是组织工程中常用的软骨生长因子聚合体,在PRG纤维蛋白骨架部分降解的时候,同样会释放出大量的细胞因子,这些细胞因子在细胞量较少及分化困难的细胞再生过程中有着至关重要的作用[3,6-7]。由于多种细胞因子的存在,PRG可以促进软骨细胞的增殖,并提高细胞外基质(ECM)的表达量,其中就包括蛋白聚糖、Ⅱ型胶原及SOX-9的表达[4-5,8-12]。
PRG本身内部结构及环境相当于模拟了组织损伤修复时的内环境。关节软骨损伤后,由于软骨细胞自身修复能力较差,且其所处内环境并无充分的血液供应及体液供应,导致软骨损伤后自体修复非常困难。PRG中富纤维蛋白的空间立体结构及高浓度的细胞因子,类似甚至优于组织损伤时机体所产生的修复条件。在其三维网状结构中,软骨细胞在高浓度的细胞因子的刺激下,充分地利用空间优势进行增殖和表达。其中TGF-β是已知有效的促软骨细胞增殖和软骨特异基质代谢的有效细胞因子,可明显促进ECM的释放,上调Ⅱ型胶原并抑制Ⅰ型胶原的表达[13-15];IGF可明显促进软骨细胞增殖和ECM合成,并且和TGF-β存在协同促进作用[16-17];而FGF和PDGF也同样有上述作用[18-19],Kato等[20]研究认为,只有存在FGF时才能使软骨细胞在增殖过程中的维持表型,甚至将一些成纤维细胞反分化为软骨细胞。通过本实验研究发现,富血小板凝胶在与软骨细胞混合共培养的情况下,确实能够明显促进软骨细胞的增殖,使软骨细胞特异性基因Ⅱ型胶原、蛋白聚糖、SOX-9表达量明显升高。
通过对PRG的组织学观察发现,PRG中血小板在凝胶纤维骨架之中分布均匀且结合紧密,在血小板和凝胶纤维之间没有明显的分布区域差别,同时PRP在与种子细胞充分混匀后才进行激活凝固,使种子细胞在PRG中分布均匀,伴随着血小板脱颗粒以及凝胶纤维的降解,细胞因子可以获得稳定持续的释放,并在一定时期内维持局部细胞因子浓度的稳定,使其对软骨细胞的促增殖和表达的作用能够维持较长时间。使软骨细胞并不需要通过细胞迁移作用就可获得足够的细胞因子支持,为软骨细胞的增殖和表达提供了有利条件[21]。
综上所述,若选用富血小板凝胶作为组织工程软骨支架,具有以下优点:①组织相容性好,降解时长适中,在动物实验中可以获得良好的支架效果;②支架中含有丰富的细胞因子,并且释放均匀,浓度稳定,可有效促进软骨细胞增殖和表达,达到修复软骨损伤的目的;③PRG的三维立体空间结构是软骨细胞良好生长依附载体,可使各种细胞因子较好地分布于软骨细胞周围,并且有利于细胞代谢所需的营养物质的渗入及代谢产物的排出,细胞在凝胶支架内部可以获得良好的生长;④采用富血小板凝胶为支架,可以在注射之后再行激活,在临床应用中可以采取局部注射的方式给药,使用较为方便。
既往研究通过将富血小板血浆中富生长因子提取液与软骨细胞进行共同培养发现,富生长因子提取液可有效促进软骨细胞增殖,提高细胞外基质的表达水平[22-24]。但将软骨细胞与富血小板凝胶复合,使软骨细胞在含高浓度生长因子的三维结构中增殖和表达的研究很少报道。本实验将富血小板凝胶与软骨细胞复合体外培养,可有效促进软骨细胞增殖和细胞外基质表达,同时富血小板凝胶三维空间结构可为软骨细胞生长提供更好的空间,使营养物质和细胞因子作用更加充分,后期还可通过富血小板凝胶孔隙率的调整,进一步摸索软骨细胞生长的最佳孔隙率和空隙直径,为组织工程软骨构建提供一个优良的方案。
[参考文献]
[1] Amy DB,May JR,Helene S.SPARC-null mice exhibit accelerated cutaneous wound closure[J].J Histochem & Cytochem,2002,50(1):1-10.
[2] Marx RE.Platelet-rich plasma:evidence to support its use[J].J Oral Maxillofac Surg,2004,62(8):489-496.
[3] Fortier LA,Barker JU,Strauss EJ,et al.The role of growth factors in cartilage repair[J].Clin Orthop Relat Res,2011,469(10):2706-2715.
[4] Mishra A,Tummala P,King A,et al.Buffered platelet-rich plasma enhances mesenchymal stem cell proliferation and chondrogenic differentiation[J].Tissue Eng Part C Methods,2009,15(3):431-435.
[5] Sun Y,Feng Y,Zhang CQ,et al.The regenerative effect of platelet-rich plasma on healing in large osteochondral defects[J].Int Orthop,2010,34(4):589-597.
[6] Vinatier C,Mrugala D,Jorgensen C,et al.Cartilage engineering:a crucial combination of cells,biomaterial and biofactors[J].Trends Biotechnol,2009,27(5):307-314.
[7] Freyria AM,Mallein-Gerin F.Chondrocytes or adult stem cells for cartilage repair:the indisputable role of growth factors[J].Injury,2011,43(3):259-265.
[8] Akeda K,An HS,Okuma M,et al.Platelet-rich plasma stimulates porcine articular chondrocyte proliferation and matrix biosynthesis[J].Osteoarthritis Cartilage,2006,14(12):1272-1280.
[9] Spreafico A,Chellini F,Frediani B,et al.Biochemical investigation of the effects of human platelet releasates on human articular chondrocytes[J].J Cell Biochem,2009,108(5):1153-1165.
[10] Kim HY,Park JH,Han YS,et al.The effect of platelet-rich plasma on flap survival in random extension of an axial pattern flap in rabbits[J].Plast Reconstr Surg,2013,132(1):85-92.
[11] Park SI,Lee HR,Kim S,et al.Time-sequential modulation in expression of growth factors from platelet-rich plasma (PRP) on the chondrocyte cultures[J].Mol Cell Biochem,2012,361(1-2):9-17.
[12] Drengk A,Zapf A,Sturmer EK,et al.Influence of platelet-rich plasma on chondrogenic differentiation and proliferation of chondrocytes and mesenchymal stem cells[J].Cells Tissues Organs,2009,189(5):317-326.
[13] Park JS,Shim MS,Shim SH,et al.Chondrogenicpotential of stem cells derived from amniotic fluid,adipose tissue,or bonemarrow encapsulated in fibrin gels containing TGF-b3[J].Biomaterials,2011,32(32):8139-8149.
[14] Jonitz A,Lochner K,Tischer T,et al.TGF-β1 and IGF-1 influence the re-differentiation capacity of human chondrocytes in 3D pellet cultures in relation to different oxygen concentrations[J].Int J Mol Med,2012,30(6):666-672.
[15] Lee CH,Cook JL,Mendelson A,et al.Regeneration of thearticular surface of the rabbit synovial joint by cell homing:a proof of conceptstudy[J].Lancet,2010,376(9739):440-448.
[16] Longobardi L,O'Rear L,Aakula S,et al.Effect of IGF-I in the chondrogenesis of bone marrow mesenchymal stem cells in the presence or absence of TGF-beta signaling[J].J Bone Miner Res,2006,21(4):626-636.
[17] Chen Y,Ke J,Long X,et al.Insulin-like growth factor-1 boosts the developing process of condylar hyperplasia by stimulating chondrocytes proliferation[J].Osteoarthritis Cartilage,2012,20(4):279-287.
[18] Schmidt MB,Chen EH,Lynch SE.A review of the effects of insulin-like growthfactor and platelet derived growth factor on in vivo cartilage healing andrepair[J].Osteoarthritis Cartilage,2006,14(5):403-412.
[19] Stewart AA,Byron CR,Pondenis H,et al.Effect of fibroblast growthfactor-2 on equine mesenchymal stem cell monolayer expansion and chondrogenesis[J].Am J Vet Res,2007,68(9):941-915.
[20] Kato Y,Lwamoto M.Fibroblast growth factor is an inhibitor of chondrocyte terminal differentiation[J].J Biol Chem,1990,265(10):5903-5909.
[21] Kang YH,Jeon SH,Park JY,et al.Platelet-rich fibrin is a bioscaffold and reservoir of growth factors for tissue regeneration[J].Tissue Eng Part A,2011,17(3-4):532-553.
[22] Drengk A,Zapf A,Stürmer EK,et al.Influence of platelet-rich plasma on chondrogenic differentiation and proliferation of chondrocytes and mesenchymal stem cells[J].Cells Tissues Organs,2009,189(5):317-326.
[23] Park SI,Lee HR,Kim S,et al.Time-sequential modulation in expression of growth factors from platelet-rich plasma (PRP) on the chondrocyte cultures[J].Mol Cell Biochem,2012,361(1-2):9-17.
[24] Akeda K,An HS,Okuma M,et al.Platelet-rich plasma stimulates porcine articular chondrocyte proliferation and matrix biosynthesis[J].Osteoarthritis Cartilage,2006,14(12):1272-1280.
(编辑:杨颖)
Study of proliferation of chondrocytes co-cultured with platelet rich gel
KANG Jian1, YUAN Wen2, CHANG Zheng-qi1, SUN Hai-ning1, YU Xiu-chun1(1.Bone Section,General Hospital of Jinan Military Region,People’s Liberation Army,Jinan Shandong 250031,China;2.Department of Orthopaedics,Shanghai Changzheng Hospital,Shanghai 200003,China)
Abstract:ObjectivePreparing platelet rich gel through two-times centrifugal technique and co-culturing chondrocytes with PRG, then observing the proliferation and gene expression of chondrocytes, in order to provide a favorable way to prepare tissue engineering cartilage. MethodsCentrifugating venous blood of rabbit through two-times centrifugal technique to obtain platelet rich plasma(PRP),then detecting the concentration of various growth factor in PRP.Admixing PRP with chondrocytes of rabbit and activating them with activator.After co-cultivation,the proliferation of chondrocytes through MTT method and expression of ACAN,Collagen Ⅱ and SOX-9 through realtime-PCR were observed,and compared with common cultured chondrocytes. ResultsThe concentrations of PDGF-AB,TGF-β1,IGF-1 and VEGF in PRG were significantly higher than those in blood(P<0.05).After co-cultivation, the proliferation rate of chondrocytes and the expression of ACAN,Collagen Ⅱ and SOX-9 were significantly higher than that of common cultured chondrocytes(P<0.05). ConclusionCo-culturing chondrocytes with PRG is able to promote the proliferation and gene expression of chondrocytes.We considered that it is a excellent method to construct tissue engineering cartilage.
Keywords:platelet rich gel;chondrocytes;tissue engineering cartilage;growth factor
[收稿日期]2014-12-16[修回日期] 2014-12-25
[通讯作者]于秀淳,E-mail:yxch48@vip.sina.com
doi:10.11659/jjssx.03E015014
[中图分类号]R684
[文献标识码]A
[文章编号]1672-5042(2015)04-0387-04
