低氧诱导因子-1α在声门上型喉癌中的表达及其对颈淋巴结转移的影响
2015-03-06李晓明路秀英
李晓明,宋 琦,路秀英,邸 斌
淋巴结转移是影响头颈肿瘤预后的独立危险因素。声门上型喉癌发病隐匿,生长速度快,侵袭性强,早期即可发生颈淋巴结转移。已有大量临床病理学研究对颈淋巴结转移方式和规律进行了探讨,但声门上型喉癌颈淋巴结转移机制仍需进一步深入研究。已有研究证实,低氧诱导因子-1α(HIF-1α)在多种肿瘤细胞中呈过度表达状态[1-6],并对肿瘤临床生物学行为和预后产生影响,认为组织的相对低氧环境是造成肿瘤发展、侵袭和转移及治疗抵抗的重要因素。其主要原因是低氧能使肿瘤细胞的一些基因和蛋白的合成或表达增加[7-11],而在这个过程中HIF-1α起中枢纽带作用。目前,HIF-1α及其相关调控因子在声门上型喉癌中表达对肿瘤颈淋巴结转移的影响尚不清楚,本文对此进行了深入研究。
1 资料与方法
1.1 临床资料 选择解放军白求恩国际和平医院2006年1月—2010年12月手术治疗的声门上型喉癌63例标本,男59例,女4例;年龄43~72岁,中位年龄56岁。根据国际抗癌协会(UICC)标准(1997)确定的TNM分期:Ⅰ期8例,Ⅱ期11例,Ⅲ期14例,Ⅳ期30例;病理学分级:鳞癌Ⅰ级15例,鳞癌Ⅱ级29例,鳞癌Ⅲ级19例。所有患者接受了不同方式的喉癌切除及颈淋巴结清扫术。术后病理证实颈部淋巴结转移41例,无转移22例。切除手术标本一部分迅速置于液氮罐中保存,另一部分标本离体后2 h内放入10%中性福尔马林中固定24 h石蜡包埋,常规病理HE染色,所有标本均经2位副高以上职称的病理科医生确定病理性质和病理学分级,肿瘤组织均经病理证实为鳞状细胞癌,取63例中经病理证实为正常喉黏膜组织的癌旁组织(肿瘤与正常组织边界以外至少0.5 cm)20例作为对照。
1.2 主要试剂 一抗:鼠抗人HIF-1α和鼠抗人血管内皮生长因子(VEFG)-C单克隆抗体购自武汉博士德生物工程公司,工作浓度为1∶100;鼠抗人VEGF单克隆抗体:福州迈新生物技术公司,工作浓度为1∶75。鼠抗人VEGF-C、CD34单克隆抗体和羊抗人LYVE-1(LYVE-1 E-20:sc-19316)多克隆抗体,购自Santa Cruz公司;SP-9002试剂盒购自北京中山生物技术公司。
1.3 流式细胞仪检测HIF-1α、VEGF、VEGF-C蛋白表达 为了避免非肿瘤细胞的污染,对石蜡标本行10μm厚切片,每个标本共5张切片,简单HE染色后在显微镜下选择性对肿瘤细胞进行机械微切割[8],将从5张切片获取的肿瘤细胞集中后采用网搓法制备单细胞样品。取1×106/ml细胞悬液用PBS液洗涤2次,加一抗工作液0.1 ml(分别为HIF-1α、VEGF、VEGF-C 蛋白单克隆抗体),室温孵育30 min,PBS洗涤1次。加羊抗鼠FITC-IgG二抗100 μl,避光室温孵育 30 min。加 PBS 10 ml,离心后加PBS0.1 ml,500目铜网过滤后上机检测。在对蛋白免疫荧光标记物测定时,设一抗或二抗的本底对照和阴性对照。采用美国Beckman Coulter公司生产的Epics-XLⅡ型流式细胞仪进行检测。激发光源为15 mW的氩离子激光器,激发波长为488 nm,应用Expo 32 ADC进行免疫荧光数据分析。检测前用flow-checkTMFluorpheres(10μm)荧光微球(REF 6605359.Beckman Coulter,Inc.Fullerton,CA 92835)作为标准样品,调整仪器的变异系数值在2%以内。以荧光指数(FI)表示蛋白表达产物的相对含量,FI=瘤细胞表达的平均荧光强度/正常对照样品平均荧光强度。FI可相对客观的反映蛋白的表达程度,FI值越大,表达量越高。
1.4 反转录聚合酶链反应(RT-PCR)检测HIF-1α
1.4.1 总RNA提取:Trizol试剂法提取总RNA(按说明书方法步骤进行),具体步骤为:取50~100 mg液氮保存的组织,加冰预冷的变性液,在组织匀浆器中迅速匀浆15~30 s。加70μl 2 mol乙酸钠(pH 4.0),充分混匀。加700μl酚:氯仿:异戊醇(25∶24∶1)充分混匀,冰上15 min。10 000 g 4℃离心20 min,取上层水相。加等量异丙醇,-20℃至少30 min。10 000 g 4℃离心15 min,沉淀用500μl变性液悬起。加500μl预冷异丙醇,-20℃至少30 min。10 000 g 4℃离心15 min,弃上清,加75%乙醇洗1次,真空干燥10~20 min。用无水RNase溶解,-70℃保存。
1.4.2 逆转录反应体系和条件:DNTP 2μl,10×PCR buffer 2 μl,MgCl22 μl,Rnase抑制剂 0.5 μl,AMV 1 μl,OligdT 1 μl,适量 RNA 样品,用 ddH2O补足至20 μl。50℃ 30 min,99℃ 5 min,5℃ 5 min。PCR扩增:取4μl逆转录产物,加 MgCl23μl、10×PCR buffer 2 μl、引物各 2 μl,Tag 酶 0.5 μl,用ddH2O补足至 50μl。扩增条件为 95℃预变性5 min,94℃ 变性 45 s,62℃ 退火 45 s,72℃ 延伸1 min,30个循环后,于72℃延伸10 min。以β-actin为内参照。HIF-1α引物序列:上游引物为GTCGGACAGCCTCACCAAACAGAGC(s),下游引物为GTTAACTTGATCCAAAGCTCTGAG(as),扩增片段长度为487 bp。PCR产物以1.5%琼脂糖凝胶电泳,紫外灯下观察并照相,做定量分析。以目的产物量/β-actin产物量的比值表示最终结果。
1.5 免疫组化染色检测 HIF-1ɑ、VEGF、VEGF-C、CD34和LYVE-1蛋白表达特点及微血管密度(MVD)和淋巴管密度(LVD)计数 标本染色步骤为:石蜡切片,每张切片厚5μm,常规二甲苯脱蜡,梯度乙醇至水化。经消除内源性过氧化物酶活性和抗原修复处理后,滴加正常山羊血清室温孵育10 min,滴加一抗(抗 HIF-1ɑ、VEGF、VEGF-C、CD34和 LYVE-1抗体),4℃过夜。用 PBS缓冲液洗5 min×3次,滴加生物素标记山羊抗兔IgG,室温孵育15 min。用PBS洗5 min×3次,滴加辣根酶标记链霉素卵白素工作液室温孵育15 min,用PBS洗5 min×3次,DAB镜下控制显色。自来水充分冲洗后,用苏木精复染,梯度乙醇脱水,中性树胶封片。用PBS代替一抗作为标本染色的阴性对照。
1.6 肿瘤组织MVD和LVD的计算方法 在临床及病理特征未知的情况下,低倍镜下选择要观察的区域,MVD计数时主要观察肿瘤边缘或间质区域,LVD计数时需分别观察肿瘤实质和间质区域。在选择区域内200倍视野下随机记录5个视野的微脉管数,求其平均值作为肿瘤MVD数和LVD数。
1.7 统计学方法 应用SAS 8.0统计软件进行分析。计量资料以均数±标准差(x±s)表示,两样本均数比较采用t检验,计数资料以率(%)表示,采用χ2检验及Fisher精确检验,α=0.05为检验水准。
2 结果
2.1 HIF-1ɑ、VEGF、VEGF-C表达病理特点 3种蛋白在声门上型喉癌细胞中均有不同程度的表达,其特点为HIF-1ɑ主要表达于细胞质,部分表达于细胞核,呈棕黄色染色;VEGF主要表达在细胞质,着色为密度较高的棕黄色,在角化的癌巢表达更明显;VEGF-C染色为深棕色颗粒样,主要表达于细胞质,部分表达于细胞核,见图1。
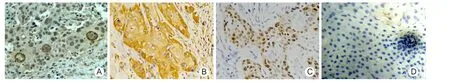
图1 HIF-1ɑ、VEGF和VEGF-C在声门上型喉癌和癌旁正常组织中表达(ABC×200)HIF-1ɑ:低氧诱导因子-1ɑ;VEGF血管内皮生长因子;A.HIF-1ɑ染色阳性;B.VEGF染色阳性;C.VEGF-C染色阳性;D癌旁正常黏膜
2.2 HIF-1α、VEGF和VEGF-C在声门上型喉癌中的表达量 肿瘤组织和癌旁正常喉黏膜组织内均有HIF-1αmRNA表达,但表达量方面比较无明显差异,见图2。HIF-1α、VEGF和 VEGF-C在颈淋巴结转移灶中的表达量高于原发灶,有颈淋巴结转移者中的表达量高于无淋巴结转移者(P<0.05,P<0.01),见表1。
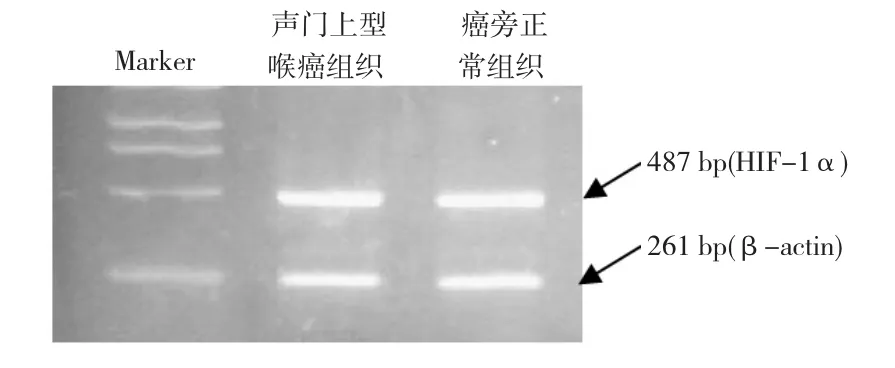
图2 低氧诱导因子-1αmRNA在正常喉黏膜和声门上型喉癌组织中表达
2.3 HIF-1α的表达与VEGF、VEGF-C的关系 经Pearson相关检验分析,HIF-1α与VEGF、VEGF-C在肿瘤组织和转移灶中的表达均呈正相关(r=0.799,r=0.789,P <0.05;r=0.686,r=0.823,P <0.05)。
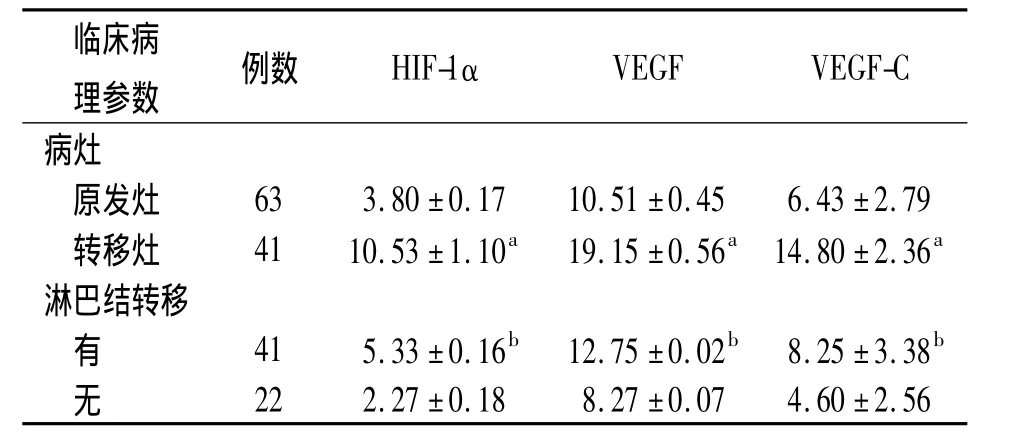
表1 HIF-1α、VEGF和VEGF-C表达荧光指数与声门上型喉癌临床病理参数的关系(x±s)
2.4 CD34和LYVE-1表达 CD34蛋白主要表达于肿瘤间质的微血管内皮细胞上,LYVE-1表达于肿瘤实质和间质内的微淋巴管内皮细胞上。对照组喉黏膜CD34着色脉管主要分布于上皮下层。CD34阳性表达的一些管状结构,管道管壁较厚,形状规则,呈圆形或椭圆形,内皮细胞核扁平,管腔内常可见大量红细胞。符合毛细血管的形态学特征。CD34染色阳性脉管主要分布在肿瘤边缘和间质区域。LYVE-1着色脉管主要分布于上皮下层,LYVE-1阳性表达的管状结构中内皮细胞呈褐色,这些管道管壁比较薄,并且不规则,管腔大,通常呈塌陷状,内皮细胞核大,且向腔内突出,符合毛细淋巴管的典型形态学特征。淋巴管腔内有时可见大量絮状物质、淋巴细胞、肿瘤细胞及其碎片。毛细淋巴管主要分布在肿瘤组织与正常组织交界处,肿瘤中心处的实质内有少量淋巴管。见图3。
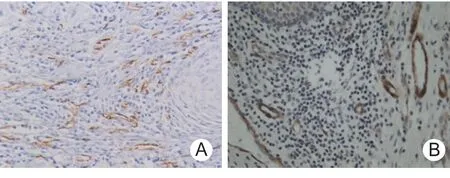
图3 声门上型喉癌组织中的微血管和微淋巴管(ABC×200)A.CD34染色阳性的微血管;B.LYVE-1染色阳性的微淋巴管
2.5 MVD和LVD计数 颈淋巴结转移的41例中,MVD和 LVD分别为35.60±6.54和28.70±7.18;在未发生颈淋巴结转移的22例中,MVD和LVD分别为11.80±3.36和8.90±3.12。颈淋巴结转移者MVD和LVD计数均高于无颈淋巴结转移者(P<0.05)。
3 讨论
HIF-1是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,能激活许多缺氧反应性基因的表达,是哺乳动物和人在缺氧条件下维持氧稳态的关键性物质[12]。已经发现,人类多数肿瘤组织中都有显著的缺氧区域,处于缺氧状态的肿瘤细胞仍能不断增殖、浸润,在此过程中HIF-1起着十分重要的作用[13]。在 HIF-1的亚型中,HIF-1α有一个氧依赖降解区(ODD),当局部氧的浓度>5%时,通过激活泛素蛋白酶体途径,作用于HIF-1αODD区,使其迅速降解,半衰期<5 min[14],因此在供氧正常的组织内很难被检测到。缺氧条件下,泛素蛋白酶对HIF-1α的降解作用受阻,引起细胞质内HIF-1α积聚增多[15]。我们的研究发现,HIF-1α蛋白在声门上型喉癌的细胞中大量表达,而在癌旁正常组织细胞中几乎检测不到。提示喉癌的肿瘤区域存在着低氧并由此诱发HIF-1α介导的低氧反应,但肿瘤细胞内的HIF-1αmRNA水平却无变化。Kallioa等[16]在体外研究中发现,低氧时HIF-1αmRNA的表达较常氧时并不增加,但是蛋白表达明显增多。因此认为,低氧下HIF-1α合成的调节并不在mRNA表达水平,而在转录和翻译后追平。本研究结果充分证明这一现象也存在于人喉癌组织中。
HIF-1α作用是通过其调节下游的各种靶基因来实现的,其中主要的基因之一就是VEGF,包括多种亚型,已有研究证实这些细胞因子可以调解和影响肿瘤微血管和微淋巴管生成[17]。本研究结果显示,声门上型喉癌中HIF-1α蛋白表达与VEGF和VEGF-C表达呈正相关。进一步研究结果显示,声门上型喉癌中MVD和LVD数量与肿瘤发生颈淋巴结转移有关。由此推测,HIF-1α可能对肿瘤微血管和微淋巴管生成具有促进作用,并可通过调节肿瘤微血管和微淋巴管生成促进颈淋巴结转移。本研究结果还显示,肿瘤转移灶中HIF-1α、VEGF、VEGF-C表达水平较原发灶升高。表明HIF-1α高表达及其对相关蛋白的调节在肿瘤转移灶形成过程中具有重要作用,但其确切机制还有待于进一步研究。
肿瘤新生血管是肿瘤生长、局部浸润和向邻近组织侵袭的必要条件,是肿瘤发生转移的促生条件。MVD越高其促生转移的概率就越高,发生转移的可能性就越大,这一现象已经得到证实[11]。肿瘤发生转移的另一个必要条件是肿瘤新生淋巴管的存在,肿瘤侵入局部微淋巴管是肿瘤发生淋巴结转移的病理解剖基础。近年肿瘤微淋巴管形成与肿瘤淋巴结转移的关系越来越引起众多学者的关注[17]。为了更加准确地阐明这一问题,人们不断寻找鉴定淋巴管的各种标志性蛋白,这其中包括目前认为最特异的淋巴管标志物 LYVE-1[18-19]。本研究发现,在有颈淋巴结转移的声门上型喉癌者中,无论是肿瘤间质和实质中的LVD均较无颈淋巴结转移者增高,表明肿瘤微淋巴管的生成对声门上型喉癌颈淋巴结转移的发生有明显影响。但有关肿瘤实质和间质内微淋巴管在颈淋巴结转移发生过程中哪一个更重要及两者的相互关系还有待于进一步研究。
[1] Wang Q,Hu D F,Rui Y,et al.Prognosis value of HIF-1alpha expression in patients with non-small cell lung cancer[J].Gene,2014,541(2):69-74.
[2] Sun G,Hu W,Lu Y,et al.A meta-analysis of HIF-1alpha and esophageal squamous cell carcinoma(ESCC)risk[J].Pathol Oncol Res,2013,19(4):685-693.
[3] Luczak M W,Roszak A,Pawlik P,et al.Increased expression of HIF-1A and its implication in the hypoxia pathway in primary advanced uterine cervical carcinoma[J].Oncol Rep,2011,26(5):1259-1264.
[4] Qiang L,Wu T,Zhang H W,et al.HIF-1alpha is critical for hypoxia-mediated maintenance of glioblastoma stem cells by activating Notch signaling pathway[J].Cell Death Differ,2012,19(2):284-294.
[5] Jochmanova I,Zelinka T,Widimsky J,Jr.,et al.HIF signaling pathway in pheochromocytoma and other neuroendocrine tumors[J].Physiol Res,2014,63(Suppl 2):S251-S262.
[6] 艾晓辉,刘蔚东,谢钢,等.缺氧诱导因子-1α和血管内皮素-1及血管内皮生长因子在胃肠道间质瘤中的表达及意义[J].中华消化外科杂志,2013,12(4):290-293.
[7] Gong K,Zhang N,Zhang K,et al.The relationship of erythropoietin overexpression with von Hippel-Lindau tumour suppressor gene mutations between hypoxia-inducible factor-1alpha and-2alpha in sporadic clear cell renal carcinoma[J].Int JMol Med,2010,26(6):907-912.
[8] Zhou J,Schmid T,Schnitzer S,et al.Tumor hypoxia and cancer progression[J].Cancer Lett,2006,237(1):10-21.
[9] Rohwer N,Cramer T.Hypoxia-mediated drug resistance:novel insights on the functional interaction of HIFs and cell death pathways[J].Drug Resist Updat,2011,14(3):191-201.
[10] Bagnall J,Leedale J,Taylor SE,et al.Tight control of hypoxia-inducible factor-alpha transient dynamics is essential for cell survival in hypoxia[J].J Biol Chem,2014,289(9):5549-5564.
[11] 成伟,李晓明,全成实,等.喉癌微血管生成中 P53 nm23蛋白和血管内皮生长因子的作用[J].中华耳鼻咽喉科杂志,2000,35(2):147-149.
[12] Fandrey J,Gassmann M.Oxygen sensing and the activation of the hypoxia inducible factor 1(HIF-1)-invited article[J].Adv Exp Med Biol,2009,648:197-206.
[13] Kizaka-Kondoh S,Tanaka S,Harada H,et al.The HIF-1-active microenvironment:an environmental target for cancer therapy[J].Adv Drug Deliv Rev,2009,61(7-8):623-632.
[14] Ke Q,Costa M.Hypoxia-inducible factor-1(HIF-1)[J].Mol Pharmacol,2006,70(5):1469-1480.
[15]Lee JW,Bae SH,Jeong JW,et al.Hypoxia-inducible factor(HIF-1)alpha:its protein stability and biological functions[J].Exp Mol Med,2004,36(1):1-12.
[16] Kallio PJ,Pongratz I,Gradin K,et al.Activation of hypoxia-inducible factor 1alpha:posttranscriptional regulation and conformational change by recruitment of the Arnt transcription factor[J].Proc Natl Acad Sci U SA,1997,94(11):5667-5672.
[17] Ji R C.Hypoxia and lymphangiogenesis in tumor microenvironment and metastasis[J].Cancer Lett,2014,346(1):6-16.
[18] Jackson D G.Biology of the lymphatic marker LYVE-1 and applications in research into lymphatic trafficking and lymphangiogenesis[J].APMIS,2004,112(7-8):526-538.
[19]袁凤霞,任力.淋巴管标记物应用于乳腺癌的研究进展[J].空军医学杂志,2011,27(4):204-206.
