参麦开肺散对NIH/3T3成纤维细胞增殖及胶原合成的影响
2015-03-06王久存楚海燕刘庆梅
郭 刚,王久存,史 颖,楚海燕,刘庆梅
组织纤维化可以累及人体几乎所有的器官和系统,据美国相关统计资料证明,致死性疾病中有近45%可归于组织纤维增生疾病[1]。而近年来肺纤维化(pulmonary fibrosis,PF)发病率和致死率呈不断上升趋势。PF是以肺泡持续性损伤、成纤维细胞(fibroblast,FB)增殖及大量细胞外基质沉积而导致肺组织反复破坏、修复,最终造成肺组织中大量胶原沉积为病理特点的一类疾病[2-4]。目前针对PF的治疗仍是世界性难题,西药治疗效果差或不良反应严重,肺移植是目前唯一有效的治疗手段。而近年来中医对PF已有较深刻的认识。诸医家将本病归属中医“肺痹”及“肺痿”范畴,认为肺肾亏虚、痰瘀阻络、肺失宣降为其基本病机[5-6]。而参麦开肺散是河北医科大学附属以岭医院根据中医辨证论治研发的治疗PF的纯中药制剂,由丹参、西洋参、麦冬等组成,具有益气养阴、化痰祛瘀通络、宣肺理气等功效,本方在临床应用能明显缓解PF患者的症状,是治疗PF的有效方剂。然而,参麦开肺散对FB增殖、胶原合成的影响等与纤维化相关的研究尚待进行。β型转化生长因子(transforming growth factorβ,TGF-β)是重要的纤维化因子,在纤维化发生中起着极其重要的作用[7-10]。因而,本研究将利用外源性TGF-β处理NIH/3T3 FB以诱导细胞纤维化反应,探讨参麦开肺散对FB中胶原及细胞外基质(extracellular matrix,ECM)相关基因、胶原蛋白表达水平以及对分泌到细胞上清中胶原蛋白含量的影响,为其进一步在临床中应用提供理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞株:NIH/3T3 FB购自中国科学院上海细胞所。
1.1.2 药物:参麦开肺散,由西洋参、麦冬、丹参、绞股蓝、半枝莲等组成,每包5 g,由河北医科大学附属以岭医院提供,是院内制剂。
1.1.3 主要试剂:DMEM基本培养液(Invitrogen);胎 牛 血 清 (FBS, Gibco);Recombinant TGF-β(R&D);TRIzol(Invitrogen);High Capacity cDNA Reverse Transcription Kit(Applied Biosystems);SYBR Premix ExTaq(Takara);RIPA(碧云天);PMSF(碧云天);BCA protein assay kit(碧云天);鼠源Ⅰ型胶原(COLⅠ)抗体(Millipore);鼠源GAPDH抗体(Cell Signaling Technology);辣根过氧化物酶(HRP)标记的-羊抗兔二抗(碧云天);HRP-羊抗鼠二抗(碧云天);蛋白分子量标准(Fermentas);Sircol assay试剂盒(Biocolor)。
1.2 方法
1.2.1 细胞培养:依据慢冻速融的原则,细胞从液氮罐中取出后迅速放入37℃的水浴锅中。待完全融化后,将细胞液从冻存管中转入15 ml离心管中离心,1200 r/min离心5 min。弃上清,加入含10%FBS的细胞培养液进行吹打。将细胞分散后,转入直径10 cm的培养皿中,添加新鲜培养液至总体积为10 ml。镜检后,37℃、5%CO2的培养箱中培养。待细胞状态趋于稳定之后,即可用于细胞铺板。
1.2.2 药物浓度的确定及分组:选用Roche公司的xCELLigence System,其操作原理是:电子传感器通过位于16孔电子微量滴定板底部的电极检测细胞阻抗,细胞越多,阻抗越大。检测到的电极阻抗用细胞指数(cell index,CI)表示。CI表示随着时间的变化,一个细胞群体与传感电极接触所产生的微量电极阻抗的变化。向16孔电子微量滴定板中每孔加入50μl不含细胞的完全培养液,设好检测程序,将滴定板放入仪器中,使用细胞计数仪对事先准备好的NIH/3T3 FB进行计数,向微量滴定板中每孔加入50μl细胞液,使每孔最终细胞数为5000个;再将滴定板放入仪器中,程序继续运行,直到生长曲线的CI值接近1.0时,取下滴定板,将细胞培养基换成无血清培养基,继续培养12 h。将参麦开肺散用完全细胞培养液稀释成不同的浓度梯度:0、1.0、1.5、2.0、2.5、5.0、10.0、15.0 mg/ml,向各孔中加入100μl含不同浓度参麦开肺散的细胞培养液,放入仪器中进行检测;参麦开肺散浓度的选择标准是对细胞毒性小、细胞增殖不受明显抑制的最大浓度。实验结果用RTCA software(Roche)进行分析。
1.2.3 纤维化体外模型的建立及处理:待细胞状态趋于稳定之后,将培养在培养皿中的细胞接种至12孔板,每孔细胞1×105个。待细胞长至融合度为80%之后,将细胞培养液换成无血清培养液,继续培养12 h。细胞常规培养后分为正常对照组、模型组和处理组,每组3个复孔。正常对照组加入含1%FBS的细胞培养液500μl,模型组加入使用含1%FBS的细胞培养液配制5 ng/ml的 TGF-β溶液500μl,处理组各孔加入5 ng/ml的 TGF-β+1 mg/ml的参麦开肺散混合溶液500μl,培养24 h。
1.2.4 荧光实时定量聚合酶链反应(Real-time PCR):提取各组细胞总RNA,逆转录合成cDNA,以此为模板,进行PCR扩增。根据Genbank数据库提供的小鼠基因外显子序列,应用primer premier 5.0软件设计Real-time PCR引物,并由上海捷瑞生物工程有限公司合成,引物序列见表1。Real-time PCR仪为ABI Prism 7900 Detector System(Applied Biosystems),PCR 反应条件:50℃、2 min,1个循环;95℃、3 min,1 个循环;95℃、15 s,60℃、40 s,40 个循环;95℃、15 s,60℃、15 s,95℃、15 s。
1.2.5 蛋白免疫印迹(Western blot)检测:收集各组细胞总蛋白,以BCA蛋白定量试剂盒测定蛋白浓度,每份蛋白样本取等量的蛋白加入胶孔中,取3μl蛋白marker加入胶孔中,80 V恒压30 min,待样本进入分离胶之后,将电压调至120 V,恒压持续1 h;将蛋白胶取下,与滤纸和PVDF膜一块放入转膜夹中,从电源正极到负极依次是滤纸、PVDF膜、蛋白胶、滤纸,夹好之后将转膜夹放入转膜槽中,将电压仪的模式调为恒流模式,电流为300 mA,转膜2 h;膜经5%脱脂牛奶室温封闭1 h后,分别与COLⅠ抗体、GAPDH抗体,4℃孵育过夜;TBST清洗,10 min×3次;加入二抗,室温孵育1 h;TBST清洗,10 min×3次;然后按照 Image Quant TL LAS 4000 mini(General Electric Company)的操作程序进行显影;最后,使用Image Quant TL Western blot分析软件(General Electric Company)进行条带分析。
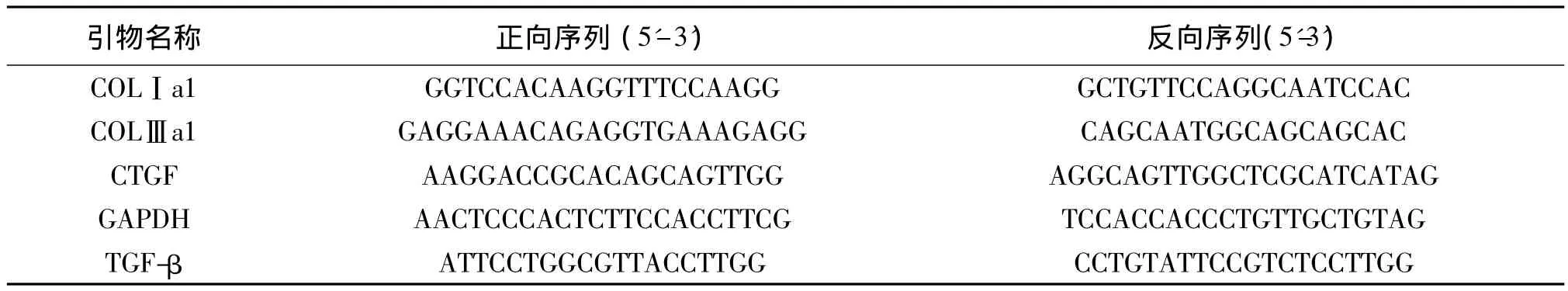
表1 荧光实时定量聚合酶链反应中引物序列
1.2.6 胶原蛋白检测(Sircol assay):收集各组细胞上清,加入100μl胶原分离与浓缩试剂(collagen isolation&concentration reagent),4℃ 过夜,12 000 g离心30 min,弃上清。标准胶原的稀释:0.5 mg/ml分别稀释到 0.2、0.1、0.05、0.01、0 mg/ml。各样本管中加入500μl的Sircol染料,机械混匀30 min。12 000 g离心10 min,弃上清。加入1×Acid-Salt Wash Reagent 750 μl,洗 1 遍,12 000 g 离心 1 min,弃上清。向各管中加入250μl的碱性金属试剂,涡漩混匀。转移200μl样本至96孔板中。在酶标仪下进行检测,调整波长至555 nm,用水调整吸光值为零,测定空白试剂,标准胶原和检测样本-空白试剂的读数重复试验的误差在±10%。重复3次。
1.3 统计学处理 采用SPSS 16.0统计软件处理数据,计量资料以均数±标准差(x±s)表示,采用方差分析,α=0.05为检验水准。
2 结果
2.1 参麦开肺散抑制FB增殖及最佳浓度 参麦开肺散浓度越大,对FB增殖的抑制作用越大,并且毒性也越大。而参麦开肺散浓度在1.0 mg/ml时,对FB毒性小,且FB增殖不受明显抑制(图1),因此,选择1.0 mg/ml作为参麦开肺散后续实验的浓度。
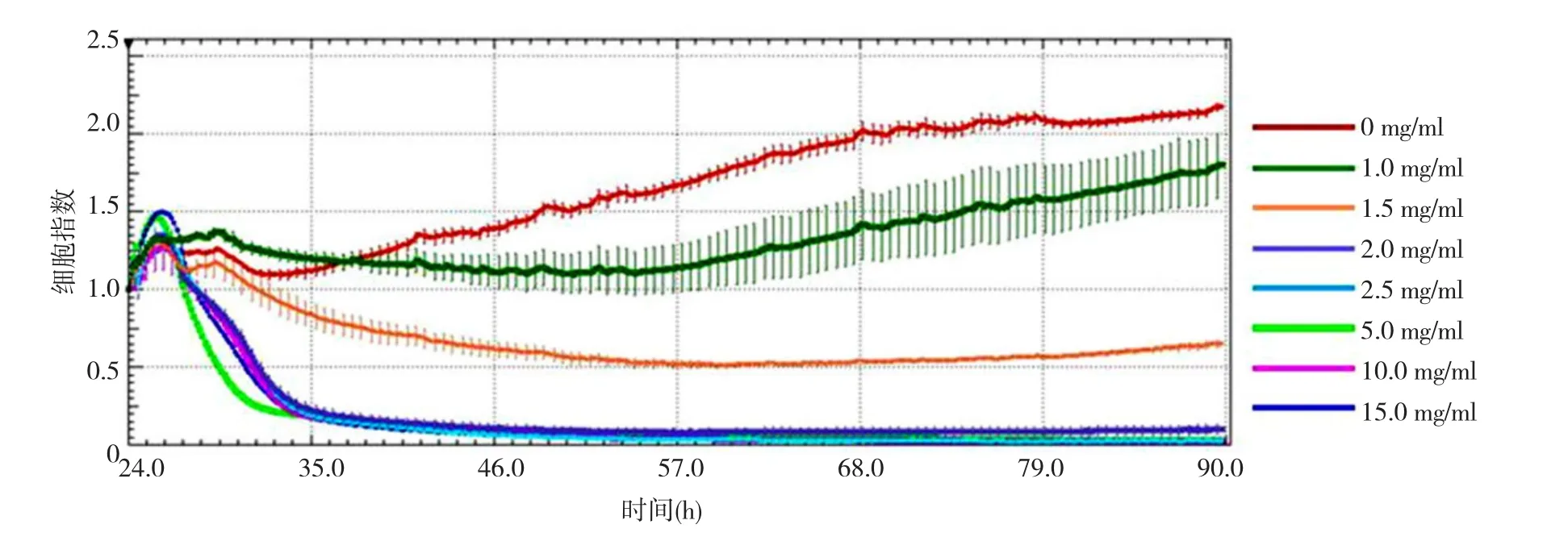
图1 不同浓度参麦开肺散处理的NIH/3T3成纤维细胞生长曲线
2.2 参麦开肺散可显著降低纤维化细胞胶原及其相关基因的表达 经过外源性TGF-β刺激之后,NIH/3T3 FB 系中 COLⅠa1、COLⅢa1、结缔组织生长因子(CTGF)、TGF-β的表达水平均显著升高(P<0.05,P<0.01),表现出类似 PB的 FB的表型。而经过参麦开肺散处理之后,上述基因的表达水平均显著下调(P<0.05,P<0.01),接近于正常水平。见图2。
2.3 参麦开肺散显著降低FB COLⅠ蛋白表达 在外源性TGF-β刺激之后,COLⅠ蛋白含量显著增高(P<0.05),而参麦开肺散可明显抑制COLⅠ蛋白的生成(P<0.05)。见图3~4。
2.4 参麦开肺散显著降低分泌到细胞上清中胶原蛋白的含量 在外源性TGF-β刺激后,细胞上清中的胶原蛋白含量显著上调,而用参麦开肺散干预后胶原蛋白含量显著下调(P<0.05),接近正常水平。见图5。
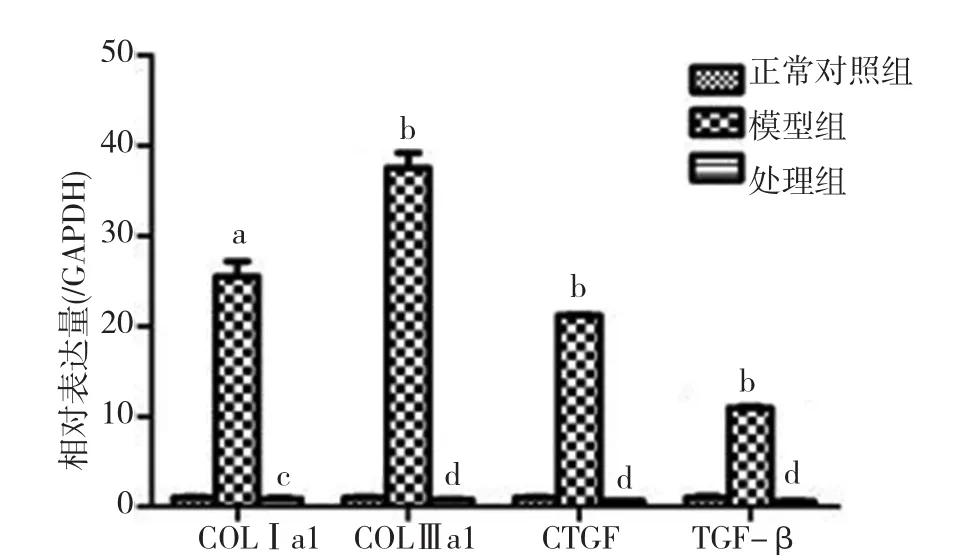
图2 参麦开肺散对体外纤维化细胞模型中胶原及其相关基因表达水平的影响COLⅠ为Ⅰ型胶原,COLⅢ为Ⅲ型胶原,CTGF为结缔组织生长因子,TGF-β为β型转化生长因子;与正常对照组比较,a P<0.05,b P<0.01;与模型组比较,c P<0.05,d P<0.01
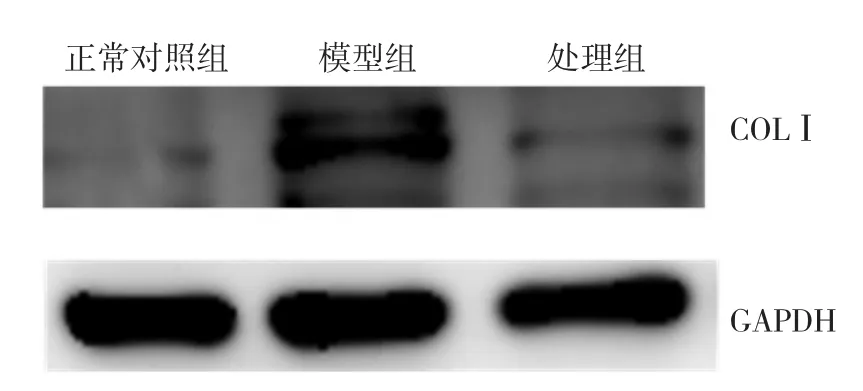
图3 参麦开肺散对成纤维细胞Ⅰ型胶原蛋白表达的影响COLⅠ为Ⅰ型胶原

图4 参麦开肺散对体外纤维化细胞模型中Ⅰ型胶原蛋白含量的影响与正常对照组比较,a P<0.05;与模型组比较,c P<0.05
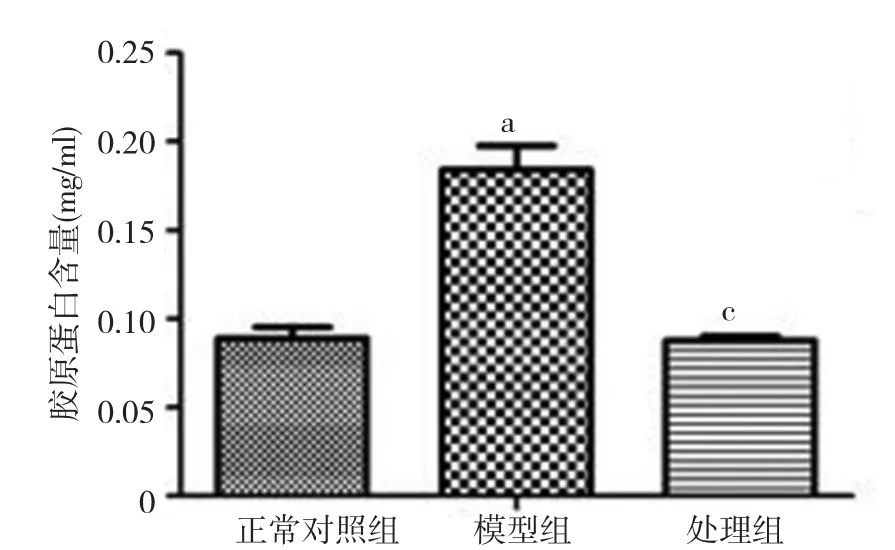
图5 参麦开肺散对细胞上清中胶原蛋白含量的影响与正常对照组比较,a P<0.05;与模型组比较,c P<0.05
3 讨论
抗纤维化是治疗纤维化疾病的主要方法,能够抑制FB活性和胶原合成是抗纤维化药物的重要特征[11-12]。TGF-β在调控FB增殖及胶原蛋白的合成与降解中起着重要作用,是目前最有效的促纤维化因子之一[13-14]。已有研究表明,上皮细胞TGF-β信号缺失时PF即终止[15],说明其在PF形成和发展过程中起关键性作用。CTGF为一种富含半胱氨酸的分泌性小分子蛋白,具有调节FB增殖、迁移以及促进TGF-β 诱导的 ECM 合成功能[16],是 TGF-β 下游重要的效应基因。有研究发现,CTGF在系统性硬化症伴PF患者肺组织内表达升高,在博莱霉素诱导的PF小鼠模型体内同样升高[17]。因此,CTGF在纤维化发生、发展过程中发挥促进作用。Lasky等[18]通过体外培养发现外源性TGF-β能够特异性地诱导CTGF表达增加2倍以上,证明在PF中CTGF的增高与 TGF-β相关。本实验表明,外源性TGF-β 可以诱导 NIH/3T3 FB中 TGF-β、CTGF基因表达水平增高,而用参麦开肺散处理后,可明显抑制其表达。说明参麦开肺散可能通过直接抑制TGF-β而防止纤维化,或通过抑制TGF-β下游效应基因CTGF表达而发挥抗纤维化作用。
众所周知,纤维化就是组织内ECM异常增多和过度沉积的病理过程,而ECM中最主要的成分就是胶原蛋白[19]。PF发生时肺组织中Ⅰ、Ⅲ型胶原含量显著增加,有研究提示,Ⅲ型胶原可作为判定PF早期或活动期的指标[20]。据报道,大鼠肺FB受到刺激因素作用后能够活跃合成Ⅰ、Ⅲ型胶原,增加ECM沉积,引起大鼠PF[21]。本实验结果提示,外源性TGF-β可以诱导NIH/3T3 FB中胶原及ECM相关基因表达、胶原蛋白合成,以及分泌到细胞上清中的胶原蛋白含量增高,类似于PF时状态。而用参麦开肺散处理NIH/3T3 FB,发现参麦开肺散不但可抑制其增殖,还可以明显抑制外源性TGF-β诱导的NIH/3T3 FB中胶原及ECM相关基因表达、胶原蛋白合成,以及分泌到细胞上清中的胶原蛋白含量。提示参麦开肺散发挥抗纤维化作用可能与其抑制FB增殖及胶原合成相关。
中药治疗PF,除了药性温和,另外一个优势就是成分众多,能够发挥多途径和多靶点的综合作用。参麦开肺散由丹参、西洋参、麦冬、绞股蓝、半枝莲等组成,具有益气养阴、化痰祛瘀通络及宣肺理气功效。现代药理研究表明,丹参可通过抗炎、抑制胶原合成、抗氧化等抑制PF的发生[22]。Th1/Th2失衡在PF中也发挥了重要作用[23],而西洋参、麦冬和绞股蓝都具有免疫调节作用[24-26]。参麦开肺散能否纠正PF中Th1/Th2失衡,还有待进一步探索。近年来大量证据表明,氧化/抗氧化失衡在PF的发生和发展中起着重要作用[27],而参麦开肺散组方中西洋参、麦冬、丹参、半枝莲均有抗氧化作用[28-31]。提示参麦开肺散也可能通过纠正氧化/抗氧化失衡和Th1/Th2失衡发挥抗PF作用。我们将通过体内外实验进一步明确参麦开肺散治疗PF的作用机制,为更好地应用于临床及新药的研发奠定基础。
[1] Wynn T A.Cellular and molecular mechanisms of fibrosis[J].J Pathol,2008,214(2):199-210.
[2] 徐慧蓉,马小兵,王献华.肺纤维化相关因子研究进展[J].现代预防医学,2011,38(10):1953-1955,1964.
[3] 高燕,雍政,黄英,等.百草枯建立肺纤维化动物模型的实验研究[J].空军总医院学报,2003,19(4):201-202.
[4] 邱慧,俞小卫,韦国桢,等.姜黄素对博莱霉素诱导大鼠肺纤维化的保护作用[J].中国医药导报,2012,9(31):23-24,27.
[5] 郭刚.肺间质纤维化中医辨治探析[J].光明中医,2010,25(10):1753-1754.
[6] 樊茂蓉,张燕萍,苗青,等.肺间质纤维化的中医发病机制与治则探讨[J].中医杂志,2012,53(3):203-204.
[7] 董晓峰,赵静,王献华,等.转化生长因子β1相关基因在肺纤维化中的作用[J].现代预防医学,2012,39(6):1548-1552.
[8] Degryse A L,Tanjore H,Xu X C,et al.TGFbeta signaling in lung epithelium regulates bleomycin-induced alveolar injury and fibroblast recruitment[J].Am J Physiol Lung Cell Mol Physiol,2011,300(6):L887-L897.
[9] 喻昌利,李林,戈艳蕾,等.罗格列酮对转移生长因子诱导的大鼠肺纤维化的影响及其作用机制研究[J].中国煤炭工业医学杂志,2010,13(5):771-773.
[10]张玉昆.肺纤维化小鼠肺组织中MMP-9和TGF-β1的表达及意义[J].中国现代医生,2014,52(4):14-16.
[11] Louneva N,HuamaIl G,Fertala J,et al.Inhibition of systemic sclerosis dermal fibroblast type I collagen production and gene expression by simvastatin[J].Arthritis Rheum,2006,54(4):1298-1308.
[12] Varga J.Antifibrotic therapy in scleroderma:extracellular or intracellular targeting of activated fibroblasts?[J].Curr Rheumatol Rep,2004,6(2):164-170.
[13]丘韶校,徐平,宋卫东.特发性肺纤维化的研究进展[J].罕少疾病杂志,2009,16(2):54-57.
[14]郑桂林,林群英,涂海健,等.特发性肺纤维化患者血清 TGF-β1、PDGF、IL-13 水平变化及相关研究[J].中国现代医生,2012,50(31):59-61.
[15]Noble P W,Barkauskas C E,Jiang D.Pulmonary fibrosis:patterns and perpetrators[J].J Clin Invest,2012,122(8):2756-2762.
[16] Abraham D J,Krieg T,Distler J,et al.Overview of pathogenesis of systemic sclerosis[J].Rheumatology(Oxford),2009,48(3):iii3-7.
[17] Bonniaud P,Margetts P J,Kolb M,et al.Adenoviral Gene Transfer of Connective Tissue Growth Factor in the Lung Induces Transient Fibrosis[J].Am J Respir Crit Care Med,2003,168(7):770-778.
[18]Lasky J A,Ortiz L A,Tonthat B,et al.Connective tissue growth factor mRNA expression is upregulated in bleomycin·induced lung fibrosis[J].Am J Physiol,2008,275(2 Pt 1):L365-371.
[19]韩军伟,高俊玲.骨髓间充质干细胞治疗肺纤维化的研究进展[J].疑难病杂志,2010,9(2):159-161.
[20] Lai C K,Wallace WD,Fishbein M C.Histopathology of pulmonary fibrotic disorders[J].Semin Respir Crit Care Med,2006,27(6):613-622.
[21]吴浩,许祖德,张月娥,等.纤维连接蛋白在大鼠肺纤维化中的作用[J].中华结核和呼吸杂志,2001,24(1):40-42.
[22]宫金艳.丹参对大鼠肺纤维化的影响研究[J].湖南中医杂志,2013,29(2):122-123.
[23]庄谊,张德平.肺纤维化与Th1/Th2失衡[J].国外医学呼吸系统分册,2005,25(5):349-351.
[24]杨修仕,周闲容,王丽君,等.西洋参多糖的超滤分离及其免疫增强活性研究[J].食品工业科技,2014,35(5):49-52,57.
[25]黄光辉,孙连娜.麦冬多糖的研究进展[J].现代药物与临床,2012,27(5):523-529.
[26]吴宗群,王艳.绞股蓝的化学成分和药理作用研究现状[J].中华全科医学,2011,9(1):116-117.
[27] Cheresh P,Kim SJ,Tulasiram S,et al.Oxidative stress and pulmonary fibrosis[J].Biochim Biophys Acta,2013,1832(7):1028-1040.
[28]吴华彰,赵云利,费鸿君,等.西洋参皂甙的抗氧化功能及其对小鼠遗传损伤的保护作用[J].中国生物制品学杂志,2012,25(1):61-64.
[29]陈华,赵荣华,贾巧,等.麦冬不同溶剂提取物的体外抗氧化活性[J].分析试验室,2013,32(3):18-21.
[30]秦海燕,索志荣.丹参水提物的体外抗氧化活性分析[J].西南科技大学学报,2012,27(2):82-85.
[31]刘婷,王晓妍,曹志群.半枝莲药理作用及临床应用研究进展[J].河南中医,2013,33(3):424-426.
