VEGF和SDF-1α对材料表面内皮再生影响的对比研究
2015-03-06谭建英陈俊英丁红燕
王 媛,谭建英,陈俊英,刘 涛,丁红燕
(1.西南交通大学 材料先进技术教育部重点实验室,材料科学与工程学院,成都 610031; 2.淮阴工学院 江苏省介入医疗器械研究重点实验室,江苏 淮安 223003)
VEGF和SDF-1α对材料表面内皮再生影响的对比研究
王 媛1,2,谭建英1,陈俊英1,刘 涛2*,丁红燕2
(1.西南交通大学 材料先进技术教育部重点实验室,材料科学与工程学院,成都 610031; 2.淮阴工学院 江苏省介入医疗器械研究重点实验室,江苏 淮安 223003)
血管支架植入后血栓及再狭窄依然是临床上的主要问题。通过材料表面仿生微环境的构建改善支架抗凝性能并加速血管内皮修复是解决上述问题的主要手段。研究表明,VEGF和SDF-1α均可有效介导血管内皮细胞的增殖与迁移。为比较两类因子在内皮化过程中的功能差异,选择在材料表面构建纤连蛋白/肝素功能层,并分别引入VEGF与SDF-1α两种因子,通过XPS和水接触角检测研究修饰表面的理化性质。体外动态释放实验结果显示,修饰层具有良好的控制因子释放的能力。体外细胞相容性评价结果显示,VEGF和SDF-1α均具有刺激内皮细胞增殖和迁移的功能,但VEGF表现出更强烈的调节内皮细胞行为的功能。
纤连蛋白;VEGF;SDF-1α;内皮细胞
0 引言
冠心病严重危害着人类生命健康。临床上,冠脉搭桥术和冠脉支架介入术是治疗冠心病的主要手段[1]。然而,由于材料表面生物相容性不足,支架在植入体内后往往会引发一系列的并发症。此外,对于临床常用的药物洗脱支架,抗增生药物的使用还会造成血管内皮修复延迟,进而引发晚期血栓和再狭窄等问题,最终导致植入失败[2-3]。在人体内,血管内皮组织提供了一层天然的无血栓形成表面,并能通过分泌重要的化学分子如NO等来保持血管内生理平衡[4]。因此,在满足血液接触性材料对抗凝要求的基础上,如何在血管支架表面快速形成一层完整的血管内皮层成为研究者关注的焦点。
血管内皮生长因子(Vascular endothelium growth factor,VEGF)是参与新生血管发生和血管内皮再生过程的一种重要细胞因子。VEGF不仅具有促进内皮细胞增殖的效果,还可通过诱导胶原酶和基质金属蛋白酶的表达以及细胞外基质的降解,诱导内皮细胞的迁移[5-6]。基质细胞衍生因子(stromal cell derived factor-1α,SDF-1α)是一种小分子趋化因子,不仅能够动员骨髓干/祖细胞向血管损伤位点归巢,参与损伤修复[7],还可以刺激损伤位点周围内皮细胞的增殖和迁移行为,诱导内皮快速再生[8]。然而这两种生物因子引入材料表面后,对内皮细胞增殖及迁移行为的调控能力是否存在差异仍不得而知。
前期工作已证明Hep/Fn微环境在一定程度上实现了Ti表面抗凝和促内皮双功能化[9],在此基础上,本文在Hep/Fn微环境表面分别引入VEGF或SDF-1α,通过XPS及水接触角检测评价表面的理化性质,通过动态释放实验研究两种生物因子的释放行为,通过体外细胞增殖及迁移实验评价两种生物因子在促内皮再生方面的差异。
1 实验部分
1.1 试剂
多聚赖氨酸(PLL, 150~300 KDa,sigma),低分子量肝素钠(4~8 KDa,sigma),VEGF(sigma),SDF-1α(sigma)。
1.2 修饰层的构建
(1)Hep/Fn微环境的构建:参考前期工作构建Hep/Fn微环境[9],样品命名为HFn。
(2)VEGF和SDF-1α的引入:用PBS(pH 7.4)配置200 ng/mL的VEGF和SDF-1α溶液,向HFn表面分别滴加50 μL VEGF和SDF-1α,烘箱37℃静置2h后,取出洗净,样品分别命名为HFn-V和HFn-S。
1.3 修饰层的成分表征
利用X射线光电子能谱对所制样品表面进行检测,获知修饰层的表面成分,以确定修饰层表面生物分子的成功固定。
1.4 修饰层的理化性质表征
利用X射线光电子能谱检测修饰层构建过程中表面的元素组成及成分比例的变化情况。利用JY-82接触角测定仪对修饰层构建过程中表面亲疏水性的变化进行表征。
1.5 修饰层生物因子的稳定性
将所制备的HFn-V和HFn-S样品分别置于含无菌PBS的离心管中,37℃下振荡(60~65 rpm),在1、3、5、7、10、14以及21天时取出释放液,使用VEGF和SDF-1α的ELISA试剂盒对释放液中生物因子的含量进行检测。
1.6 细胞相容性评价
1.6.1 体外ECs增殖实验
从新鲜人脐带静脉分离血管内皮细胞,置于37℃恒温细胞培养箱内培养,培养基为含15%胎牛血清和20 μg/mL内皮生长因子补充物(ECGS)的DMEM/F-12培养基。当细胞融合度达到80%以上时,使用胰蛋白酶消化细胞,用培养基调节细胞密度至5×104,并种植于样品表面。37℃培养1d和3d后,使用CCK-8检测细胞增殖活性,同时用罗丹明对细胞进行染色,在荧光显微镜下观察细胞粘附形态和粘附密度。
1.6.2 体外ECs迁移实验
将1cm×2cm的钛箔对折成直角,其中一半命名为A面,另一半则为B面。首先,在A面分别构建HFn-V和HFn-S两种修饰层;然后,将样品置于24孔板内,B面位于孔底,在B面种植高密度ECs(5×105 cell/mL),6h后移除B面的细胞悬液,此时细胞已铺满B面;移除旧培养基,将样品翻转,A面置于24孔板底部,加入新鲜1ml培养基。24h后取出样品,依次对A面用PBS清洗CM)、2.5%戊二醛固定、罗丹明染色,最后在荧光显微镜下观察细胞从折痕处向A面的迁移情况。
2 结果与讨论
2.1 修饰层XPS检测结果
由XPS全谱图(图1左)和S元素高分辨谱图(图1右),相对于TiOH表面, HFn、HFn-V和HFn-S表面均出现了N1s和S2p吸收峰,其中N元素主要来自Fn,VEGF和SDF-1α,而S元素则是肝素的特征元素。结合元素组成分析(表1),可见VEGF和SDF-1α引入后,材料表面N元素含量有所上升,该结果表明生物分子均成功固定于材料表面。

图1 各样品表面XPS全谱图(左)以及硫元素的高分辨图谱(右)
表1 各样品表面元素组成及含量百分比

SamplesC%N%O%S%TiOH50.970.0948.940HFn57.067.0534.151.74HFn-V55.798.7033.981.53HFn-S53.578.3537.821.26
2.2 修饰层的亲疏水性结果
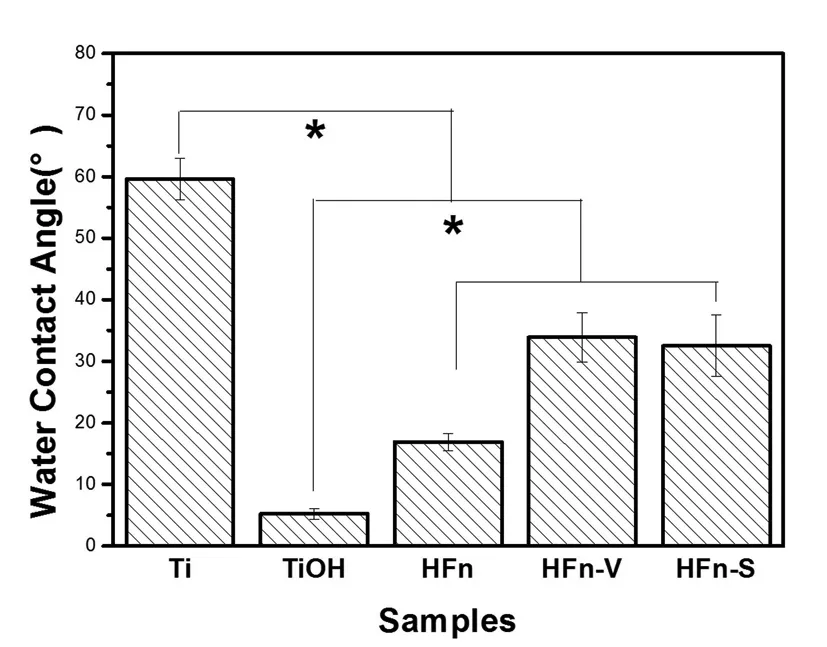
图2 各样品表面亲疏水性结果
由图2可以看出,Ti表面经碱热处理后,水接触角大幅降低,这主要是由于碱热处理的表面含大量亲水性羟基基团。肝素和纤连蛋白共固定后,表面的水接触角有所上升,虽然肝素是一种富含亲水性基团(羧基、羟基、磺酸基)的分子,但蛋白质分子中则含有大量的烃基等非亲水性基团,因此纤连蛋白的存在引起表面接触角上升。相对于HFn表面,HFn-V与HFn-S表面的水接触角进一步增高,这是由于表面蛋白质含量上升所致,也说明生物因子VEGF和SDF-1α均成功引入材料表面。
2.3 修饰层生物因子的稳定性
图3为动态条件下,HFn-V与HFn-S表面生物因子累积释放量检测结果,其中HFn样品作为空白对照。由结果可知,在24h内,VEGF和SDF-1α均呈现快速释放的趋势,单位面积释放因子量分别为0.46 ng/cm2和0.21 ng/cm2。

图3 材料表面两种生物因子动态释放统计结果(mean±SD, N=6)
此后,因子释放速率减缓,1-14天内VEGF和SDF-1α累积释放量分别为2.26 ng/cm2和
1.05 ng/cm2。14天后,生物因子释放速率趋于平稳,至21天VEGF和SDF-1α累积释放量分别为2.49 ng/cm2和1.16 ng/cm2。VEGF与SDF-1α在释放趋势上相似,但在释放量上存在明显差异,这一方面可能是由于两种因子在材料表面的固定量不同,另一方面可能是两种因子与肝素之间的结合力存在明显差异。结合文献报道[10]分析, VEGF-A在10 pM到1 nM范围内促内皮细胞增殖的能力随着浓度的增大而增加,而在本研究中VEGF的固定及释放量已达到刺激内皮细胞生物行为的范围。此外,人体内皮克浓度的SDF-1α即可以发挥有效的刺激细胞动员迁移的作用。这表明,HFn-S表面SDF-1α的含量也达到诱导细胞增殖迁移的剂量,两种修饰层中生物因子的持续释放对促进内皮再生具有重要意义。
2.4 ECs体外培养
图4为内皮细胞在不同样品表面培养1天和3天后,细胞粘附形态和增殖活性检测结果。由结果可知,相对于Ti表面,HFn修饰的样品表面内皮细胞体积较小(图4A),但增殖活性并未出现显著提升(图4B)。HFn-V和HFn-S表面,内皮细胞均呈现铺路石形态(图4A),CCK-8结果显示,1天时两种样品表面细胞CCK-8值与Ti相比无明显差异, 3天时HFn-V表面内皮细胞增殖活性显著高于纯Ti表面,而HFn-S表面细胞增殖活性与纯Ti相当(图4B)。

(A)及CCK-8检测值 (B)(mean±SD, *p<0.05, N=3)
分析其原因,Ti表面亲水性适中,有利于培养基中粘性蛋白的吸附,从而有效促进细胞粘附、铺展以及增殖等行为。修饰层构建过程中碱活化处理方式使Ti呈高亲水性表面,这可能造成粘性蛋白在材料表面的解吸附,对细胞生长不利。此外,PLL的使用使表面氨基密度提高,也会表现出微弱的细胞毒性[11]。受这两种因素的影响,样品HFn、HFn-V和HFn-S在初期(1d)并未表现出优于Ti的细胞相容性。但随着时间的延长,细胞培养到3d时,HFn-V表面表现出明显更高的细胞增殖活性,而HFn和HFn-S表面细胞增殖活性与纯Ti相当,这表明 VEGF作为ECs特异性细胞有丝分裂素,能够比SDF-1α更有效的刺激ECs增殖。
2.5 ECs体外迁移
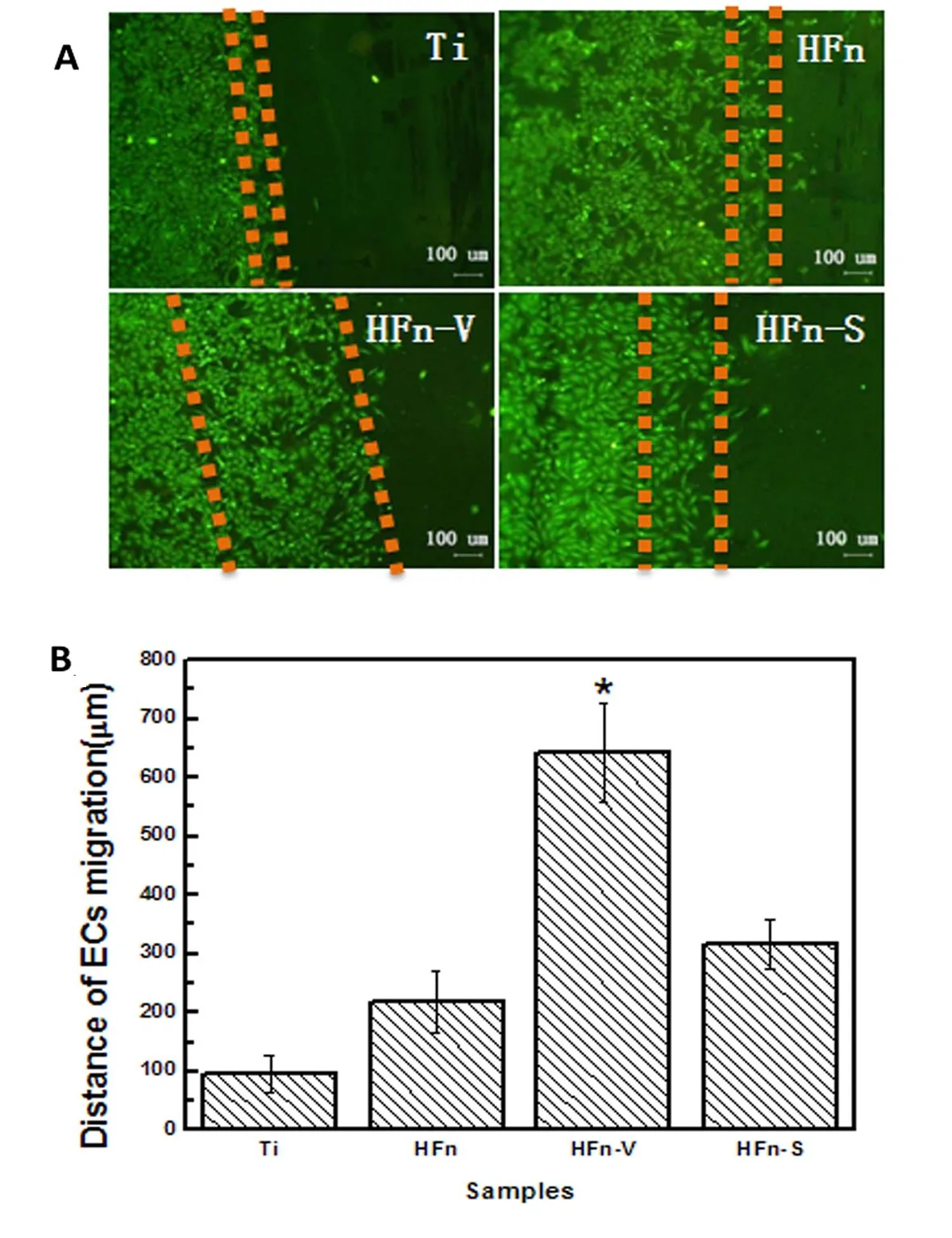
图5 ECs迁移24h后,(A)细胞荧光染色图片及(B)细胞迁移距离结果 (mean±SD, *p<0.05, N=6)
由图5A可以看出,ECs迁移实验24h后,各样品表面的细胞均发生了一定程度的迁移,但可明显看出不同的修饰层表面ECs的迁移速率不同。图5B为ECs在样品表面迁移距离的统计结果,虽然Ti表面有利于ECs的增殖(图4),但并未表现出明显的促进细胞迁移的作用。而HFn表面ECs迁移距离相对于Ti有所提升,这可能是因为修饰层中Fn发挥出介导ECs迁移行为的功能;相对于HFn表面,HFn-V和HFn-S表面ECs迁移距离均表现出不同程度的提高,其中HFn-V表面ECs的迁移距离显著高于HFn-S表面。该结果表明VEGF和SDF-1α均具有刺激ECs迁移的功能,但VEGF对细胞迁移的作用要优于SDF-1α。这可能是因为VEGF能刺激ECs基质金属蛋白酶以及胶原的表达,促进细胞外基质降解,从而更有效的诱导ECs迁移[12]。
3 结论
本研究通过XPS和水接触角实验证明VEGF和SDF-1α成功引入Ti材料表面。体外生物因子动态释放实验结果表明,构建的修饰层能控制生物因子持续释放,其释放速率取决于生物因子与肝素之间的结合作用。通过体外内皮细胞增殖和迁移实验,发现VEGF具有比SDF-1α更显著的刺激细胞生长和迁移的能力。
[1] Mohr F W,Morice M C,Kappetein A P,et al.Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial[J].The lancet,2013,381(9867):629-638.
[2]NazneenF,HerzogG,ArriganDWM,etal.Surfacechemicalandphysicalmodificationinstenttechnologyforthetreatmentofcoronaryarterydisease[J].JournalofBiomedicalMaterialsResearchPartB:AppliedBiomaterials, 2012,100(7):1989-2014.
[3]InoueT,CroceK,MorookaT,etal.Vascularinflammationandrepair:implicationsforre-endothelialization,restenosis,andstentthrombosis[J].JACC:CardiovascularInterventions,2011,4(10):1057-1066.
[4]ShimokawaH,SatohK.Vascularfunction[J].Arteriosclerosis,thrombosis,andvascularbiology,2014,34(11):2359-2362.
[5]EichmannA,SimonsM.VEGFsignalinginsidevascularendothelialcellsandbeyond[J].Currentopinionincellbiology,2012,24(2):188-193.
[6]Avci-AdaliM,ZiemerG,WendelHP.InductionofEPChomingonbiofunctionalizedvasculargraftsforrapidinvivoself-endothelialization—areviewofcurrentstrategies[J].Biotechnologyadvances,2010,28(1):119-129.
[7]DeVisscherG,MesureL,MeurisB,etal.ImprovedendothelializationandreducedthrombosisbycoatingasyntheticvasculargraftwithfibronectinandstemcellhomingfactorSDF-1α[J].Actabiomaterialia,2012,8(3):1330-1338.
[8]YamaguchiJ,KusanoKF,MasuoO,etal.Stromalcell-derivedfactor- 1effectsonexvivoexpandedendothelialprogenitorcellrecruitmentforischemicneovascularization[J].Circulation,2003,107(9):1322-1328.
[9]WangX,LiuT,ChenY,etal.Extracellularmatrixinspiredsurfacefunctionalizationwithheparin,fibronectinandVEGFprovidesananticoagulantandendothelializationsupportingmicroenvironment[J].AppliedSurfaceScience,2014,320:871-882.
[10]BernatchezPN,RollinS,SokerS,etal.RelativeeffectsofVEGF-AandVEGF-Conendothelialcellproliferation,migrationandPAFsynthesis:Roleofneuropilin-1[J].Journalofcellularbiochemistry,2002,85(3):629-639.
[11]WangJ,ChenY,LiuT,etal.Covalentco-immobilizationofheparin/laminincomplexthatwithdifferentconcentrationratioontitaniumsurfaceforselectivelydirectionofplateletsandvascularcellsbehavior[J].AppliedSurfaceScience,2014,317:776-786.
[12]MichaelJ.Cross,JhanDixelius,TaroMatsumoto,LenaClaesson-Welsh.VEGF-receptorsignaltransduction[J].TRENDSinBiochemicalSciences.2003,28(9):488-494.
(责任编辑:尹晓琦)
Comparison Research of VEGF and SDF-1α Modified Surface on the Influence of Endothelium Regeneration
WANG Yuan1,2,TAN Jian-ying1,CHEN Jun-ying1,LIU Tao2*,Ding Hong-yan2
(1.Key Lab. for Advanced Technologies of Materials, Ministry of Education, School of Material Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China;2.Jiangsu Provincial Key Lab. for Interventional Medical Devices, Huaiyin Institute of Technology,Huai'an Jiangsu 223003, China)
Thrombosis and restenosis caused by vascular stent implantation remain major clinical problems. Biomimetic microenvironment construction of stent surface to improve the anticoagulant ability and accelerate re-endothelialization has been a main approach to solve above problems. According to recent research, both VEGF and SDF-1α were found to promote endothelial cells proliferation and migration effectively. To compare the stimulating effect of these two cytokines on endothelialization, VEGF or SDF-1α was incorporated into the fibronectin and heparin modified Ti surface, respectively. XPS and water contact angle assay were used to investigate physical-chemical properties of modified surfaces. The modified surface was found to control VEGF and SDF-1α release according to in vitro dynamic release results. In vitro cellular compatibility results indicated that both VEGF and SDF-1α might contribute to cell proliferation and migration. However, VEGF was found more effective in stimulating cell behavior compared with SDF-1α.
fibronectin; VEGF; SDF-1α; endothelial cells
2015-04-15
国家自然科学基金项目(31170916,31470921);淮阴工学院校科研基金项目(491714296)
王媛(1990-),女,四川成都人,硕士,主要从事心血管材料表面改性研究;*为通讯作者。
R318.1
A
1009-7961(2015)05-0007-05
