基于ELISA-生长曲线对食品中沙门氏菌定量检测的研究
2015-03-06苏远科张国林李纯钢
苏远科 张国林 李纯钢
沙门氏菌属(salmonella)是一大群寄生于人类和动物肠道内,生化反应和抗原构造相似的革兰氏阴性杆菌[1,2]。据统计在世界各国的种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。国内外对食品中沙门氏菌的检测技术或检测方法研究并不鲜见[3-5]。这些方法大都都是对沙门氏菌的定性检测但是对沙门氏菌定量研究很少。目前,仅有SN/T0040-1992是沙门氏菌定量方法,原理是基于MPN法实现定量。SN/T0040-1992虽然可以定量检测但是缺点操作繁琐,需要稀释三个梯度或更多,每个梯度3管共9管,每个管都要进行阴阳性判断才能确定,耗时费力,同时,该方法由于从225 ml 10倍样品稀释液中取1 ml用来增菌培养存在漏检风险。本课题以肠炎沙门氏菌为例对沙门氏菌定量研究模型进行探讨,基于ELISA和细菌生长曲线应用的结合,研究沙门氏菌的定量,开发一种一种操作简单有效能够对样品中沙门氏菌本底含量检测的方法。
1 材料与方法
1.1 材料与仪器
1.1.1 实验仪器:MiniVidas酶联免疫分析仪制造商生物梅里埃,恒温培养箱型号INE600制造商MEMMERT。
1.1.2 培养基:缓冲蛋白胨水(BP)海博生物批号20120509,亚硒酸盐胱氨酸增菌液(SC)海博生物批号20120506,四硫磺酸盐煌绿增菌液(TTB)海博生物批号20120309,亚硫酸铋琼脂(BS)海博生物批号20120417,DHL琼脂海博生物批号20120315,3M菌落总数测试片规格型号 PertrifilimTM 6406批号2013-10TP。
1.1.3 菌株:肠炎沙门氏菌株(salmonella enteritidis)3代,大肠杆菌(escherichia coli)3代(购置中国工业菌种保藏中心),奇异变形菌(P.mirabilis)2代(实验室分离获得)
1.2 方法
1.2.1 标准菌株活化:以无菌操作将菌株滤纸片放入10 mm缓冲蛋白冻水试管中,36℃培养过夜;培养液划线接种平板BS,DHL培养24~48 h;挑去单菌落接种到盛有20 ml BPW的试管中培养18 h备用。
1.2.2 菌液的梯度稀释及计数:10倍梯度稀释菌液(10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8),分别将10-5、10-6、10-7、10-8稀释液1 ml接种测试片,每个梯度接种2片,放入培养箱36℃培养24~48 h后计数。
1.2.3 酶联免疫分析仪测试值(荧光值)与沙门氏菌浓度函数关系建立:肠炎沙门氏菌株纯化后挑去单菌落接种于缓冲蛋白胨水中10~20 ml 36℃培养12~18 h,分别进行10倍稀释,5倍稀释,4倍稀释3倍稀释和2倍稀释。选取2、3、4、5、10、20、30、40、50、100、200、300、400、500、1 000倍稀释液使用Vidas检测,同时使用3M细菌菌落计数测试片对培养液10-5,10-6,10-7进行计数。然后建立Vidas测试值与沙门氏菌浓度(取对数值)数学函数关系式。
1.2.4 沙门氏菌在两种培养液中的生长曲线绘制:使用不同浓度沙门氏菌分别接种TTB(1、10、50、150、 380 cfu/ml)、SC(0.58、5.8、20、58、200、580 cfu/ml)增菌液100 ml于42℃和36℃培养间隔1或2 h取样,使用测试片对沙门氏菌计数,培养至16~20 h。绘制不同接种浓度沙门氏菌在两种培养液中的生长曲线。
1.2.5 生长曲线对人为污染样品的检测:选用样品常温和冷鲜猪和鸡肉25 g进行人为污染,放入25 ml增菌液均质1 min,然后加入剩下的200 ml增菌液置于36℃和42℃培养,分析建立的方法对人为污染样本检出的的误差。
1.2.6 干扰试验:选择大肠杆菌,金黄色葡萄球菌,单核细胞增生李斯特氏菌,变形杆菌作为干扰菌。设置两组相同的样品,第1组如同验证试验部分,只添加一定浓度的肠炎沙门氏菌到样品中,第2组在第1组的基础上添加干扰菌混合液包括大肠埃希菌,金黄色葡萄球菌,单增李斯特氏菌和变形杆菌,每种干扰菌的添加量均是目标菌10倍以上。操作同验证试验部分,在SC增菌液中增菌10 h,使用vidas对增菌液检测。每种干扰菌的添加量均是目标菌10倍以上。操作同验证试验部分,在SC增菌液中增菌10 h,使用vidas对增菌液检测。
2 结果
2.1 vidas检测值与菌浓度关系及验证 本文发现,Vidas测试值与沙门氏菌浓度(对数值)函数关系为y =0.102x3-0.648x2+1.563x+5.826,相关系数R2= 0.994,X值适应范围0.2~3.8,对应沙门氏菌浓度范围约106~108cfu/ml,即vidas对沙门氏菌检测底限约在106cfu/ml,而菌浓度超过108cfu/ml会出现x值钝化状态,可能与抗原抗体结合饱和有关。取经过一系列稀释梯度的肠炎沙门氏菌液6管分别对其进行vidas检测和使用3 M测试片计数进行了验证试验。通过验证发现,vidas检测计算值与测试片所得值相对误差最小0.13%,最大2.50%,平均相对误差1.33%。见图1、表1。
2.2 肠炎沙门氏菌在TTB和SC中生长曲线的建立我们比较肠炎沙门氏菌若干梯度在sc增菌液36℃培养生长曲线发现,生长曲线对数期的中后期培养8~10 h是进行vidas检测较好时机,而vidas最佳检测区间在沙门氏菌浓度在106cfu/ml到108cfu/ml,这时各梯度生长曲线区分度分较好,进入平稳期曲线则近于粘合。横坐标为培养时间(h)纵坐标我们发现肠炎沙门氏菌在TTB培养基中生长曲线的对数期要短些,培养12 h后基本进入稳定期。其中接种1 cfu/ml为例经过2 h的调整期进入对数期,经过约14 h后进入稳定期,不同接种浓度沙门氏菌在调整期都是2 h,不
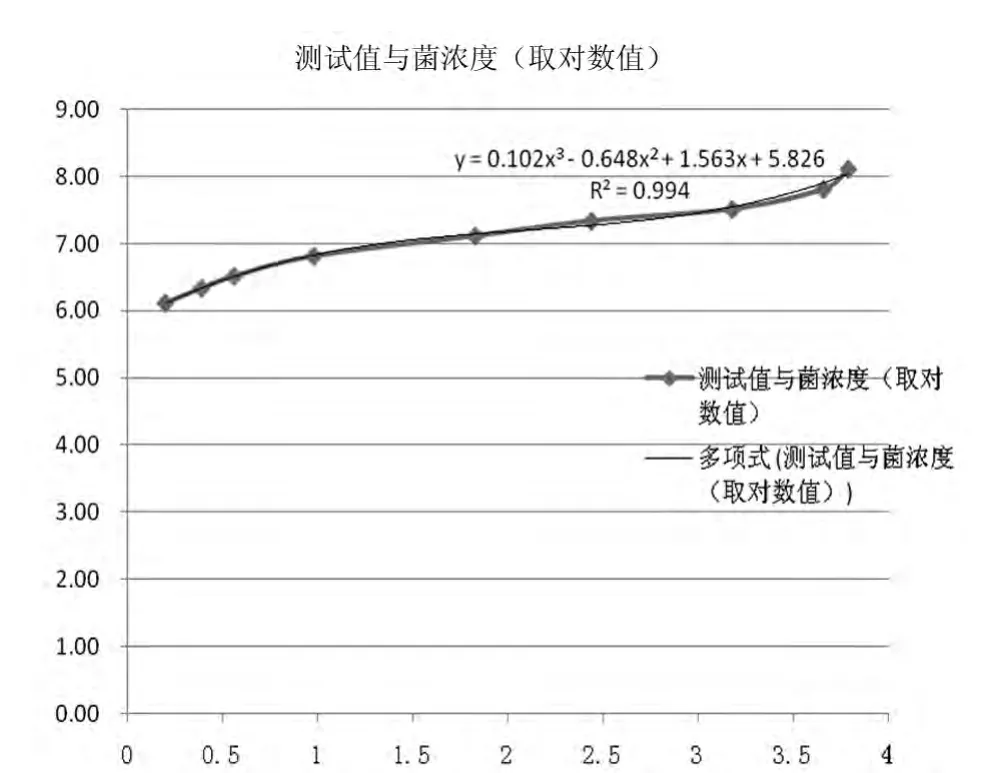
图1 Vidas测试值横坐标与菌浓度纵坐标(取对数值)函数关系
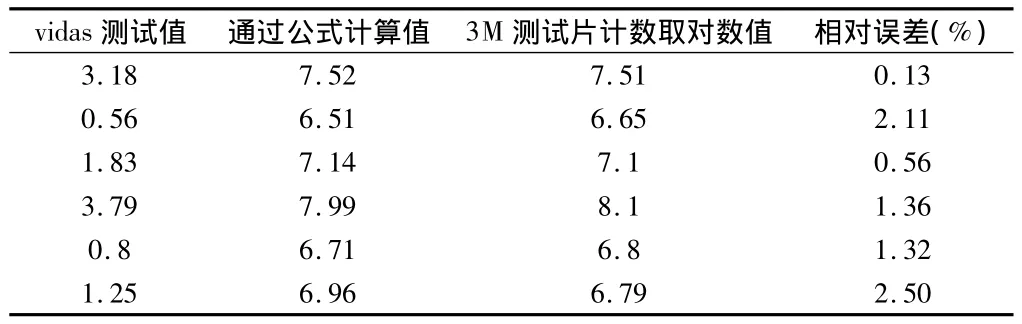
表1 验证试验中通过vidas检测得到数值代入公式计算值与实测值对比分析
同的是浓度越高对数期时间越短更早的进入稳定期。见图2、3。
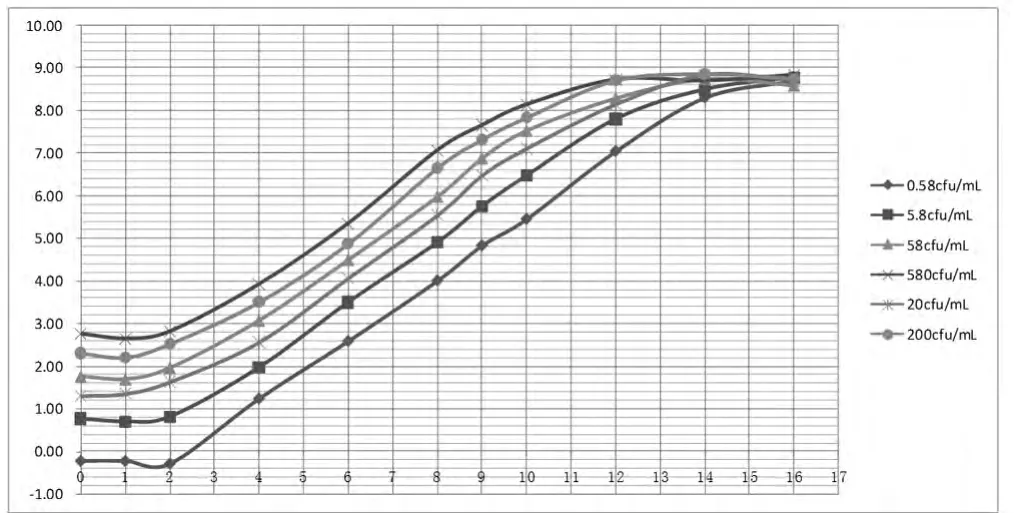
图2 肠炎沙门氏菌若干稀释梯度在SC增菌液36度培养生长曲线
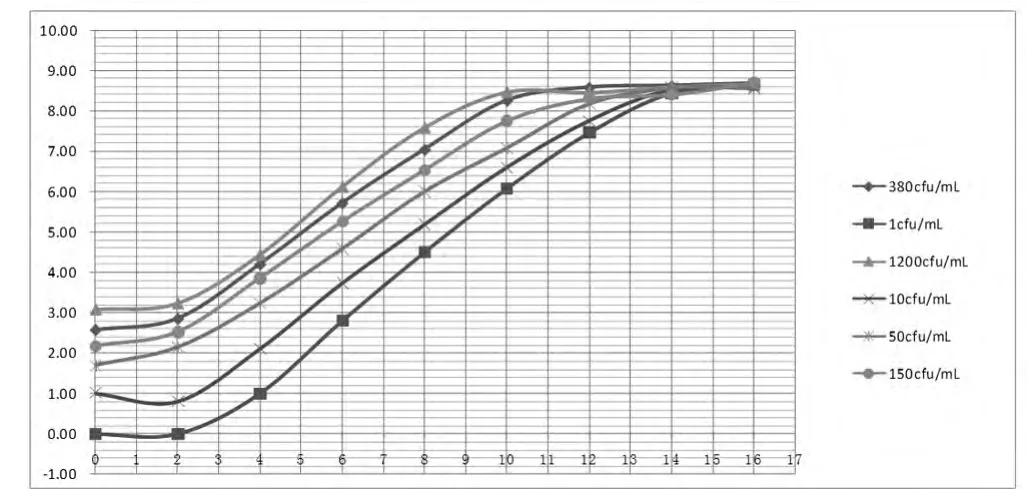
图3 肠炎沙门氏菌若干稀释梯度在TTB增菌液42度培养生长曲线
2.3 通过生长曲线对人为污染样品的检测 本文发现,在SC增菌液中,冷鲜猪肉模拟样品相对误差较大,其余样本误差均在10%以内;在TTB增菌液中,冷鲜猪肉模拟样品相对误差在28.6%,而其他样本误差均在10.0%以内。见表2~5。
2.4 干扰实验 本文发现,干扰试验中对含有干扰菌的样品检测与不含干扰菌的检测误差平均值为0.17,相对误差平均值在11.0%。见表6。
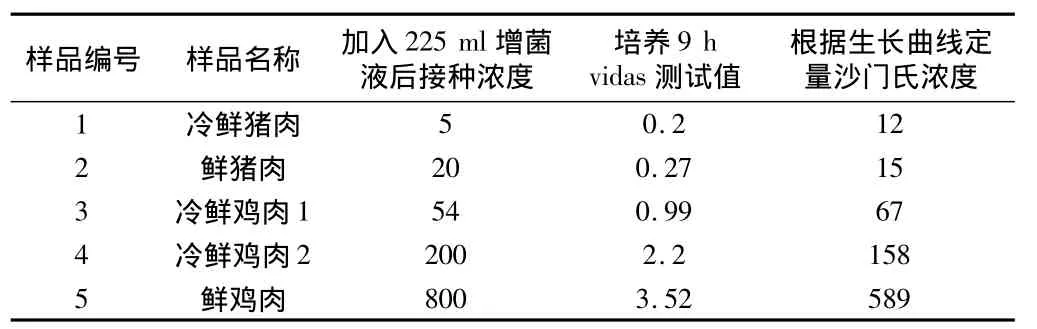
表2 加入系列浓度沙门氏菌的人为污染样品在sc增菌液中增菌9 h后vidas检测
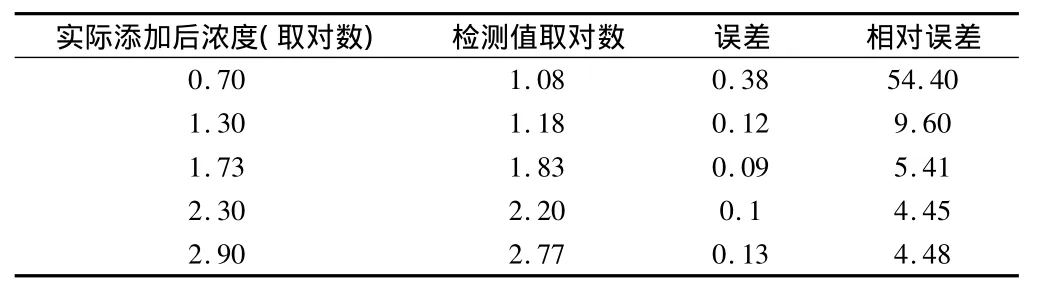
表3 实际添加肠炎沙门氏浓度和检测值比较分析 %
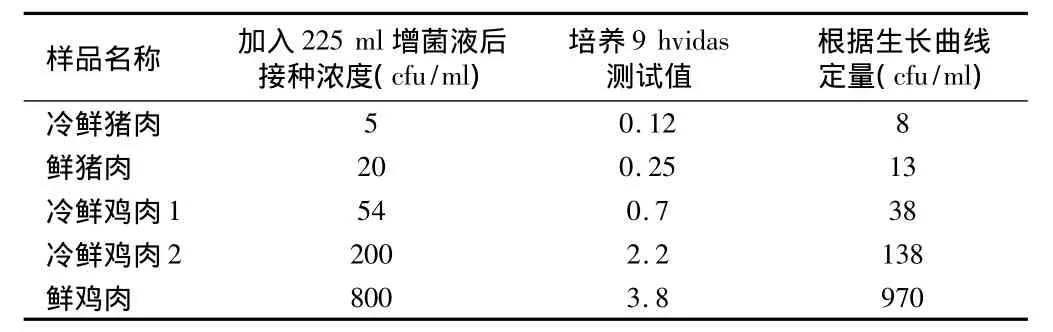
表4 加入系列浓度沙门氏菌的人为污染样品在TTB增菌液中增菌9 h后vidas检测
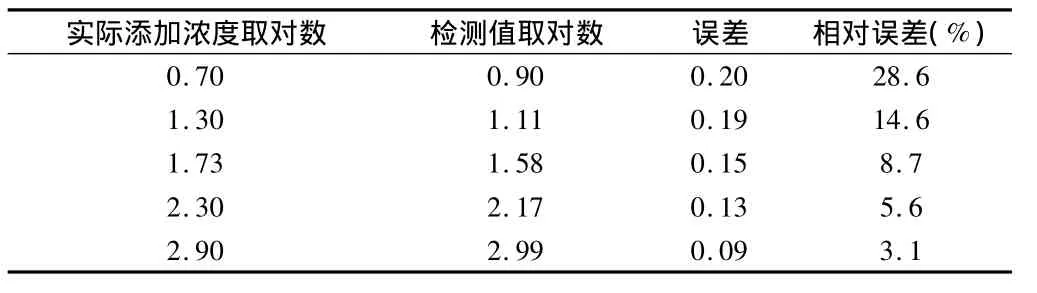
表5 实际添加肠炎沙门氏浓度和检测值比较分析

表6 第1组样品和第2组添加干扰菌的样品的增菌液初始沙门氏菌浓度估算cfu/ml
3 讨论
沙门氏菌是影响食品安全的主要微生物之一。沙门氏菌病是公共卫生学上重要的人畜共患病之一,沙门氏菌引起的食物中毒在各国细菌性食物中毒中常列榜首,现有规定中食品中不得检出沙门氏菌[6,7]。但是目前食品中沙门氏菌的定量检测方法相对较少,且存在诸多的不足。本课题对鲜肉及制品中肠炎沙门氏菌定量检测研究,基于沙门氏菌在选择性增菌液中的生长曲线。选择性增菌液对干扰菌会有一定的抑制作用,同时还能促进沙门氏菌的生长,这样能够更好的对目标菌的分离。通过生长曲线可以看出,无论接种浓度大小,都经历2 h停滞期(适应期)然后进入对数生长期,对数生长期随着接种菌浓度增加而缩短,进过培养9~16 h不同接种浓度沙门氏菌基本上都到达平稳期菌含量在(5~8)×108cfu/ml。在对数生长期不同接种浓度沙门氏菌形成斜率基本相同的平行斜线,如在SC增菌液中对数期生长曲线斜率在0.71~0.73。对数生长期某一定时间不同接种浓度的沙门氏菌增殖达到浓度形成一定斜率的直线,如SC增菌中培养9 h时得出方程y=1.028X-5.202相关系数R2=0.995,根据此方程和此时增菌液沙门氏菌浓度x可以计算出增菌液初始接种浓度。本文中使用vidas对增菌液浓度检测根据检测值与菌浓度数学模型y=0.102x3-0.648x2+1.563x+5.826相关系数R2=0.994(0.2<x<3.8)因为vidas检测底限在106cfu/ml此时检测值接近0.2,此方法在10 h时检测限在2 cfu/ml附近。但是如果使用荧光定量PCR检出限100 cfu/ml,能够定量到1 cfu/100 ml[8-10]。
本方法是对鲜肉类及制品直接使用SC或TTB增菌根据标准SN/T0040-1992出口食品沙门氏菌属(包括亚利桑那菌)计数检验方法。本使用肠炎沙门氏菌为模型进行的研究,如果扩展到其他类型沙门氏菌还需要具体探索其他菌在SC或TTB中的生长模型。同时,本文探索基于ELISA-生长曲线原理来对沙门氏菌定量研究的方法,也可扩展到对其他菌的定量研究。
1 陈玲,张菊梅,杨小鹃,等.南方食品中沙门氏菌污染调查及分型.微生物学报,2013,53:1326-1333.
2 滕要辉,索标,艾志录,等.速冻食品中沙门氏菌和金黄色葡萄球菌多重PCR检测方法的建立与应用.食品科学,2013,34:140-144.
3 颜成英等.肠炎沙门氏菌EMA-PCR检测方法的建立.食品科学,2014,35:90-93.
4 刘景武,付素兰,任天红,等.免疫胶体金法与培养方法检测沙门氏菌检测结果研究.河北医药,2014,36:1021-1022.
5 张海霞,孙桂珍,王慧,等.食源性致病菌沙门氏菌与奇异变形杆菌二重PCR检测方法的建立.泰山医学院学报,2014,36:165-167.
6 杨娟,许美玲,许爱华,等.畜产品中沙门氏菌检验方法的研究进展.家禽科学,2011,33:51-53.
7 赵志伟,莫国东,韦平.畜禽生产中沙门氏菌病的防控意义.广西畜牧兽医,2011,27:75-77.
8 张冲,刘祥,陈计峦.实时荧光定量RT-PCR检测沙门氏菌活菌.食品工业科技,2012,33:91-94.
9 杜雄伟,李叶,冮洁,等.肉制品中沙门氏菌invA基因实时荧光定量PCR检测方法的建立.食品工业科技,2013,34:68-70,80.
10 杨柳,苏明权,马越云,等.荧光定量RT-PCR检测沙门氏菌方法的建立.中国实验诊断学,2011,15:17-20.
