沉默人肺癌A549细胞中期因子基因表达对细胞凋亡的影响
2015-03-05孙常铭王丽萍赵维川朴宗方张秀琴
孙常铭,王丽萍,刘 敏,赵维川,朴宗方,张秀琴
(承德医学院附属医院检验科,河北承德067000)
中期因子(MK)就是与肿瘤发生和发展有密切关系的基因。MK 能调节细胞生长、存活和分化,并参与肿瘤发病过程[1-4]。在许多不同类型的肿瘤中表达增强,包括食管癌、胃癌、结直肠癌、胰腺癌、胆囊癌、肺癌、甲状腺癌、乳腺癌、膀胱癌、子宫癌、卵巢癌、前列腺癌和肝癌、神经细胞瘤、恶性胶质瘤、髓系白血病[5],阳性表达率45%~90%,MK 在正常组织中不表达或低表达[6]。所以,血清MK 水平有望成为一个新的肿瘤标志物[7]。MK 可以促进肿瘤血管的生成,增强肿瘤的耐药性,抑制细胞凋亡。到目前为止,MK 基因在肺癌细胞凋亡抑制中的可能作用尚不清楚。本研究采用转录载体Pgenesil-2.1靶向构建MK 的siRNA 真核表达载体,转染人肺癌A549细胞。采用RT-PCR、Western blot、流式细胞术的方法,观察MK siRNA 对A549 细胞mRNA、蛋白的表达和细胞凋亡的影响。从而为肺癌的治疗提供理论基础,同时为肿瘤的治疗和预后判断提供新的监测指标。
1 材料与方法
1.1 细胞与材料 人肺癌细胞株A549(承德医学院附属医院中心实验室);RT-PCR 试剂盒、T4DNA Ligase、EcoRⅠ内切酶、SacⅠ内切酶、RNAiso试剂(大连宝生物公司)。含有新霉素G418抗性基因和卡那霉素抗性基因的Pgenesil-2RNA 干扰质粒载体,-20 ℃保存(武汉晶赛公司);晶赛通用阴性对照质粒(Pgensil-2-HK)其形成的siRNA 干扰序列为5′-GAC TTC ATA AGG CGC ATGC-3′,此序列不与任何人类基因序列同源;AnnexinⅤ-FITC细胞凋亡检测试剂盒(江苏碧云天公司);caspase-3酶特异性底物DEVD-para-Nitroanilide及特异性抑制剂DEVD-CHO 试剂盒(瑞士Bachem 公司)。
1.2 方法
1.2.1 MK siRNA 干扰质粒的 构建 (1)siRNA 的设计:根据GeneBank MK 基因序列(NM001012333),结合MK mRNA的二级结构,设计了一条特异性的针对MK 基因389~407bp的19nt的siRNA,序列为5′-GTA CAA GTT TGA GAA CTG G-3′。BLAST 分析排除其同源序列。(2)合成编码siRNA 的DNA 序列:结构CACC +Sense+Loop+Antisense+终止信号+SacⅠ,MK-2.1-A:5′-CAC CGT ACA AGT TTG AGA ACT GGT TCA AGA CGC CAG TTC TCA AAC TTG TAC TTT TTT G-3′;MK-2.1-B:5′-AGC TCA AAA AAG TACA AGT TTG AGA ACT GGC GTC TTG AAC CAG TTC TCA AAC TTG TAC-3′。均由武汉晶赛公司合成。
1.2.2 细胞培养及转染 A549细胞株在10%胎牛血清RPMI 1640培养基,37 ℃,5%CO2,饱和湿度的条件下培养。以下实验均取对数生长期细胞。选择对数生长期的细胞在6孔板中接种1.0×106个/孔A549细胞,培养24h,待细胞密度为80%~90%左右,用于第2 天转染。细胞分组,(1)转染MK siRNA 的实验组:10%胎牛血清RPMI 1640中含有MK siRNA 干扰质粒,400μg/mL的G418浓度持续筛选2~3周,其间每2~3天换1次含G418的培养液,同时转入培养瓶中扩大阳性克隆;(2)阴性对照组:转染阴性对照质粒;(3)空白对照组:未转染的A549细胞。
1.2.3 RT-PCR 检 测MK mRNA 的表达水平MK上游引物:5′-GCT ACA ATG CTC AGT GCC AGG A-3′;MK下游引物:5′-AAG GCA CTG GTG GGT CAC ATC-3′。以GAPDH 基因为参照基因,GAPDH上游引物:5′-ACCACAGTCCATGCCATCAC-3′;下游引物:5′-TCC ACC ACC CTG TTG CTG TA-3′。
1.2.4 MK 蛋白表达水平检测 分别收获实验组、阴性对照组和空白对照组细胞,离心收集细胞,PBS洗涤,弃上清液,重新悬浮细胞,加入4×蛋白提取液,蛋白定量后,以β-actin作为内参,蛋白免疫印迹法(Western blot)检测。
1.2.5 MK siRNA 转染对A549细胞凋亡的影响 流式细胞仪进行细胞凋亡检测(AnnexinⅤ-FITC和PI双染法),分别检测3组细胞的早期凋亡情况。
1.2.6 caspase-3检测 在酶标仪上分别测定405nm 时各细胞的吸光度(OD),每组细胞重复测定3次。
1.3 统计学处理 采用SPSS14.0软件进行统计分析,计量资料采用±s表示,组间比较行单因素方差分析。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR 检测3组细胞中MK mRNA 的表达水平 结果以MK 平均光密度值/GAPDH 平均光密度值表示。实验组(0.05±0.03)分别与阴性对照组(0.29±0.01)和空白对照组(0.30±0.01)比较,差异有统计学意义(P<0.05)。而阴性对照组与空白对照组差异无统计学意义(P>0.05)。实验组MK的mRNA 表达相对于空白对照组下降了83.3%。
2.2 Western blot检测3组细胞的MK 蛋白表达水平 空白对照组(0.28±0.01)与阴性对照组(0.27±0.01)MK 蛋白表达水平差异无统计学意义(P>0.05)。实验组(0.03±0.01)分别与阴性对照组和空白对照组比较差异有统计学意义(P<0.05)。实验组MK 蛋白的表达是空白对照组的0.107倍。即实验组的MK 蛋白表达相对于空白对照组下降了89.3%。见图1。
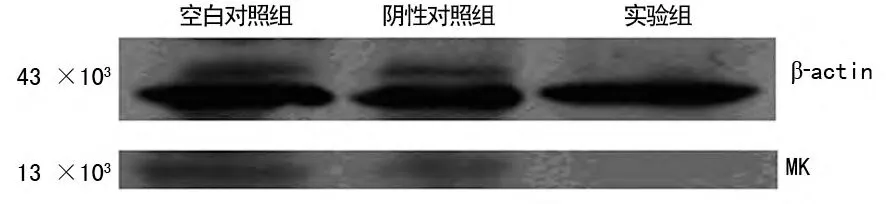
图1 3组细胞的蛋白表达结果
2.3 流式细胞仪进行细胞凋亡检测(AnnexinⅤ-FITC和PI双染法) 如图2显示,在双变量流式细胞仪的散点图上,正常的活细胞位于左下象限,早期凋亡细胞位于右下象限,而坏死细胞和晚期凋亡细胞位于右上象限。实验组A549细胞凋亡比阴性细胞早期凋亡高15.5倍。比空白组细胞早期凋亡高9.34倍。实验组出现了自发凋亡现象,具有较高的早期凋亡率。

图2 3组细胞细胞凋亡水平的变化
2.4 caspase-3活性检测 实验组(0.308±0.008)caspase-3活性明显高于阴性对照组(0.054±0.002)和空白对照组(0.055±0.001),而阴性对照组和空白对照组的caspase-3活性差异无统计学意义(P=0.196)。
3 讨 论
肺癌细胞的凋亡抑制可以使肿瘤细胞对机体产生较大的影响,使肿瘤在体内大量聚集,引起肿瘤患者出现各类相关临床症状和临床表现。因此从分子水平探讨肺癌细胞的凋亡,对肺癌的治疗有着非常重要的意义。
在肿瘤的各种治疗方法中,以RNAi为主要技术手段的基因治疗已经得到广泛的关注。RNAi是近年来发现的一种调节mRNA 的生物学技术,能够使基因的mRNA 被相应的双链RNA 分子敲除,达到基因沉默的目的,其效果要强于正义和反义RNA[8]。RNAi最主要的功能在于可以调节和关闭基因的表达,进而调控细胞的各种高级生命活动。这种现象属于转录后的基因沉默机制。而siRNA 是指RNAi过程中在细胞内产生的长21~25个核苷酸的小双链RNA 分子,是RNAi作用机制的重要中间效应分子。目前已经有人工合成的siRNA,具有明显的敲除相应基因mRNA 的效果[8]。
本研究中构建了siRNA 真核表达载体,其转录产物可在体内形成一个9个碱基组成的茎环分离的具有反向重复序列的发夹样RNA(shRNA),此shRNA 被真核细胞内的核酸酶切割成siRNA,进而降解目的基因mRNA 的表达。这种方法克服了人工合成的siRNA 成本高、需要直接操作RNA 以及siRNA 在体内作用时间短等缺点[9]。本研究针对MK 基因序列,设计合成了siRNA 通过转染技术,将MK siRNA 转染入人A549细胞中,分别采用了RT-PCR 和Western blot法检测MK mRNA 和蛋白的表达。发现转染人MK siRNA 的细胞MK mRNA 和蛋白表达水平明显下降,说明转染成功。
接着,本研究观察了MK siRNA 转染对A549细胞凋亡的影响。MK 基因的表达与多种肿瘤细胞凋亡呈正相关,MK 表达上升或下降后细胞凋亡随之增强或减弱[10-11]。通过流式细胞仪检测3 组细胞的细胞凋亡情况,可以清楚地看出,转染MK siRNA 的A549 细胞凋亡率明显增加,提示MK 基因在A549细胞中对细胞凋亡有着重要的作用。实验组细胞caspase-3活性明显高于阴性对照组和空白对照组,提示中期因子可能参与抑制细胞caspase-3活性来抑制A549细胞的凋亡。结果显示:MK 基因表达的下调可以增加A549肿瘤细胞的早期凋亡,为肺癌的治疗提供实验基础。
由于MK 在基因水平和蛋白水平表达的下调,可以预见其在血浆中的水平也会相应降低,所以MK 可以作为一个新的肿瘤标志物应用于临床诊断和预后判断。
[1] Wilson JF.Liver cancer on the rise[J].Ann Intern Med,2009,142:1029-1032.
[2] 张曙光,张林.Midkine基因在肿瘤治疗中的研究进展[J].现代肿瘤医学,2011,19(8):1681-1682.
[3] Ye C,Qi M,Fan QW,et al.Expression of midkine in the early stage of carcinogenesis in human colorectal cancer[J].Br J Cancer,1999,79(1):179-184.
[4] Koide N,Hada H,Shinji T,et al.Expression of the midkine gene in human hepatocellular carcinomas[J].Hepatogastroenterology,2000,46(30):3189-3196.
[5] Kato H,Watanabe K,Murari M,et al.Midkine expression in Reed-Sternberg cells of Hodgkin′s disease[J].Leuk Lymphoma,2000,37(3/4):415-424.
[6] 栾兆吉,褚兰艳.中期因子在肺癌中的研究进展[J].国际呼吸杂志,2010,30(4):229-233.
[7] 蓝美锐,陈礼刚,李涛.中期因子与肿瘤的联系[J].吉林医学,2013,34(3):533-534.
[8] Green DW,Roh H,Pippin J,et al.Antisense oligonucle-otides:an evolving technology for the modulation of gene expression in human disease[J].J Am Coll Surg,2000,191(1):93-105.
[9] Kitabwalla M,Ruprecht RM.RNA interference--a new weapon against HIV and beyond[J].N Engl J Med,2002,347(17):1364-1367.
[10] Tong Y,Mentlein R,Buhl R,et al.Overexpression of midkine contributes to anti-apoptotic effects in human meningiomas[J].J Neurochem,2007,100(4):1097-1107.
[11] Takei Y,Kadomatsu K,Goto T,et al.Combinational antitumor effect of siRNA against midkine and paclitaxel on growth of human prostate cancer xenografts[J].Cancer,2006,107(4):864-873.
