GSTP1基因变异与胃黏膜非典型增生的关系
2015-03-05王旭光
王旭光,张 忠,张 珉,王 莹
(沈阳医学院病理教研室,沈阳 110034)
GSTP1基因变异与胃黏膜非典型增生的关系
王旭光※,张忠,张珉,王莹
(沈阳医学院病理教研室,沈阳 110034)
胃黏膜非典型增生(gastric dysplasia,GD)是胃癌的一种重要的癌前病变,但并不是所有的GD都发展为胃癌,如何确定可癌变的GD尤为重要。目前,筛查基因的多态性已成为确定某种疾病高危人群的重要方法之一。关于基因多态性与胃癌关系的报道逐年增多,其中谷胱甘肽硫转移酶类(glutathione S-transferases,GSTs)与胃癌的关系是研究的热点之一[1],特别是GSTP1(GST P 1,GSTP1)基因第5外显子1587对碱基处A→G,导致异亮氨酸-105→缬氨酸,其与乳腺癌、口腔癌、结肠癌、前列腺癌及肺癌等多种肿瘤有关[2-5]。前期的研究已证实,GSTP1第5外显子的多态性与胃癌有关[6]。本研究在此基础上拟检测GSTP1在GD中的变异规律,以期筛选出高危GD患者,并予以干预治疗。
1资料与方法
1.1一般资料选择2008年3月至2012年12月中国医科大学附属第一医院、沈阳奉天医院以及沈阳第四人民医院收治的150例胃部疾病患者为研究对象,其中男83 例、女67例,年龄28~85岁,平均(51±11)岁。其中,经病理确诊的胃癌患者50例(胃癌组),男24例、女26例,年龄48~85岁,平均(52±3)岁。非萎缩性胃炎患者50例(非萎缩性胃炎组),男28例、女22例,年龄28~75岁,平均(50±12)岁。GD患者50例(GD组)男31例、女19例,年龄35~80岁,平均(51±7)岁,依据文献[7]再进一步将GD患者分为低GD组(27 例):男16例、女11例,年龄35~75岁,平均(50±7)岁;高度GD组(23 例):男15例、女8例,年龄40~80岁,平均(52±6)岁。各组患者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会批准,并经患者知情同意,并签署知情同意书。
1.2遗传平衡检测为了检验本组人群 GSTP1基因型频率是否具有群体代表性,对人群的基因型频率进行遗传平衡检测。结果表明,实际值和期望值比较差异无统计学意义(χ2=0.263,P>0.05),说明GSTP1各基因型分布频率已达到Hardy-Werberg遗传平衡,具有群体代表性。
1.3标本采集非萎缩性胃炎组和GD组患者的标本来自于胃镜检查时取得的胃黏膜,然后经95%乙醇或4%醛固定;胃癌组的标本来自于患者手术切除后,标本经4%醛固定。固定后的标本经石蜡包埋,然后制作切片。
1.4试剂和方法采用北京基因公司的试剂盒(GT pureTMFFPE tissue DNA Extraction KIT NO.56404)提取石蜡组织中的DNA。每例标本连续切10~12片,每片厚5 μm,放入1.5 mL离心管中,然后按试剂盒操作说明提取DNA。提取DNA后进行聚合酶链反应 (polymerase chain reaction,PCR)扩增,上游引物5′GTA GTT TGC CCA AGG TCA AG 3′,下游引物5′AGC CAC CTG AGG GGT AAG 3′。扩增条件:95 ℃12 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 60 s 15个循环;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s 25个循环;72 ℃ 5 min,16 ℃保存。
取PCR产物2 μL,加限制性内切酶BsmA I(购于美国NEB公司)2 μL、NET缓冲液4 μL,然后加去离子水配成20 μL 体系,在37 ℃恒温箱中,酶切3 h后,2%琼脂糖凝胶进行电泳,溴化乙锭显色10 min后观察DNA条带。
1.5统计学方法应用SPSS 17.0统计软件对数据进行分析,计数资料以百分比表示,比较采用χ2检验,以比值比(odd ratio,OR)及其95%置信区间(confidence intervals,CI)表示各基因型发生不同疾病的风险。OR值以非条件Logistic回归计算。P<0.05为差异有统计学意义。
2结果
2.1PCR扩增的GSTP1基因片断经BsmA I酶切后的琼脂糖凝胶电泳图谱GSTP1基因经BsmA I酶切后出现3个分子量不同的等位基因片断,分别为329 bp、222 bp以及107/104 bp,见图1。

M 泳道为 DNA marker,1-4、6-8、10、12、14-16、19泳道为A/A纯合子基因型;5、11、13、18泳道为A/G杂合子基因型;17 泳道为G/G纯合子基因型;9泳道为阴性图1 聚合酶链反应扩增的谷胱苷肽硫转移酶P1基因片段经BsmA I酶切后的琼脂糖凝胶电泳图谱
2.2不同胃部疾病患者GSTP1第5外显子基因多态性的分布经性别和年龄校正后,非萎缩性胃炎组与GD组GSTP1患者第5外显子G等位基因频率比较差异有统计学意义(χ2=8.011,P=0.006),OR(95%CI)=2.381(1.271~4.461),非萎缩性胃炎组与胃癌组比较差异有统计学意义(χ2=26.440,P<0.05),OR(95%CI)=3.042(1.631~5.675),见表1。
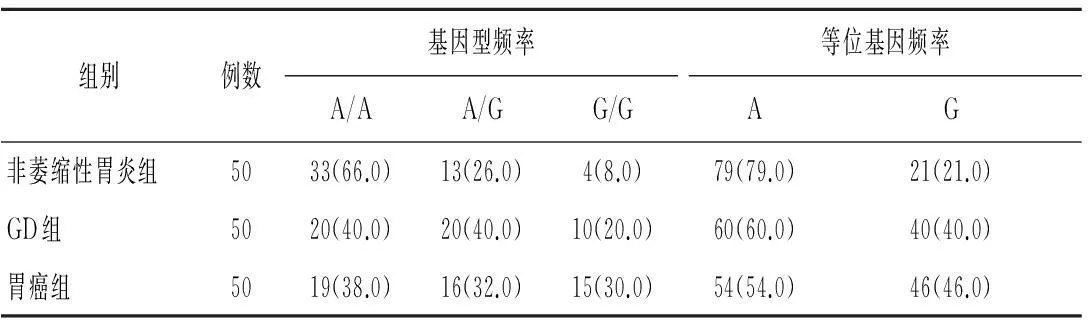
表1 不同胃部疾病患者GSTP1第5外显子
GSTP1:谷胱苷肽硫转移酶P1; GD:胃黏膜非典型增生;等位基因频率=纯合基因型频率×2+杂合基因型频率
2.3第5外显子G等位基因频率在不同级别GD中的分布经性别和年龄校正后,非萎缩性胃炎组患者GSTP1第5外显子G等位基因频率与低度GD组比较差异无统计学意义(χ2=1.388,P=0.232),与高度GD组比较有统计学意义(χ2=22.449,P=0.000),OR(95%CI)=4.104(1.934~8.710),与胃癌组比较差异有统计学意义(χ2=26.440,P=0.000),OR(95%CI)=3.042(1.631~5.675);低度GD组患者GSTP1第5外显子G等位基因频率显著低于高度GD组患者[χ2=5.260,P=0.022,OR(95%CI)=2.591(1.139~5.895)]和胃癌组患者[χ2=3.260,P=0.048,OR(95%CI)=1.100(1.001~1.208)];胃癌组G等位基因频率与高度GD组比较差异无统计学意义(χ2=0.481,P=0.488),见表2。
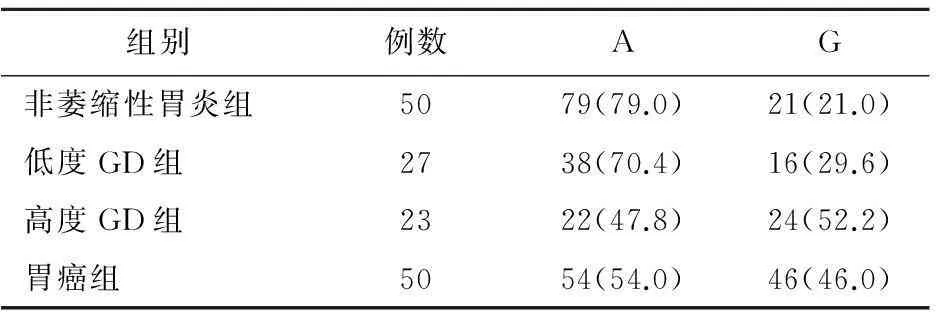
表2 第5外显子G等位基因频率在
GD:胃黏膜非典型增生
3讨论
目前,胃癌仍是全国范围内高发的恶性肿瘤之一,2008年全国疾病监测系统城乡死因监测数据显示,新增胃癌病例464 439例,因胃癌而死亡者352 315例,胃癌发病率(年龄标化率)为17.9/10万,病死率(年龄标化率)为11.8/10万[8]。2011年全国肿瘤登记中心收集41个登记处、覆盖66 138 784例 的报告中指出,在新发恶性肿瘤中,胃癌发病率和病死率占第2位[9]。为降低胃癌的发病率和病死率,人们对胃癌的发生和发展进行了深入研究。研究发现,在胃癌的周围经常发现一些分化异常的腺管,后将此定义为GD,随着研究的深入,发现其与胃癌密切相关,其是一种重要的癌前病变[10]。GD是胃癌发生前的重要一环,但什么情况下可发生胃癌并不明确。胃癌的发生是环境因素与遗传因素共同作用的结果。近年来,人们在研究环境因素致癌的同时,更注重胃癌发生的遗传因素。研究显示,基因多态性与胃癌相关,特别是具有解毒功能的代谢酶基因的多态性与胃癌的关系更为密切[11]。目前关于基因多态性的研究多数停留在胃癌阶段,对胃癌发生前GD阶段的研究甚少。
本研究结果显示,50例胃癌和50例GD患者中存在GSTP1第5外显子的变异,且胃癌组与GD组患者携带G等位基因的频率均显著高于非萎缩性胃炎组(P>0.05),提示携带G等位基因的GD患者与胃癌患者有相似的遗传特性,其能增加胃癌的发生率。推测这类患者可能是由于GSTP1第5外显子突变,导致GSTP1所编码的蛋白质功能发生改变,解毒功能降低,给环境致癌因素提供可乘之机。研究表明,位于第105位点的氨基酸序列对于蛋白质的生物学功能十分重要,该位点氨基酸的替代改变蛋白质的体积和疏水性,从而影响酶的热稳定性[12]。据报道,GSTP1酶-缬氨酸105的热稳定性比GSTP1酶-异亮氨酸105低[13]。该酶功能的改变可进一步导致机体损伤,甚至出现多基因改变,最终导致胃癌的发生。
不同类型的GD与胃癌的关系也不尽相同。目前临床上对GD的组织分级也不统一,主要存在两级和三级两种方案。国内大多数医疗单位仍采用1978年我国胃癌协作组根据WHO分类原则制订的三级分类分级标准,将GD分为轻、中、重3级[10]。1998年4月在意大利的Podova来自西欧、北美及日本的9位胃肠病理学家共同制订了两级分类法并正式发表于《美国外科病理杂志》[14]。WHO试用并修改了这一方案,该方案将GD分为低度GD和高度GD。本研究也将GD分为低度和高度两级,分别检测GSTP1等位基因的分布频率。结果显示,GSTP1等位基因在低度组的分布规律与正常胃黏膜组相似,以A/A基因型为主;在高度GD组,该等位基因分布频率与胃癌组相似。低度GD组与高度GD组比较,A等位基因频率显著降低。从正常胃黏膜→低度GD→高度GD→胃癌,A等位基因频率逐渐降低,G等位基因频率逐渐升高。结果提示,具有G等位基因的高度GD发生胃癌的危险性高。这一结论尚需扩大样本量进行深入研究,同时对于携带G等位基因的GD患者要进一步随访,并给予积极的治疗,有望实现胃癌的一级预防。
参考文献
[1]Bammler TK,Smith CA,Wolf CR.Isolation and characterization of two mouse Pi-class glutathione S-transferase genes[J].Biochem J,1994,298(Pt 2):385-390.
[2]Pandith AA,Lateef A,Shahnawaz S,etal.GSTP1 gene Ile105Val polymorphism causes an elevated risk for bladder carcinogenesis in smokers[J].Asian Pac J Cancer Prev,2013,14(11):6375-6378.
[3]Wei B,Zhou Y,Xu Z,etal.GSTP1 Ile105Val polymorphism and prostate cancer risk:evidence from a meta-analysis[J].PLoS One,2013,8(8):e71640.
[4]Tan Z,Feng M,Luo Y,etal.GSTP1 Ile105Val polymorphism and colorectal cancer risk:an updated analysis[J].Gene,2013,527(1):275-282.
[5]Feng X,Zhou HF,Zheng BS,etal.Association of glutathione S-transferase P1 gene polymorphism with the histological types of lung cancer:a meta-analysis[J].Mol Biol Rep,2013,40(3):2439-2447.
[6]张晔,孙丽萍,陈威,等.中国北方人群谷胱甘肽转硫酶 P1基因多态性及其与胃癌遗传易感性的关系[J].遗传,2007,29(3):293-300.
[7]Rugge M,Correa P,Dixon MF,etal.Gastric dysplasia:the Padova international classification[J].Am J Surg Pathol,2000,24(2):167-176.
[8]卫生部卫生统计信息中心.中国恶性肿瘤危险因素研究[M].北京:中国协和医科大学出版社,2003:30.
[9]赫捷,陈万青.2012年中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:52.
[10]袁媛.胃癌病因及早诊早治[M].北京:科学出版社,2013:94-102.
[11]Wu MS,Chen CJ,Lin MT,etal.Genetic polymorphisms of cytochrome p450 2E1,glutathione S-transferase M1 and T1,and susceptibility to gastric carcinoma in Taiwan[J].Int J Colorectal Dis,2002,17(5):338-343.
[12]McCarver DG,Hines RN.The ontogeny of human drug- metabolizing enzymes:phase Ⅱ conjugation enzymes and regulatory mechanisms[J].J Pharmacol Exp Ther,2002,300(2):361-366.
[13]Watson MA,Stewart RK,Smith GB,etal.Human glutathione S-transferase P1 polymorphisms:relationship to lung tissue enzymeactivity and population frequency distribution[J].Carcinogenesis,1998,19(2):275-280.
[14]张文范,张荫昌,陈峻青.胃癌[M].2版.上海:上海科学技术出版社,2001:58-59.
摘要:目的检测胃黏膜非典型增生(GD)及不同程度GD患者谷胱苷肽硫转移酶P1(GSTP1)第5外显子变异情况,探讨GSTP1变异与胃黏膜GD的关系。方法选择2008年3月至2012年12月中国医科大学附属第一医院、沈阳奉天医院以及沈阳第四人民医院收集的150例胃部疾病患者为研究对象,根据疾病类型分为非萎缩性胃炎组(50例)、GD组(50例)以及胃癌组(50例),采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)法检测GSTP1第5外显子变异情况(rs200139798)。结果胃癌组和GD组GSTP1第5外显子携带G等位基因的频率均高于非萎缩性胃炎组(P<0.05);高度GD组携带G等位基因的频率高于非萎缩性胃炎组和低度GD组(P<0.05),与胃癌组相似(P>0.05)。结论GSTP1第5外显子携带G等位基因的GD患者易发生胃癌,尤其是高度GD患者,临床需予以重视。
关键词:谷胱苷肽硫转移酶P1;变异;非典型增生;等位基因
The Relationship between GSTP1 Genovariation and Gastric DysplasiaWANGXu-guang,ZHANGZhong,ZHANGMin,WANGYing. (DepartmentofPathology,ShenyangMedicalCollege,Shenyang110034,China)
Abstract:ObjectiveTo detect the variation status of GSTP1 of exon 5 of the different degrees of gastric dysplasia(GD) and discuss the relationship between GD and GSTP1 genovariation.MethodsTotal of 150 gastric disease patients from the First Hospital Affiliated to China Medical University,Fengtian Hospital and the Fourth People′s Hospital of Shenyang during Mar. 2008 and Dec. 2012 were selected. The patients were divided into non-atrophic gastritis group(50 cases),gastric dysplasia group (50 cases) and 50 cases of gastric cancer according to the type of diseases.Using polymerase chain reaction restriction fragment length polymorphisms(PCR-RFLP) method to detect the variation of GSTP1(rs200139798).ResultsGastric cancer group and GD group carrying G allele frequency of GSTP1 exon 5 were higher than the non-atrophic gastritis group(P<0.05),high degree GD group carrying G allele frequency was higher than non-atrophic gastritis group and low degree GD group(P<0.05),it was similar to the gastric cancer group(P>0.05).ConclusionThe GD patients carrying G allele frequency of exon 5 GSTP1 were prone to develop stomach cancer,especially the patients with severe GD,and due attention should be paid in clinical.
Key words:Glutathione S transferase P1; Variation; Atypical hyperplasia; Allele
收稿日期:2014-06-21修回日期:2014-08-18编辑:辛欣
doi:10.3969/j.issn.1006-2084.2015.06.049
中图分类号:R730.231
文献标识码:A
文章编号:1006-2084(2015)06-1088-03
