樟子松幼树株高及其逆境生理指标对沙埋的响应特征
2015-03-03赵哈林周瑞莲云建英潘成臣
赵哈林,李 瑾,周瑞莲,曲 浩,云建英,潘成臣
(1 中国科学院寒区旱区环境与工程研究所,兰州 730000;2 鲁东大学生命科学学院,山东烟台 264025)
樟子松幼树株高及其逆境生理指标对沙埋的响应特征
赵哈林1,李瑾1,周瑞莲2,曲浩1,云建英1,潘成臣1
(1 中国科学院寒区旱区环境与工程研究所,兰州 730000;2 鲁东大学生命科学学院,山东烟台 264025)
摘要:以3龄樟子松幼树为材料,2013年在科尔沁沙地研究了不同沙埋深度下其株高、叶片膜透性、渗透调节物质含量及保护酶活性变化,以揭示沙埋条件下樟子松幼树生长及其对逆境的生理响应特征。结果显示:(1)在沙埋深度低于株高以上2 cm时被埋樟子松幼树能够正常生长,其株高和芽长均明显高于非沙埋对照,并以沙埋深度为株高的50%时增长幅度最大;当沙埋深度超过株高2 cm以上时,虽然植株高度和芽长也较埋前有一定增长,但均低于对照,且所有处理植株均未破土,后来全部死亡。(2)所有沙埋处理的叶片可溶性糖含量均显著低于对照,而POD活性显著高于对照,可溶性蛋白质和脯氨酸含量也高于对照。(3)随沙埋深度增加,叶片相对含水量总体呈增加趋势,但大多数处理与对照差异不显著;丙二醛含量基本呈显著下降趋势,可溶性蛋白和脯氨酸含量先增加后下降,而大多数处理的膜透性与对照差异不显著;随着沙埋深度增加,叶片可溶性糖含量显著下降,SOD和POD活性均先增加后下降。(4)相关分析显示,樟子松幼树叶片膜透性变化与MDA含量变化相关性几乎为零,可溶性蛋白与脯氨酸含量呈显著正相关关系,可溶性糖含量与脯氨酸含量呈显著负相关关系。研究表明,沙埋深度低于樟子松株高以上2 cm能够促进其幼树生长;沙埋并没有导致樟子松幼树体内的膜脂过氧化,也没有引起细胞膜的损伤,在受到沙埋胁迫时,樟子松幼树体内SOD、POD以及可溶性蛋白和脯氨酸分别在防止其膜脂过氧化和维持细胞膨压中起到重要作用,而可溶性糖含量在沙埋过程中没有起到渗透调节作用。
关键词:樟子松幼树;沙埋胁迫;膜透性;保护酶;渗透调节
在中国干旱、半干旱风沙区,植物经常遭受沙埋胁迫[1]。由于沙埋能使植物光合面积下降,生产力降低,甚至导致植物死亡,因而成为沙地植物生长及其分布的重要选择压力之一,对于沙地植物的分布、组成、种群大小和生产力高低都有显著影响[2-3]。因此,近年来关于沙埋对于植物影响及其适应或响应研究正日益受到广泛重视,国内外已有不少报道,且研究焦点主要集中于沙埋对植物种子萌发、幼树出土、存活和生长的影响[3-5]等方面。例如,Benvenuti研究了沙埋对Rumexobtyssifolius种子萌发、出土和幼树生长的影响[4],马红媛研究了4种沙埋深度对羊草(Leymuschinensis)种子萌发和幼树生长的影响[5]等。关于沙埋对植物存活、形态和繁殖的影响也有一些报道,如赵文智等[6]研究了砂生槐(Sophoramoorcroftiana)繁殖和生长对沙埋的响应,米志英等[7]研究了沙埋对沙柳形态特征的影响等。另外,还有少量有关沙埋对植物解剖结构和幼树气体交换影响的研究报道[8-9]。上述研究表明,沙埋可以改变光合有效辐射、土壤温度、水分、有机质含量、根际氧含量、微生物活性等环境条件,可以显著影响植物种子萌发、幼树存活、生长和植物形态特征[4-9]。但是,沙埋对植物生长的影响因植物种类和沙埋深度不同而有很大差别,通常沙生植物耐沙埋能力要强于非沙生植物,沙埋时间越长越深对植物影响越大[5]。但迄今为止,有关沙埋对于植物生长过程的生理抑制研究还鲜有报道,对于沙埋胁迫下樟子松幼树的逆境生理响应机制还知之甚少。
樟子松(Pinussylvestrisvar.mongolica)是中国北方沙区目前推广种植面积最大的常绿乔木树种之一[10]。开展沙埋对樟子松幼树株高生长的影响及其逆境生理响应研究,不仅对于揭示樟子松幼树在沙埋下的受损过程及其适应机制具有重要科学意义,而且对于提高沙区樟子松幼树的栽培存活率具有重要实践意义。
1材料和方法
1.1研究区自然概况
研究区位于内蒙古通辽市奈曼旗境内,地处科尔沁沙地腹地(42°55′~42°57′N,120°41′~120°45′E,海拔340~370 m)。该区属温带半干旱大陆性气候,年均降水量356.9 mm,年均蒸发量1 900 mm,年均气温6.5 ℃,≥10 ℃年积温3 190 ℃,无霜期151 d;年平均风速3.4 m·s-1,年平均扬沙天气20~30 d。地貌以高低起伏的沙丘地和平缓草甸或农田交错分布为特征,土壤多为风沙土或沙质草甸土。研究区天然植物群落以中旱生植物为主,主要植物种有沙米(Agriophyllumsquarrosum)、大果虫实(Corispermummarocarpum)、猪毛菜(Salsolacollina)、差巴嘎蒿(Artemisiahalodendron)、小叶锦鸡儿(Caraganamicrophylla)等,樟子松作为人工林常绿树种在当地广泛种植。
1.2试验材料和试验设计
试验地位于中国科学院奈曼沙漠化研究站的水分平衡场内。试验材料为长势良好,高矮基本一致的3龄樟子松幼树,试验前一年秋季将其移栽至直径30 cm、深35 cm的无底塑料花盆中,每盆1株,并通过适时适量浇水和冬季防冻等措施保证其生长良好和安全越冬。
试验设置分别为樟子松幼树株高的25%(A)、50%(B)、75%(C)、100%(D)和超过株高的2(E)、4(F)、6(G)、8(H)、10(I)、15(J)和20 cm(K)等11个沙埋深度处理,另外设置一个非沙埋处理作为对照(CK)。试验采用区组排列,每个处理6次重复,每重复为1棵樟子松幼树。
沙埋试验于2013年春季樟子松顶芽萌长初期进行,沙埋前测定和挑选相同高度植株,使各处理植株高度差异不显著,其植株平均高度为(27.2±1.2) cm。进行沙埋时,按照试验设计下挖不同深度,然后将栽有幼树的无底花盆放入,保持枝条延展保持原状,再用沙子小心埋到预设高度,使埋后沙面与地面平齐。沙子来源于周边流动沙丘上的流沙,埋后不进行灌水。
1.3测定指标及方法
在沙埋后2周(第14天)时将幼树小心挖出,测定株高和顶芽长度。这时,100%沙埋(D处理)和株高以上2 cm沙埋(E处理)的植株顶芽已出土,而沙埋深度超过株高2cm的处理(包括F、G、H、I、J和K处理)的植株顶芽均未出土。被埋叶片颜色变浅,无任何腐烂现象。取样时,用剪刀剪取植株上部5 g叶片,一部分材料即刻带回实验室测定细胞膜透性和叶片相对含水量,另一部分材料迅速用纸包裹置于液氮罐内,用于脯氨酸、可溶性糖、可溶性蛋白质含量以及SOD和POD活性的分析。测定方法:SOD活性为氯化硝基四氮唑蓝光还原法,POD活性为愈创木酚法,丙二醛(MDA)含量为硫代巴比妥酸法,游离脯氨酸含量为茚三酮比色法,可溶性糖含量为蒽酮比色法,膜透性为电导率法,可溶性蛋白含量采用考马斯亮蓝G-250染色法[11]。测定和取样之后,再次小心将植株重新进行沙埋,以后每周观测一次被沙埋叶片变化,至第7周时,其绝大多数被埋叶片腐烂,完全沙埋植株濒临死亡。
1.4数据分析
应用SPSS13软件进行数据的统计分析。采用单因素方差分析(One-Way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异显著性,用Pearson相关系数评价不同因子间的相互关系。
2结果与分析
2.1沙埋对樟子松株高和顶芽长度的影响
图1结果显示,随着沙埋深度增加,樟子松幼树株高表现出先增加后下降的趋势。与CK相比,樟子松株高从A处理到D处理有所增加,其中以B处理增加幅度最大(8.8%)并达到显著水平;从E处理到K处理,株高均较CK有所下降,下降幅度在5.9%~14.7%。同时,樟子松顶芽长度变化与株高变化略有不同,A处理和C处理芽长与CK差异不显著,B处理和D处理分别显著高于CK 30.0%和20.0%,其他处理低于CK 10.0%~60.0%。结果说明一定深度的沙埋处理能够刺激樟子松幼树的生长,沙埋过深则会不同程度抑制其株高生长。
2.2沙埋对樟子松幼树叶片丙二醛含量和膜透性的影响
随着沙埋深度的增加,樟子松幼树叶片丙二醛(MDA)含量呈先增加后下降的变化趋势(图2,A)。其中,与对照(CK)相比,处理A叶片MDA含量显著提高,处理B叶片MDA含量略低于CK,其余处理MDA含量均比CK显著降低,降幅为74.3%~21.8%。同时,随着沙埋深度的增加,樟子松幼树叶片膜透性呈波动式变化(图2,B)。其中,与CK相比,仅C处理和D处理叶片膜透性提高,其他处理均不同程度降低,但只有D处理达到了显著水平。可见,除个别处理外,沙埋并没有造成樟子松幼树叶片MDA含量的积累,也没有造成其膜透性明显增加。
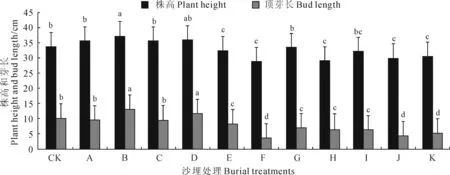
图1 沙埋处理下樟子松株高和顶芽长的变化
2.3沙埋对樟子松幼树叶片相对含水量和渗透调节物质含量的影响
图3,A显示,随着沙埋深度的增加,樟子松幼树叶片相对含水量(RWC)总体呈波动式增加。其中,除E、F和K等3个处理叶片RWC显著高于CK外,其他处理的RWC与CK差异均未达到显著水平。
另外,随着沙埋深度增加,樟子松幼树叶片可溶性蛋白质含量总体呈先增加后下降的变化趋势(图3,B),并以H处理值最高(10.1%),J处理值最低(6.6%),且除A、B、I、E 等4个处理与CK差异不显著外,其他处理的可溶性蛋白质含量均显著高于CK。同时,樟子松幼树脯氨酸含量随着沙埋深度的增加也呈先增加后下降的变化趋势(图3,C),且均不同程度地高于CK(5.03 μg·g-1),其中以F处理脯氨酸含量最高(11.03 μg·g-1),但只有D、E、F和G等4个处理达到显著差异水平。此外,从图3,D可以看出,随着沙埋深度的增加,叶片可溶性糖含量总体呈下降趋势,且所有沙埋处理均显著低于CK处理,而全埋处理的可溶性糖含量又显著低于部分沙埋处理。可见,一定深度的沙埋可以导致樟子松幼树叶片含水量、可溶性蛋白质和脯氨酸含量的增加,可溶性糖含量下降,而超过其深度也会导致其可溶性蛋白质和脯氨酸含量下降。

图2 沙埋处理樟子松叶片丙二醛含量(A)和膜透性(B)的变化

图3 沙埋处理下樟子松叶片相对含水量以及可溶性蛋白、脯氨酸和可溶性糖含量变化

图4 沙埋处理下樟子松叶片SOD和POD活性的变化

指标Index膜透性MP相对含水量RWC超氧化物歧化酶SOD过氧化物酶POD丙二醛MDA可溶性蛋白SP可溶性糖SS脯氨酸Proline膜透性MP1相对含水量RWC-0.5701超氧化物歧化酶SOD0.346*-0.460**1过氧化物酶POD0.359*-0.0610.2881丙二醛MDA0.0000.621**0.625**0.0801可溶性蛋白SP0.2300.1600.1230.217-0.1151可溶性糖SS-0.187-0.496**0.2150.1070.673**-0.363*1脯氨酸Proline0.2690.399*0.1790.358*-0.0530.411*-0.2931
注:*和**分别表示相关系数达到0.05和0.01显著水平。
Note:* and ** meant correlation efficients are significant at 0.05 and 0.01 levels,respectively.
2.4沙埋对樟子松幼树叶片保护酶活性的影响
从图4,A可以看出,随着沙埋深度的增加,樟子松幼树叶片超氧化物歧化酶(SOD)活性呈现先增加后下降的变化趋势。其中,从A处理到H处理的SOD活性均高于CK,I、J和K处理的SOD活性低于CK,但只有A处理和E处理与CK的差异达到显著水平。与SOD变化趋势一样,随着沙埋深度的增加,叶片过氧化物歧化酶(POD)活性也呈现先增加后下降的变化趋势,但变化幅度明显大于SOD,而且所有沙埋处理的POD活性均高于CK(图4,B)。其中,F处理叶片POD活性最大(29.2 μmol·g-1·min-1),是CK的13.5倍;除A、B处理外,其他处理的POD活性与CK差异均达显著水平。以上结果说明,沙埋对于SOD活性变化影响较小,但可导致POD活性大幅度增加。
2.5沙埋樟子松幼树叶片各项生理指标之间的相关关系
从表1可以看出,沙埋樟子松幼树叶片膜透性变化与其SOD和POD活性变化呈显著正相关关系,与MDA等其他因子的变化相关性未达到显著水平;MDA含量与RWC、SOD活性和可溶性糖含量变化呈极显著正相关,而与POD活性、可溶性蛋白和脯氨酸含量的相关性未达到显著水平;SOD与POD呈不显著正相关,可溶性糖与可溶性蛋白、脯氨酸含量呈负相关,脯氨酸含量与可溶性蛋白呈显著正相关。以上结果说明,MDA含量主要受制于RWC和SOD活性变化,膜透性变化主要受制于SOD和POD活性变化,而可溶性糖和脯氨酸含量变化主要受到RWC含量变化影响。
3讨论
本研究表明,当沙埋深度低于株高2 cm时,被埋樟子松幼树能够正常生长,其株高和芽长均明显高于非沙埋对照,并以沙埋深度为株高50%时增长幅度最大,说明适度沙埋可以促进樟子松幼树的高生长,这和有关无芒雀麦(Bromusinermis)、柠条(Caraganakorshinskii)、小叶锦鸡儿(Caraganamicrophylla)等植物的沙埋研究结果[5-8]一致。当沙埋深度超过株高2 cm以上时,虽然植株高度和芽长也较埋前有一定增长,但所有处理植株未破土而出,之后全部死亡。这说明樟子松幼树只能耐受不超过株高2 cm的沙埋,如果超过该深度其生存会受到严重威胁。部分沙埋及轻度全埋之所以能够促进樟子松幼树的高生长和顶芽生长,一方面可能是樟子松幼树在遭受沙埋胁迫时采取了优先将光合产物分配给高生长,以避免被流沙埋没的策略,这种生存策略显然有利于樟子松幼树在风沙环境中生存[3,5];另一方面可能是一定深度的沙埋能够降低其根层的土壤温度,增加根层的土壤含水量,从而有利于其生长[1,8]。但是如果沙埋深度过大,植物幼树因储存的能量不足以顶土而出,其被埋叶片在长期黑暗和缺氧环境下出现死亡和腐烂,最终会导致植株死亡[2,5]。
已有研究表明,在逆境条件下植物会产生过量的活性氧类(ROS),当ROS 积累到一定程度,就会对细胞膜产生伤害,引起植物衰老或死亡[12]。ROS对细胞的伤害主要源于自由基导致膜脂过氧化作用,产生较多的膜脂过氧化产物,使膜的完整性被破坏[13]。MDA作为膜脂过氧化的一种产物,反映着膜质过氧化程度,对植物细胞膜系统结构和功能都具有较显著影响[14]。本研究表明,随着沙埋深度的增加,樟子松幼树叶片MDA含量呈下降趋势,除25%沙埋处理MDA含量高于非沙埋对照外,其他沙埋处理的MDA含量均低于对照。这说明除25%沙埋处理外,其他处理的沙埋并未导致植物MDA积累,反而引起MDA含量降低。而随着沙埋深度增加,除100%沙埋处理膜透性显著高于对照外,其他处理膜透性与对照的差异均未达到显著水平。进一步的相关分析表明,樟子松幼树叶片膜透性变化与MDA含量变化相关性几乎为零。这说明短期沙埋(2周)虽然造成樟子松幼树叶片略有褪色,但并没有导致其体内的膜脂过氧化,也没有引起细胞膜的损伤。这显然与干旱、高温、盐碱等环境胁迫下MDA通常会大量积累,膜透性明显增加的研究结果不同[14-15]。分析其原因,一方面可能是沙埋并不造成植物的水分胁迫,植物叶片相对含水量随沙埋深度增加不但没有下降,反而略有增加就证实了这一点,而干旱、高温和盐碱等会对植物造成严重的水分胁迫[13-15];二是已有研究表明,沙埋会对植物造成黑暗、缺氧、低温环境,其中黑暗可抑制植物光合作用的光反应,降低氧自由基的产生,缺氧可抑制细胞呼吸作用,也可降低氧自由基产生速率,低温可降低了细胞代谢强度,这些均能导致沙埋叶片积累的氧自由基量减少和膜脂过氧化作用降低,从而保障膜透性的完整性[1,16]。
膨压对细胞生长具有关键性的作用,而渗透调节最重要的生理功能就是降低细胞渗透压,维持细胞一定的膨压,从而有利于其他生理过程的进行[17]。不同植物对逆境的反应不同,因而不同植物细胞内累积的渗透调节物质也不同。其中,可溶性糖和脯氨酸是大多数植物体内最重要的渗透调节物质[18]。另外,可溶性糖还可为植物生长提供能量,脯氨酸还具有保护各种酶活性和膜结构不被NaCl破坏,并维持完整水合范围的作用[19-20]。已有研究表明,在干旱、高温、盐碱胁迫下,通常植物体内可溶性糖含量增加,脯氨酸大量积累[17-20]。本研究表明,随着沙埋深度的增加,樟子松幼树叶片可溶性糖含量趋于下降,所有沙埋处理的可溶性糖含量均显著低于对照;其可溶性蛋白质和脯氨酸含量则先增加后下降,其中25%~75%沙埋处理和株高以上10~20 cm处理与CK差异不显著,而从100%沙埋到株高以上6~8 cm沙埋处理显著高于对照;相关分析表明,脯氨酸含量与可溶性蛋白质含量呈显著正相关,可溶性糖含量与脯氨酸含量呈显著负相关。这说明,在受到沙埋胁迫时,樟子松幼树可溶性蛋白质和脯氨酸在维持细胞膨压、降低细胞渗透势方面共同发挥着作用,而可溶性糖含量没有起到渗透调节作用。樟子松幼树可溶性糖含量在沙埋胁迫条件下降低,可能是在黑暗、无氧呼吸情况下植物为了维持基本生存而大量消耗糖分的结果[1,16]。

综上所述,本研究结果表明:(1)沙埋深度低于株高以上2 cm时能够促进樟子松幼树的高生长和顶芽生长,沙埋深度超过株高2 cm以上时其高生长和顶芽生长受到严重抑制;(2)沙埋对樟子松幼树并未产生水分胁迫,其遭遇的主要胁迫可能是黑暗、缺氧和低温;(3)短期沙埋胁迫下,其膜脂过氧化作用不明显,膜透性未见发生显著改变;(4)沙埋胁迫下,可溶性蛋白质和脯氨酸共同发挥着维持细胞膨压降低渗透势的作用,而可溶性糖未起到相应作用;(5)沙埋胁迫下,SOD和POD协同发挥着清除氧自由基维持膜透性的作用,但以POD作用更大。
参考文献:
[1]WANG J(王进),ZHOU R L(周瑞莲),ZHAO H L(赵哈林),etal.growth and physiological adaptation ofMesserschmidiasibiricato sand burial in beach sand[J].ActaEcologicaSinica(生态学报),2012,32(14):4 291-4 299(in Chinese).
[2]刘新民,赵哈林,赵爱芬.科尔沁沙地风沙环境与植被[M].北京:科学出版社,1996.
[3]赵哈林,赵学勇,张铜会,等.沙漠化过程中植物的适应对策和植被的稳定性[M].北京:中国海洋出版社,2004.
[4]BENVENUTI S,MACCHIA M,MIELE S.Light,temperature and burial depth effects onRumexobtussifoliusseed germination and emergence[J].WeedResearch,2001,41:177-186.
[5]MA H Y(马红媛),LIANG ZH W(梁正伟),YAN CH(闫超),etal.Effects of sand-burial depth onLeymuschinensisseedlings emergence and growth[J].ChineseJournalofEcology(生态学杂志),2007,26(12):2 003-2 007(in Chinese).
[6]ZHAO W ZH(赵文智),LIU L M(刘志民).Responses of growth and reproduction ofSophoramoorcroftianato altitude and sand-burying in Tibet[J].ActaEcologicaSinica(生态学报),2002,22(1):134-139(in Chinese).
[7]MI ZH Y(米志英),ZHOU D D(周丹丹),WU Y D(吴亚东).Influence of wind erosion and sand bury on the morphological characteristics ofSalixpsammophila[J].InnerMongoliaForestryScience&Technology(内蒙古林业科技),2005,31(1):9-13(in Chinese).
[8]SHI L,ZHANG Z J,ZHANG C Y.Effects of sand burial on survival,growth,gas exchange and biomass allocation ofUlmuspumilaseedlings in the Hunshandak Sandland,China[J].AnnalsofBotany,2004,94:553-560.
[9]XU B(徐斌),LIU X E(刘杏娥),SUN ZH Y(孙主义),etal.Study on the anatomical properties and variation of sand covered poplar grown in the beaches of Yangtze River[J].ForestResearch(林业科学研究),2005,18(6):738-742(in Chinese).
[10]JIAO SH R(焦树仁).Review of afforestation technology ofPinussylvestrisvar.mongolica[J].ProtectionForestScienceandTechnology(防护林科技),2010,(6):52-54(in Chinese).
[11]张志良,瞿伟菁.植物生理试验指导[M].北京:高等教育出版社,2003.
[12]CAKMAK I,MARSCHNER H.Effect of zinc nutritional status on activities of superoxide radical and hydrogen peroxide scavenging enzymes in bean[J].PlantSoil,1993,156:127-130.
[13]JOUILI H,FERJANI E.Changes in antioxidant and lignifying enzyme activities in sunflower roots(HelianthusannuusL.) stressed with copper excess[J].Comp.Rend.Biol.,2003,326:639-644.
[14]YAN CH SH(阎成仕),LI D Q(李德全),ZHANG J H(张建华).Oxidative damage and antioxidant responses during drought induced winter wheat flag leaf senescence[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2000,20(4):568-576(in Chinese).
[15]VOLKOV V,WANG B,DOMING P J,etal.Thellungiellahalophila,a salt relative ofArabidopsisthaliana,possesses effective mechanisms to discriminate between potassium and sodium[J].PlantCellEnviron,2003,27:1-14.
[16] MAUN M A.Adaptations of plants to burial in coastal sand dunes[J].CanadianJournalofBotany,1998,76:713-738.
[17]QAYYUM A,RAZZAQ A,AHMAD M,etal.Water stress causes differential effects on germination indices,total soluble sugar and proline content in wheat(TriticumaestivumL.) genotypes[J].AfricaJournalBiotechnology,2011,10:14 038-14 045.
[18]CUTLER J M.Influence of water deficits and osmotic adjustment on leaf elongation in rice[J].CropScience,1980,(20):314-318.
[19]WATAD A A,REINHOLD L,LERNER H R.Comparison between a stable NaCl-selectedNicotianacell line and wild type[J].PlantPhysiol.,1983,73:624-629.
[20]HANSON A D,NELSEN C E,EVERSON E H.Evaluation of free proline accumulation as an index of drought resistance using two contrasting barley cultivars[J].CropSci.,1977,17:720-726.
[21]HERNANDEZ J A,ALMANSA M S.Short-term effects of salt stress on antioxidant systems and leaf water relations of pea leaves[J].PhysiologyofPlant,2002,115:251-257.
[22]SU M Y(苏梦云),FAN M Q(范铭庆).Effect of osmotic stress and calcium on membrane-lipid peroxidation and the activity of defense enzymes in fir seedling[J].ForestResearch(林业科学研究),2000,13(4):391-396(in Chinese).
[23]PAGTER M,BRAGATO C,BRIX H.Tolerance and physiological responses ofPhragmitesaustralisto water deficit[J].AquaticBot.,2005,81:285-299.
(编辑:裴阿卫)
Effect of Sand Burial on Height Growth ofPinussylvestrisvar.
mongolicaSaplings and Its Physiological Responses
ZHAO Halin1,LI Jin1,ZHOU Ruilian2,QU Hao1,YUN Jianying1,PAN Chengchen1
(1 Cold and Arid Regions Environment and Engineering Institute,CAS,Lanzhou 730000,China;2 School of Life Sciences,Ludong University,Yantai,Shandong 264025,China)
Abstract:In order to understand effects of sand burial on height growth ofPinussylvestrisvar.mongolicasaplings and its physiological responses,we investigated the changes in plant height,membrane permeability,osmotic adjustment substances contents,protective enzyme activities ofP.sylvestrisvar.mongolicasaplings in different sand burial depths in the Horqin Sand Land of Inner Mongolia in 2013.The results showed that:(1)The sapling could grow normally,plant height and bud length were significant higher when buried depth was lower than 2 cm above saplings height compared to no-buried CK,with a maximum increased magnitude at sand burial depths of 50% of sapling height.When burial depth was higher than 2 cm above sapling height,although the plant height and bud length increased than buried before,they were lower than the CK,and all the buried saplings were not speared out of the earth and then all died.(2)Soluble sugar content was significant lower,POD activity and soluble protein and proline contents were higher at all the burial treatments than that at the CK.(3)With increase of burial depth,RWC(relative water content) tended to increase,but the differences were not significant at all the burial treatments compared to the CK;MDA and soluble sugar contents tended significant decrease,and soluble protein and proline contents and SOD and POD activities increased firstly and decreased later,and membrane permeability had not significant differences at most the burial treatments than that at the CK.(4)The results from correlation analysis showed the correlation between membrane permeability and MDA content was almost zero;proline content had a significant positive correlation with soluble protein content,and soluble sugar content was significantly negatively correlated with proline content.The results suggested that when sand burial depth was lower than 2 cm above sapling height could promote height growth of the saplings,and did not result in membrane lipid peroxidation,also did not cause cell membrane damage.When the sapling subjected sand burial stress,SOD,POD,soluble protein and proline played an important role in preventing the membrane lipid peroxidation and maintaining cell turgor pressure,respectively,while soluble sugar did not play a role in osmotic adjustment.
Key words:Pinussylvestrisvar.mongolicasaplings;sand burial stress;membrane permeability;protective enzymes;osmotic adjustment
中图分类号:Q945.78
文献标志码:A
作者简介:赵哈林(1954-),男,研究员,博士生导师,主要从事荒漠生态学研究。E-mail:resdiv@lzb.ac.cn
基金项目:国家自然科学基金(31270752,30972422)
收稿日期:2014-05-21;修改稿收到日期:2014-12-16
文章编号:1000-4025(2015)01-0146-07
doi:10.7606/j.issn.1000-4025.2015.01.0146
