荔枝古树胚性愈伤组织LcCu/Zn-SOD3基因启动子的克隆及功能验证
2015-03-03练从龙卢秉国赖钟雄林玉玲陈裕坤张梓浩
练从龙,卢秉国,赖钟雄,冯 新,林玉玲,陈裕坤,张梓浩
(福建农林大学 园艺植物生物工程研究所,福州 350002)
荔枝古树胚性愈伤组织LcCu/Zn-SOD3基因启动子的克隆及功能验证
练从龙,卢秉国,赖钟雄*,冯新,林玉玲,陈裕坤,张梓浩
(福建农林大学 园艺植物生物工程研究所,福州 350002)
摘要:以荔枝古树“宋荔”胚性愈伤组织为材料,采用接头染色体步移法,分离获得LcCu/Zn-SOD3启动子片段长度为1 426 bp,命名为ProLcCSD3(GenBank登录号:KF672186.1)。生物信息学分析表明,该启动子含有多个逆境应答元件、激素应答元件、胚乳特异表达元件,且可能受WRKY和MYB等转录因子调控。通过双酶切方法,以ProLcCSD3替换载体pCAMBIA1301上的CaMv35S启动子,构建了重组质粒p1301-proLcCSD3-GUS,并成功转化农杆菌EHA105和GV3101。注射烟草的瞬时表达分析表明,该启动子片段可以驱动下游报告基因表达。转化拟南芥分析表明,该启动子驱动的下游GUS可以在拟南芥的根、茎、叶中表达,且可响应NaCl、PEG-6000、ABA、MeJA和损伤等非生物胁迫。研究表明,荔枝古树LcCu/Zn-SOD3可能参与多种非生物胁迫应答和激素信号转导途径。
关键词:荔枝古树;胚性愈伤组织;Cu/Zn-SOD3;启动子;功能验证
荔枝(LitchichinensisSonn.)属无患子科(Sapindaceae)荔枝属(Litchi),是热带亚热带地区风光的代表性树种,也是重要的经济树种。古树被誉为“活化石”,具有较高的观赏、经济、文化价值,同时也是一座优良种源基因库[1]。‘宋荔’作为荔枝古树的代表性品种,位于福州西禅寺,历经千年,可能是国内最高龄的古荔之一[2]。‘宋荔’凭借顽强的生命力经历4次枯荣到目前仍长势良好,且每年仍可结出沉甸甸的果实,其强大的生命力可算是生命的奇迹[3]。体现了其自身强大的环境适应能力,也代表着荔枝整个生命的长期演化过程。超氧化物歧化酶(SOD)抗性基因作为抗氧化系统的第一道防线,具有防御氧毒性、清除体内氧自由基等作用,在植物抗氧化、抗逆等方面起着关键的作用[4],可能在维持“宋荔”整个生长过程中活性氧的代谢平衡,防止其衰老而历经千年中起重要作用。
启动子作为基因表达的重要调控元件,是转录的调控中心,指导着RNA聚合酶与DNA模板的正确结合,并通过活化RNA聚合酶,募集相应的转录因子形成特异性的转录起始复合体,进而决定转录的方向和效率[5];同时,启动子作为精确调控基因表达的“开关”,直接控制着下游基因的表达,其含有的顺式元件也直接反映了该基因的生物学功能。因此,通过对SOD基因启动子进行研究,分析其调控元件,可为SOD基因的研究奠定一定的基础。许珊珊[6]对‘宋荔’SOD基因的克隆与表达进行了较为全面的研究。因此,本试验在此基础上,采用接头染色体步移法分离获得荔枝古树SOD基因家族LcCu/Zn-SOD3基因的启动子,并通过转化烟草和拟南芥对其功能进行初步验证分析,为进一步深入研究SOD在荔枝古树中的时空表达特性、生物学功能以及抗逆转基因研究奠定基础。
1材料和方法
1.1供试材料
‘宋荔’胚性愈伤组织,采自福州西禅寺‘宋荔’的花药诱导而成,由福建农林大学园艺植物生物工程研究所保存。
1.2方法
1.2.1荔枝基因组DNA的提取及检测采用改良CTAB法[7]提取‘宋荔’基因组DNA,并经1.0%琼脂糖凝胶电泳和紫外分光光度计检测。
1.2.2荔枝LcCu/Zn-SOD3启动子的克隆及测序利用接头染色体步移法对荔枝LcCu/Zn-SOD3启动子进行克隆。参照Genome WalkingTMUniversal kit(Clonetech)试剂盒说明进行操作,步骤如下:首先,对检验合格的荔枝基因组DNA分别进行DraⅠ、EcoRⅤ、PvuⅡ和StuⅠ 4种平末端限制酶酶切并纯化;然后,将荔枝基因组DNA的4种酶切产物分别与试剂盒中的Genome WalkerTMAdaptors连接构建4种Genome Walker文库;最后,以构建好的4种文库为模板,在LcCu/Zn-SOD3基因组序列(KF672186)靠近5端处设计的两条反向互补引物分别与接头引物AP1、AP2引物配对,进行两轮的巢式PCR。PCR体系及two-step cycle程序详见Genome WalkingTMUniversal kit(Clonetech)说明书。其中所用引物有AP1、AP2、LcCSD3-GSP1和LcCSD3-GSP2(表1)。
1.2.3目的片段的回收、TA克隆与测序将PCR扩增产物进行琼脂糖(1.0%)电泳检测,割胶回收目的片段。将目的片段克隆至pMD18-T载体,转化大肠杆菌DH5a并进行培养。最后,PCR菌检后挑取阳性克隆,送华大基因公司测序。
1.2.4荔枝LcCu/Zn-SOD3启动子的序列分析首先,利用Neural Network Promoter Prediction(http://www.fruitfly.org/seq_tools/pro moter.html)在线软件分析该启动子可能的核心启动子区域及转录起始位点;其次,使用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)并结合PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)在线软件分析该启动子序列潜在的顺式作用元件。

表1 启动子克隆及载体构建引物
1.2.5荔枝LcCu/Zn-SOD3启动子瞬时表达载体的构建首先,克隆带酶切位点的目的片段BamHⅠ-proLcCSD3-NcoⅠ。在启动子上游引物引入BamHⅠ(5′-GGATCC-3′)酶切位点,下游引入NcoⅠ(5′-CCATGG-3′)酶切位点,所设计引物见表1的proLcCSD3-F和proLcCSD3-R。以含有该启动子序列的质粒为模板,利用高保真酶KOD-Plus-Neo(Code:KOD041)进行PCR,获得目的片段后割胶回收,测序正确后,将该回收产物命名为BamHⅠ- proLcCSD3-NcoⅠ。
其次,构建p1301-proLcCSD3-GUS重组质粒。利用Thermo公司的FastDigestBamHⅠ和FastDigestNcoⅠ双酶切pCAMBIA1301和回收产物BamHⅠ-proLcCSD3-NcoⅠ,并分别回收pCAMBIA1301的大片段和BamHⅠ-proLcCSD3-NcoⅠ酶切的目的片段。将回收的两条片段进行连接,并转化大肠杆菌,菌液鉴定,提取该重组质粒,并进行双酶切和特异引物PCR的双重鉴定,将构建成功质粒命名为p1301-proLcCSD3-GUS。
最后,将重组质粒p1301-proLcCSD3-GUS转化农杆菌EHA105和GV3101。取5 μL重组质粒于100 μL的农杆菌中,充分混匀,通过冻融法转化农杆菌[8],并进行菌检。
1.2.6荔枝LcCu/Zn-SOD3启动子转化烟草的瞬时表达鉴定以不携带任何载体的空菌株EHA105为阴性对照、CaMV35S启动子驱动GUS基因的pCAMBIA1301的EHA105菌株为阳性对照,和携带目的质粒的阳性EHA105分别通过注射法注入烟草叶片[9],3 d后用打孔器取下烟草叶片的注射部位进行GUS组织化学染色[10]鉴定。
1.2.7荔枝LcCu/Zn-SOD3启动子转化拟南芥的功能鉴定以Columbia野生型拟南芥植株为阴性对照,以CaMV35S启动子驱动GUS基因的pCAMBIA1301的GV3101菌株为阳性对照和携带目的质粒的阳性GV3101分别通过花絮浸染法转化拟南芥[11]。即将待转化的农杆菌GV3101单菌落于含str+kan各100 mg/L的50 mL YEB中,28 ℃、250 r/min振荡培养;离心,收集菌体,重悬于5% 蔗糖悬浮液中,悬浮液浓度调至OD600为0.8左右;选取花蕾期的拟南芥,将花蕾浸泡到重悬液中数秒;培养室下黑暗保湿培养1 d,之后正常光照生长,直至开花收种。
1.2.8T1代转基因拟南芥筛选将存放在4 ℃冰箱的T0代拟南芥种子先采用75%的乙醇处理1 min,后用10%的NaClO处理10 min,期间不断振荡,最后用无菌水漂洗种子数次进行消毒。将消毒后的种子平铺在含有潮霉素的MS固体培养基上,4 ℃春化2 d后移至培养箱中正常光照萌发。待长出2片真叶后,将植株移至营养土中正常光照生长。
1.2.9转基因拟南芥GUS组织化学染色分析和DNA水平检测选取部分经潮霉素筛选的转化植株,于GUS 染色液中过夜染色后,加入75% 乙醇70 ℃水浴脱色至无色后,观察拍照[10]。之后,每种转基因株系分别随机选取经GUS染色验证成功的8株植株,进行DNA水平的鉴定,即提取植物总DNA,采用相应启动子的载体构建引物进行目的片段的PCR验证。
1.2.10转基因拟南芥不同株系胁迫处理选取经GUS染色和DNA水平鉴定转化成功的转ProLcCSD3拟南芥株系,待其莲座叶片完全展开而还未抽薹时,分别进行200 mmol/L NaCl、15% PEG-6000模拟干旱、100 μmol/L ABA、50 μmol/L MeJA和针刺叶片的损伤处理,分别在处理后的0、6和24 h取样,同一单株的取样根据拟南芥生长特点取大小、长势相同的靠基部相对较大的叶片。其中NaCl和模拟干旱处理采用浇灌法,即在营养钵上分别注入等体积配置好的溶液;ABA和 MeJA处理采用叶片喷施,即在处理的叶面上均匀的喷洒配置好的液体,并以水喷洒处理为对照,覆盖保鲜膜;损伤处理采用针刺造成叶片上等量的多个小孔伤害。最后,将采取的样本进行GUS荧光定量活性分析[12]。
2结果与分析
2.1荔枝LcCu/Zn-SOD3启动子的克隆
启动子克隆结果表明,从限制性内切酶EcoRⅤ和StuⅠ酶切的文库中,分别获得长度约1 100 bp和1 500 bp的扩增条带(图1)。测序所得实际长度分别为1 062 bp和1 491 bp,DNAMEN软件比对分析表明其为同一条序列。取1 491 bp长片段,经拼接和NCBI Blast比对显示所得序列即为LcCu/Zn-SOD3的启动子序列,命名为ProLcCSD3(GenBank登入号:KF672186)。因此,获得LcCu/Zn-SOD3启动子长度为1 426 bp。
2.2荔枝LcCu/Zn-SOD3基因启动子的序列结构分析
Neural Network Promoter Prediction预测表明,该启动子可能存在的核心启动子区域有3处,分值分别为0.88、0.85和0.80,分别位于第-782~-733 bp、-418~-369 bp和-93~-44 bp之间(将起始密码子ATG中的A定义为位+1),而可能的转录起始位点为T和A。PlantCARE顺式元件分析表明(图2),该序列存在大量的调控元件,其中核心元件TATA-Box和CAAT-Box最为丰富,此外,还存在多个光响应元件Box 4、Box I、I-box、Sp1 和3-AF1 binding site;激素应答元件CE3、GARE-motif和TCA-element;胚乳表达响应元件Skn-1_motif和GCN4_motif;环境胁迫中的厌氧诱导响应元件ARE和GC-motif、热压响应元件HSE、防御与胁迫响应元件TC-rich repeat、干旱诱导响应元件MBS和昼夜节律元件circadian;以及一些功能未知的相关元件。其中MBS元件为干旱诱导下的MYB结合位点。此外,PLACE软件分析表明该启动子还存在WBOX和WRKY71OS元件。

图1 荔枝LcCu/Zn-SOD3基因启动子
2.3荔枝LcCu/Zn-SOD3基因启动子载体构建
重组质粒双酶切和目的序列的PCR双重鉴定分析(图3)表明,所切下的小片段及特异引物PCR所得条带与目地启动子长度一致,说明p1301-pro-LcCSD3-GUS重组质粒构建成功。重组质粒p1301-proLcCSD3-GUS转化农杆菌EHA105和GV3101的PCR检测均得到与该启动子大小一致的条带,说明p1301-proLcCSD3-GUS重组质粒已分别成功地转化农杆菌EHA105和GV3101,可用于后续试验。

图2 PlantCARE预测LcCu/Zn-SOD3

图3 p1301-proLcCSD3-GUS载体构建凝胶成像图
2.4荔枝LcCu/Zn-SOD3启动子转化烟草的功能鉴定
GUS组织化学染色如图4所示,阴性对照的叶片未能染色,而注射目的启动子ProLcCSD3和阳性对照的CaMv35S驱动GUS的叶片均染成蓝色,但ProLcCSD3驱动下的染色程度不及CaMv35S启动子。该结果表明ProLcCSD3启动子具有驱动下游GUS基因表达能力,即具有启动子活性,但其活性不及CaMv35S启动子。
2.5荔枝LcCu/Zn-SOD3启动子转化拟南芥T1代筛选及鉴定
潮霉素筛选结果表明:转化成功的拟南芥小苗根系生长良好且植株长势相对较强。拟南芥小苗GUS组织化学染色分析(图5)显示,ProLcCSD3驱动的GUS在转基因拟南芥的根、茎和叶中均有表达。进一步DNA水平上的PCR鉴定结果(图6)表明,随机选取的8株转基因拟南芥株系均为阳性植株。
2.6荔枝LcCu/Zn-SOD3启动子响应非生物胁迫分析
转基因拟南芥植株在不同非生物胁迫处理下的
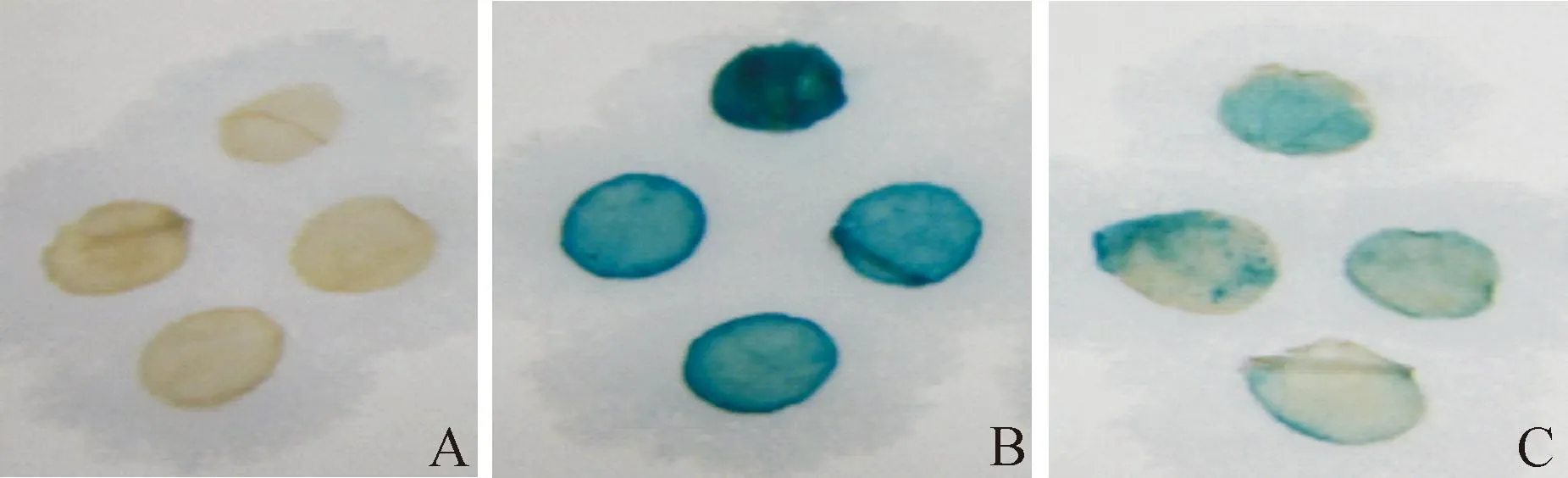
图4 组织化学染色法检测GUS酶活性
GUS荧光活性变化分析如图7。首先,从图中可看出在水处理下,其GUS活性变化不显著,因此,可排除ABA和MeJA处理时水成分的影响。分析转ProLcCSD3株系在各非生物胁迫下GUS活性变化,表明LcCu/Zn-SOD3启动子可响应NaCl、PEG-6000、ABA、MeJA和损伤等非生物胁迫。其中在NaCl、PEG-6000和ABA处理6 h时其GUS活性即显著升高,可达到未处理的1.7~3.2倍,而在24h时均又下降;MeJA和损伤胁迫处理6 h时其活性变化不明显,而在处理24 h时其GUS活性显著升高,约为未处理的2~3倍,且两者的表达模式相近。

图6 转基因拟南芥株系DNA水平验证

图7 转基因拟南芥不同胁迫处理下GUS活性分析

图5 转基因拟南芥植株的GUS组织化学染色

图8 转基因拟南芥不同株系GUS活性差异分析
此外,进一步分析(图8)发现,不同的转基因株系叶片中的GUS活性差异较大,表明在转ProLcCSD3的拟南芥不同株系中,其ProLcCSD3驱动下游GUS的活性存在差异,这可能是该启动子插入拟南芥基因组中的位置不同所致。
3讨论
3.1荔枝古树胚性愈伤组织LcCu/Zn-SOD3参与环境胁迫的调控
荔枝胚性愈伤组织LcCu/Zn-SOD3启动子的转录活性受不同环境因素的诱导。顺式元件预测分析表明该启动子含有光、热压、厌氧、防御与胁迫、干旱和昼夜节律等响应元件,说明该启动子可能响应光、热、厌氧、干旱和昼夜等的诱导。本研究对转LcCu/Zn-SOD3启动子的拟南芥植株进行NaCl、PEG-6000和损伤胁迫的结果验证了该启动子对盐、干旱和损伤逆境下的响应。这与以往NaCl、干旱等逆境胁迫均诱导Cu/Zn-SOD基因表达的研究相符[13-14]。因此,该研究表明LcCu/Zn-SOD3启动子在逆境胁迫下,可通过响应相应的逆境顺式元件调控其下游基因的表达,从而调整植株对逆境的耐受能力。
3.2荔枝古树胚性愈伤组织LcCu/Zn-SOD3参与激素胁迫调控
荔枝胚性愈伤组织LcCu/Zn-SOD3启动子响应外源激素胁迫。PlantCARE顺式元件分析表明,该启动子含有参与ABA、赤霉素和水杨酸应答元件。表明该启动子在上述激素信号转导中可能发挥了一定作用。Mundy等[15]指出一些基因的表达可能是外源激素直接作为反式作用因子与这些调控元件结合来调控的。ABA[16]、赤霉素[17]和水杨酸[18]等均在植物的抗旱、抗盐、抗低温等逆境方面起到一定调控作用。其中,茉莉酸甲酯作为一种挥发性化合物,可以从植物的气孔进入植物体内,在细胞质中被酯酶水解为茉莉酸,实现长距离的信号传导和植物间的交流,诱导邻近植物产生诱导防御反应[19],并可以产生与机械损伤和昆虫取食相似的效果[20]。同样,在本研究对转LcCu/Zn-SOD3启动子的拟南芥植株进行ABA和MeJA胁迫的结果验证了该启动子对ABA和MeJA激素的响应。因此,该研究也表明该启动子在外源激素胁迫下,可通过响应相应的激素顺式元件调控LcCu/Zn-SOD3基因的表达。
综上,本研究主要通过对LcCu/Zn-SOD3启动子进行克隆和功能分析,即在启动子研究的水平初步鉴定了LcCu/Zn-SOD3基因功能,为进一步对该基因的转基因抗逆性研究奠定一定的基础。此外,MBS、WBOX和WRKY71OS等顺式元件的存在,暗示荔枝胚性愈伤组织LcCu/Zn-SOD3基因的调控可能还受MYB和WRKY转录因子的调控。其中,MYB转录因子作为植物转录因子中最大的家族之一,参与植物对非生物胁迫的响应[21],尤其在干旱胁迫下,大部分MYB转录因子均与ABA相关,且MYB转录因子对ABA的调控存在诱导型、介导型和依赖型三种方式[22]。本试验所得的启动子中,也正含有一个干旱诱导的MBS元件和ABA响应的CE3元件,那么该两个元件是否也协同作用以及作用的方式有待进一步研究。WRKY转录因子能够与W-box发生特异性作用,调节启动子中含有W-box元件的基因表达[23],从而参与各种防御反应,调节植物的生长发育等[24]。同时,以往的研究也表明WRKY转录因子还受外源激素如水杨酸[25]、赤霉素[26]、脱落酸[27]和茉莉酸甲酯[28]等胁迫。因此,以上的前人研究成果也为进一步深入研究该启动子的功能及上游调控因子的调控方式等提供新的思路。
参考文献:
[1]LAI ZH X(赖钟雄),LI H L(李焕苓).The evaluation and utilization of the ancient and famous trees genes resources[J].LandGreening(国土绿化),2007,(5):6-7(in Chinese).
[2]HU SH M(胡善美).The ancient litchi trees in the Xichan temple of Fuzhou[J].FujianGeography(福建地理),2000,15(4):35-38(in Chinese).
[3]刘枫.福州市寺庙园林研究[D].福州:福建农林大学,2008.
[4]BUBLIY O,LOESCHCKE V.Correlated responses to selection for stress resistance and longevity in a laboratory population ofDrosophilamelanogaster[J].JournalofEvolutionaryBiology,2005,18(4):789-803.
[5]孙乃恩,孙东旭,朱德煦.分子遗传学[M].南京:南京大学出版社,1999.
[6]许珊珊.福州荔枝古树离体种质保存及抗性基因SOD的克隆与表达[D].福州:福建农林大学,2012.
[7]DING X D(丁晓东),LÜ L X(吕柳新).Study on genomic DNA extraction from recalcitrant litichi[J].ChineseJournalAppliedEnvironmentaiBiology(应用与环境生物学报),2000,6(2):142-145(in Chinese).
[8]WANG X Q(王学全),SHEN X(沈晓),HE Z M(何赞绵),etal.An optimized freeze-thaw for transformation ofAgrobacteriumtumefaciensEHA105 and LBA4404[J].PharmaceuticalBiotechnology(药物生物技术),2011,18(5):382-386(in Chinese).
[9]LI Y(黎茵),ZHANG Y SH(张以顺).Study onAgrobacteriumtumefaciens-mediated transient transformation of tobacco by infiltration[J].ExperimentalTechnologyandManagement(实验技术与管理),2010,27(11):50-52(in Chinese).
[10]JEFFERSON R A,KAVANAGH T A,BEVAN M W.GUS fusions:β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].TheEMBOJournal,1987,6(13):3 901-3 907.
[11]BENT A.Arabidopsisthalianafloral dip transformation method[M].Agrobacterium Protocols.Humana Press,2006:87-104.
[12]JEFFERSON R A.Assaying chimeric genes in plants:theGUSgene fusion system[J].PlantMolecularBiologyReporter,1987,5(4):387-405.
[13]WANG SH(王盛),ZHANG B Q(张保青),HUANG X(黄杏),etal.Molecular cloning of sugarcaneCu/ZnSuperoxidedismutase(Cu/Zn-SOD) and its expression analysis[J].ScientiaAgriculturaSinica(中国农业科学),2013,46(15):3 277-3 284(in Chinese).
[14]ZANG J(臧洁),YU M(余梅),WANG X L(王先磊),etal.Cloning and salt-tolerance analysis of theSalicorniaeuropaeageneCu/Zn-SOD[J].JournalofAgriculturalBiotechnology(农业生物技术学报),2013,21(7):847-854(in Chinese).
[15]MUNDY J,YAMAGUCHI-SHINOZAKI K,CHUA N H.Nuclear proteins bind conserved elements in the abscisic acid-responsive promoter of a rice rab gene[J].ProceedingsoftheNationalAcademyofSciences,1990,87(4):1 406-1 410.
[16]NAMBARA E,KUCHITSU K.Opening a new era of ABA research[J].JournalofPlantResearch,2011,124(4):431-435.
[17]SHADDAD M A K,HM A E S,MOSTSFA D.Role of gibberellic acid(GA3) in improving salt stress tolerance of two wheat cultivars[J].InternationalJournalofPlantPhysiologyandBiochemistry,2013,5(4):50-57.
[18]MENG X J(孟雪娇),DI K(邸昆),DING G H(丁国华).Progress of study on the physiological role of salicylic acid in plant[J].ChineseAgriculturalScienceBulletin(中国农学通报),2010,26(15):207-214(in Chinese).
[19]FARMER E E,RYAN C A.Interplant communication:airborne methyl jasmonate induces synthesis of proteinase inhibitors in plant leaves[J].ProceedingsoftheNationalAcademyofSciences,1990,87(19):7 713-7 716.
[20]XU W(徐伟),YAN SH CH(严善春).The function of jasmonic acid in induced plant defence[J].ActaEcologicaSinica(生态学报),2005,25(08):2 074-2 082(in Chinese).
[21]LIAO Y,ZOU H F,WANG H W,etal.SoybeanGmMYB76,GmMYB92,andGmMYB177 genes confer stress tolerance in transgenicArabidopsisplants[J].CellResearch,2008,18(10):1 047-1 060.
[22]ZUO R(左然),XU M L(徐美玲),CHAI G H(柴国华),etal.Function and regulation mechanism of plant MYB transcription factors[J].ChineseBulletinofLifeSciences(生命科学),2012,24(10):1 133-1 140(in Chinese).
[23]TIAN Y(田云),LU X Y(卢向阳),PENG L SH(彭丽莎),etal.The structure and function of plant WRKY transcription factors[J].Hereditas(遗传),2006,28(12):1 607-1 612(in Chinese).
[24]李玥.3个玉米WRKY转录因子基因的表达模式分析[D].四川成都:四川农业大学,2012.
[25]DONG J,CHEN C,CHEN Z.Expression profiles of theArabidopsisWRKYgene superfamily during plant defense response[J].PlantMolecularBiology,2003,51(1):21-37.
[26]ZHANG Z L,XIE Z,ZOU X,etal.A riceWRKYgene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells[J].PlantPhysiology,2004,134(4):1 500-1 513.
[27]XIE Z,ZHANG Z L,ZOU X,etal.Annotations and functional analyses of the riceWRKYgene superfamily reveal positive and negative regulators of abscisic acid signaling in aleurone cells[J].PlantPhysiology,2005,137(1):176-189.
[28]PENG X X(彭喜旭),HU Y J(胡耀军),etal.Isolation and expression profiles of rice WRKY30 induced by jasmonic acid application and fungal pathogen infection[J].ScientiaAgricultureSinica(中国农业科学),2011,44(12):2 454-2 461(in Chinese).
(编辑:宋亚珍)
Cloning and Functional Analysis ofLcCu/Zn-SOD3 Promoter
from Embryogenic Callus of the Ancient Litchi Tree
LIAN Conglong,LU Bingguo,LAI Zhongxiong*,FENG Xin,
LIN Yuling,CHEN Yukun,ZHANG Zihao
(Institute of Horticultural Biotechnology,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
Abstract:In this experiment,the 1 426 bp promoter fragment ofLcCu/Zn-SOD3 from embryogenic callus of the ancient litchi tree ‘Songli’ which namedProLcCSD3(GenBank:KF672186.1) was cloned by means of adapter chromosome walking method.The bioinformatics analysis showed that ProLcCSD3 contains a number of environmental stress response elements,hormone response elements,endosperm expression elements and also might be regulation by MYB and WRKY transcription factors.A novel plant expression vector p1301-proLcCSD3-GUS was constructed with ProLcCSD3 replace 35S promoter in the pCAMBIA1301 vector by using the double-digested method and then transferred intoAgrobacteriumstrain EHA105 and GV3101.Furthermore,transformation analysis showed that ProLcCSD3 has promoter activity by the infection of tobacco leaves and could drive the downstream reporterGUSgene expression in the roots,stems and leaves byAgrobacterium-mediated transformation ofArabidopsis.And stress treatments showed that ProLcCSD3 could response to some abiotic stresses,such as NaCl,PEG-6000,ABA,MeJA and wounding.Our results demonstrated thatLcCu/Zn-SOD3 might response to abiotic stresses and participate in the signal transduction pathways of hormones in the ancient litchi tree.
Key words:the ancient litchi tree;embryogenic callus;Cu/Zn-SOD3;promoter;functional analysis
中图分类号:Q785;Q786
文献标志码:A
作者简介:练从龙(1988-),男,硕士,主要从事花卉与景观园艺生物技术研究。E-mail:770379183@qq.com*通信作者:赖钟雄,博士,研究员,博士生导师,主要从事园艺植物生物技术与遗传资源。E-mail:laizx01@163.com
基金项目:福建省农业科技平台(2008N2001);国家科技支持计划项目(2007BAD07B01)
收稿日期:2014-08-07;修改稿收到日期:2014-11-09
文章编号:1000-4025(2015)01-0016-07
doi:10.7606/j.issn.1000-4025.2015.01.0016
