棉花GhWRKY44基因的克隆与表达分析
2015-03-03赵曾强韩泽刚李会会李潇玲
赵曾强,韩泽刚,李会会,李潇玲,张 析,张 薇
(石河子大学 农学院,新疆石河子 832000)
棉花GhWRKY44基因的克隆与表达分析
赵曾强,韩泽刚,李会会,李潇玲,张析,张薇*
(石河子大学 农学院,新疆石河子 832000)
摘要:该研究以枯萎病菌诱导棉花根部基因表达谱中筛选得到的WRKY基因片段为探针,通过电子克隆结合RT-PCR技术,从高抗枯萎病品种‘中棉所12’中克隆到1个与抗枯萎病相关的WRKY转录因子基因GhWRKY44(GenBank登录号KJ801807)。序列分析表明,GhWRKY44基因开放阅读框1 197 bp,编码398个氨基酸,含有2个WRKY结构域及C2H2型锌指结构,属于棉花WRKY转录因子家族第Ⅰ类;系统进化分析显示,GhWRKY44基因与拟南芥AtWRKY44亲缘关系最近。实时荧光定量PCR(qRT-PCR)检测该基因表达特性,结果发现枯萎病菌诱导后,GhWRKY44基因在抗病品种中优势表达,随处理后时间的推移,其表达量呈先增加后降低再增加的变化趋势,处理后3 h时GhWRKY44基因表达量达到最大;而在感病品种中,GhWRKY44基因表达水平明显低于抗病品种,对病原菌响应时间也晚于抗病品种,处理后6 h时GhWRKY44基因表达量才达到最大。水杨酸和茉莉酸均能诱导GhWRKY44基因的表达,水杨酸诱导后,GhWRKY44基因表达量迅速增加,且其表达量一直维持在一个较高水平;而茉莉酸诱导后,GhWRKY44基因表达量呈先增加后降低的变化趋势,且其表达水平明显低于水杨酸诱导。研究表明,GhWRKY44基因可能参与了棉花对病原菌和激素胁迫的应答反应。
关键词:棉花;WRKY转录因子;枯萎病菌;基因克隆;表达分析
棉花枯萎病(Fusariumoxysporumf.sp.vasinfectum,Fov)是由尖孢镰刀菌(萎蔫专化型)引起的一种土传性真菌维管束病害,严重影响棉花的产量和品质。培育抗病品种是解决棉花尤其是海岛棉枯萎病危害最为经济有效的途径。陆地棉中含有丰富的枯萎病抗性资源,利用基因工程技术从中挖掘抗病基因,将为海岛棉抗枯萎病分子育种奠定基础。
转录因子是指能够与顺式作用元件相结合,从而调控相关目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。大量研究表明,转录因子在植物与病原菌互作中发挥着重要的调控作用。目前已知与抗病反应有关的转录因子家族主要有bZIP型、AP2/ERF家族、WRKY家族、MYB家族、Homeodomain蛋白、HSF蛋白等[1]。其中WRKY转录因子家族作为植物中最大的转录因子之一,不仅参与植物的生长发育,而且在调控植物生物和非生物胁迫中起重要作用[2-4]。
第一个WRKY转录因子是1994年Ishiguro等[5]从白薯中克隆得到的,此后人们从多种植物中分离出多个WRKY转录因子基因[6-7]。研究发现,该类基因家族都含有一段由60个氨基酸组成的高度保守的WRKY结构域,其N末端含有高度保守的氨基酸序列WRKYGQK,羧基C末端有锌指结构,其结构域可以与靶基因的顺式作用元件W-box((T)TGAC(C/T))发生特异性结合,从而调节基因的表达,参与植物的生长和发育[8]。根据WRKY结构域数量及锌指结构类型,可将WRKY家族分为三类:第Ⅰ类包含2个WRKY结构域,第Ⅱ类含有1个WRKY结构域,第Ⅰ、Ⅱ类锌指结构均为C2H2型(C-X4-5-C-x22-23-H-XI-H),第Ⅲ类含有1个WRKY结构域,锌指结构为C2HC型(C-X7-C-X23-H-X1-C)。近期研究表明,在拟南芥中,几乎所有的第三类WRKY蛋白都与应答生物胁迫反应有关[9]。Tao等[10]研究发现,水稻中过量表达OsWRKY45-1和OsWRKY45-2能提高水稻对稻瘟病的抗性;Dang等[11]研究发现,过量表达CaWRKY40能提高辣椒对青枯雷尔氏菌(R.solanacearum)侵染的抗性,但当该基因沉默后,对青枯雷尔氏菌侵染的抗性减弱。Higashi等[12]在拟南芥中发现,过表达基因AtWRKY41提高了对假单胞菌(Pseudomonassyringae)的抗性,但对软腐病菌(Erwiniacarotovora)的抵抗力下降。目前,大多数与抗病相关的WRKY转录因子的研究主要在模式生物中进行,对棉花的WRKY转录因子了解还十分有限,WRKY转录因子是否在棉花抗枯萎病中发挥作用及其作用的分子机制还不清楚。石河子大学长绒棉育种课题组利用Solexa高通量测序技术建立了枯萎病菌诱导棉花幼苗根部不同时间的基因表达谱,本研究以此为基础,从中筛选并克隆了一个WRKY转录因子基因,利用qPCR技术分析其在枯萎病菌和激素胁迫下的表达模式,为海岛棉抗枯萎病品种的改良提供新的基因资源和理论基础。
1材料和方法
1.1实验材料及其处理
1.1.1实验材料高抗枯萎病陆地棉品种‘中棉所12’和高感枯萎病陆地棉品种‘新陆早7号’由石河子大学棉花所提供。选取硫酸脱绒后籽粒饱满种子,0.1%氯化汞浸泡消毒15 min,无菌水冲洗4~5遍,种植于无菌蛭石,待棉苗长至3 cm左右时将其移入盛有霍格兰营养液的发芽盒(棉苗用带有孔洞的泡沫板漂浮),于25 ℃、光照16 h、黑暗8 h的培养箱中继续培育,每周换2次培养液。
1.1.2枯萎病菌处理枯萎病菌落菌种为枯萎病7号生理小种的强致病力菌系F430,由石河子大学植保系张莉老师提供。接种到已灭菌的查氏培养液中,28 ℃震荡培养4 d,配制成浓度为7×106/mL的孢子悬浮液。待棉苗第一片真叶完全展开时,选取生长一致的棉苗浸泡到孢子悬浮液中45 min后转入霍格兰营养液中[13],在侵染后的0、1、3、6、12、24和48 h分别采集‘中棉所12’和‘新陆早7号’的根部组织,液氮速冻后保存于-80 ℃冰箱。
1.1.3激素处理待棉苗的第一片真叶完全展开时,选取生长一致的棉苗分别浸于含有1 mmol/L乙烯(ET)、50 μmol/L水杨酸(SA)和1 mmol/L茉莉酸(JA)的霍格兰营养液中。处理0、0.5、1、2、4、8、12和24 h后分别取植株的根部组织,液氮速冻后保存于-80 ℃冰箱。
1.2方法
1.2.1GhWRKY44基因克隆用改良的CTAB法[14]提取材料的总RNA。cDNA的合成按照Takara公司生产的first strand cDNA synthesis kits说明书的步骤进行操作。
以表达谱中筛选到的WRKY基因片段为探针,在NCBI中棉花(Gossypiumhirsutum)EST数据库进行Blastn比对,选择下载与之一致性较高的ESTs序列,运用在线拼接软件CAP3(http://pbil.univ-lyon1.fr/cap3.php)进行ESTs序列拼接;以拼接的序列为新探针,继续在棉花EST数据库中进行同源搜索,直到拼接的序列不再延伸为止。通过NCBI网站上ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和Conserved Domain Search(http://www.Ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析开放阅读框和保守域,选取ORF完整且含有WRKY结构域的序列,利用Primer premier 5.0软件设计引物F1(GCTCTAGAATGGATGTGG-ATTGGGATTTGC和R1(CGAGCTCCCGGCGGTG-ACCGTTTGTGGAG)并扩增ORF。以枯萎病菌处理后的根系cDNA为模板,进行PCR扩增,扩增条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测,回收预期大小的目的片段与pMD19-T载体连接,转化DH-5α大肠杆菌感受态,通过质粒PCR与酶切验证,筛选阳性菌株送华大基因进行测序。
1.2.2序列分析利用Inter Pro(http://www.ebi.ac.uk/interpro/)进行蛋白保守域分析;用DNAMAN进行序列比对分析;利用Mega 5.0进行进化分析。利用GOR4(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)进行蛋白二级结构分析;利用ExPaSy ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)进行蛋白亲/疏水性分析;利用SWISS-MODEL(http://swissmodel.expasy.org/)进行WRKY结构域三级结构的同源建模分析;利用ExPaSy ProtParam(http://web.expasy.org/protparam/)进行蛋白理化性质分析。
1.2.3实时荧光定量PCR分析利用Primer premier 5.0软件设计目的基因qRT-PCR引物F2(AGTTCTTTAATGGCGGATTT)和R2(GCTT-AGGCTTTACTTGTTGA),以GhUBQ7(DQ116441)为内参基因,FU(GAAGACCTACACCAAGCCC-AAG)和RU(CGGACTCTACTCAATCCCCACC)为引物,由北京六合华大基因科技有限公司合成。实时荧光定量PCR反应体系及程序参见TOYOBO公司SYBR®Green Realtime PCR Master Mix(QPK-212)说明书,实验设3个重复,采用2-△△Ct法计算基因相对表达量。
2结果与分析
2.1GhWRKY44基因克隆及序列分析
2.1.1GhWRKY44克隆以在线拼接软件CAP3进行ESTs序列的拼接,获得一个ORF完整且含有WRKY结构域的序列,依据这个序列的ORF设计PCR扩增引物,以枯萎病菌处理后的棉花根部cDNA为模板,扩增获得一条长度为1 197 bp序列(图1),测序结果表明,其核苷酸序列与电子克隆序列一致,经Blast比对,该序列编码398个氨基酸,所编码的氨基酸中含有2个典型的WRKY结构域,分别位于第126~182和317~374氨基酸之间,属于WRKY家族Ⅰ类,将该基因命名为GhWRKY44,登录号为KJ801807。
2.1.2序列分析利用生物信息学网站对GhWRKY44基因编码的蛋白质理化性质和结构域分析表明,该基因编码的蛋白分子量为44.24 kD,理论等电点为8.80,为亲水蛋白。蛋白二级结构分析表明,无规则卷曲所占比例为63.57%,是该蛋白二级结构的主要组成元件,而α螺旋和延伸链所占比例分别为16.33%和20.10%。蛋白WRKY结构域的三级结构分析表明,该转录因子的WRKY结构域与AtWRKY4[15]非常相似(图2),推测GhWRKY44基因编码的转录因子可能具有与AtWRKY4相类似的结合特性,即可以与下游基因启动子中的W-box结合,从而实现对下游基因的表达调控。

图1 GhWRKY44基因PCR扩增(A)和酶切验证(B)
2.1.3GhWRKY44基因同源进化分析运用DNAMAN软件对GhWRKY44基因预测的氨基酸序列与Genbank上公布的其他一些物种的WRKY基因(AtWRKY4:NP_172849;GhWRKY116:KF031118;CaWRKY2:ABA56495;GhWRKY18:KF031076;GhWRKY74:KF031105;AtWRKY20:NM_179119;OsWRKY30:HM153428;AtWRKY44:NM_129282.3)的氨基酸序列进行同源性比较,结果(图3)表明,该基因预测的氨基酸序列与上述基因氨基酸序列的保守区主要集中在2个WRKY结构域,且该基因含有预测的核定位信号序列(KRKK),其锌指结构为CX4~5CX22~23HX1H(X为任意氨基酸),与前人研究相符合。利用Mega 5.0软件对GhWRKY44与上述基因进化关系比较,该基因在进化上与拟南芥AtWRKY44的亲缘关系最近(图4)。
2.2GhWRKY44的表达特性
由图5可以看出,枯萎病菌诱导后,GhWRKY44基因的表达量在抗病品种中明显增加,并随处理时间的推移呈现先增加后降低再增加的变化趋势,在处理后3 h表达量达到最大,是处理前的10.93倍,随后逐渐下降,24 h后表达量再次增加;与抗病品种相比,GhWRKY44基因在感病品种中的表达水平明显低于抗病品种,对病原菌响应时间也晚于抗病品种,处理后6 h表达量才达到最大,且只有处理前的2.94倍。由此推测,GhWRKY44基因可能与棉花枯萎病抗性有关。
通过qRT-PCR检测GhWRKY44表达结果(图6)表明,SA和JA均能够诱导GhWRKY44基因的表达。SA处理后,该基因的表达量迅速增加,在处理后0.5 h已增至处理前的13.64倍,随处理后时间的推移,其表达量一直维持在一个较高的水平,24h表达量达到最高,为处理前的26.91倍;JA处理后,该基因的表达量呈现先增加后降低的变化趋势,处理后4 h其表达量达到最高值,但其表达水平明显低于SA处理,7个时间点的平均相对表达量只有SA处理的1/7。ET处理后,GhWRKY44基因的表达量变化不明显。
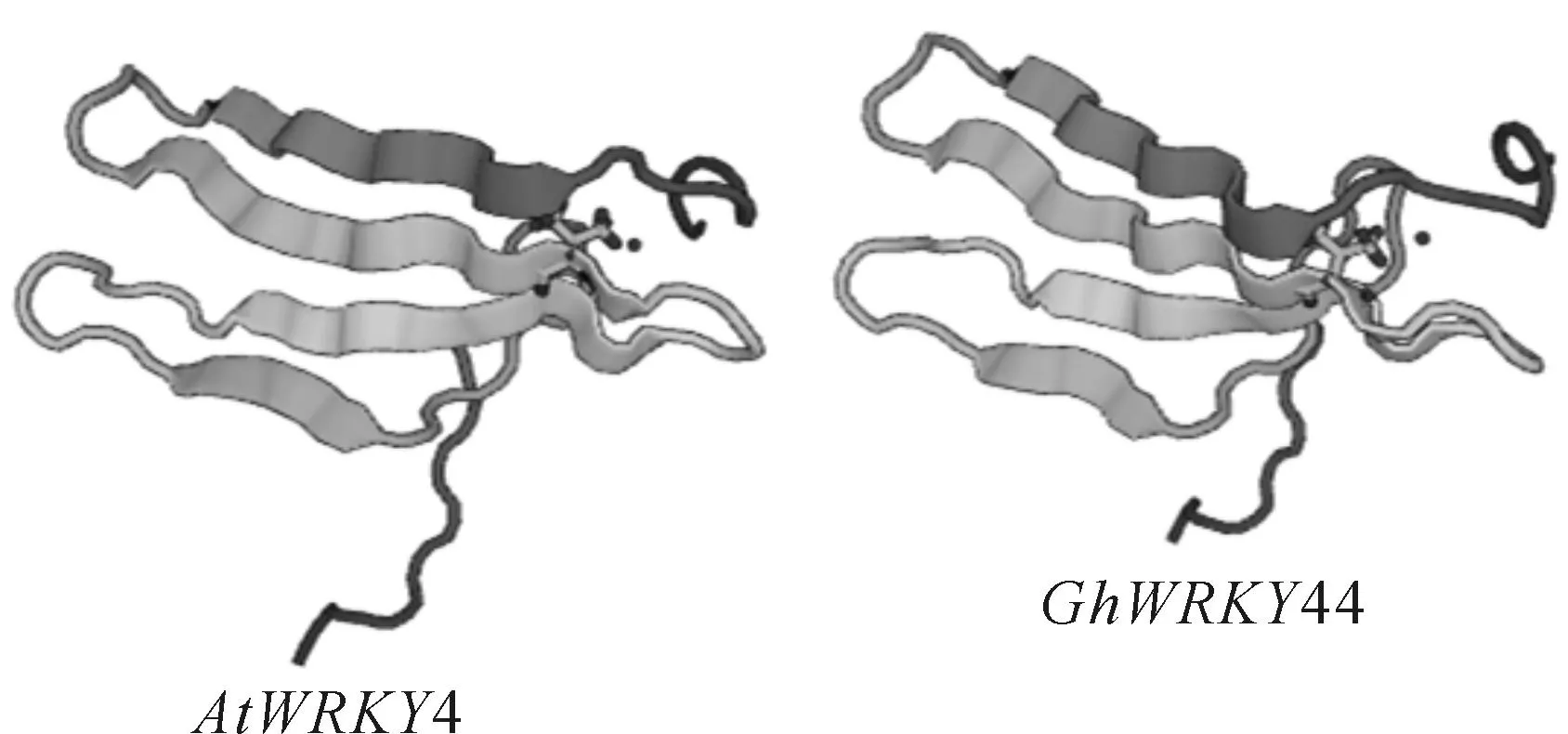
图2 GhWRKY44与AtWRKY4编码蛋白的三级结构分析

图3 GhWRKY44推定的氨基酸序列与其他

图4 GhWRKY44与其他WRKY

图5 中棉所12和新路早7中GhWRKY44基因
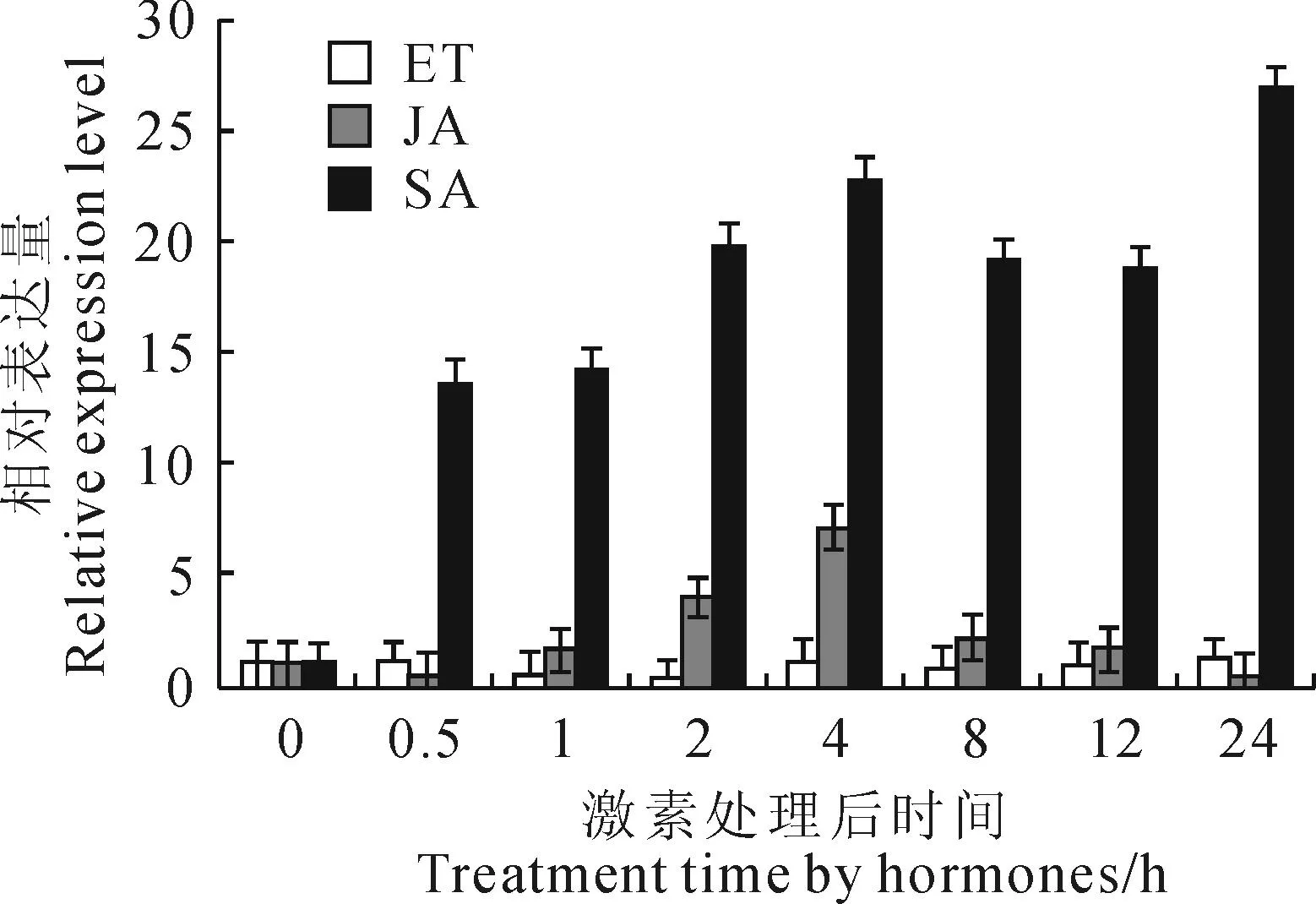
图6 不同激素处理后GhWRKY44基因表达模式
3讨论
WRKY转录因子家族是植物特有超级基因家族,现已发现,拟南芥中有72个WRKY基因[16],水稻中有97个WRKY基因[17]。本研究以枯萎病菌诱导棉花根部基因表达谱中筛选得到WRKY基因片段为探针,通过电子克隆结合RT-PCR技术,从陆地棉中克隆到1个编码WRKY转录因子基因,命名为GhWRKY44;该基因编码的氨基酸序列含有2个WRKY结构域及C2H2型锌指结构,同时存在1个预测的核定位信号序列,保守域和进化树分析证明该基因属于棉花WRKY转录因子I类。
近年来,随着大量WRKY基因被克隆,已证实植物WRKY基因的主要生物学功能之一在于调控植物抗病反应及其信号转导途径的建立[18]。本研究利用qRT-PCR技术分析了枯萎病菌诱导后GhWRKY44基因的表达模式,结果表明在枯萎病菌诱导后,该基因在抗病品种中的表达量显著高于感病品种,其高峰期出现时间也早于感病品种,推测该基因表达量的高低可能在一定程度上影响了植株对枯萎病菌的抗性。Hwang等[19]研究发现,用水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae,Xoo)侵染培养3周的水稻幼苗,利用半定量PCR技术分析表明,OsWRKY6表达量持续增高,在48 h达到最大,超表达OsWRKY6转基因拟南芥植株可以增强对真菌的抗性,同时提高抗性相关基因的转录水平。Yu[20]通过半定量PCR技术对棉花GhWRKY15进行表达特异性分析表明,分别用枯萎病菌(Fusariumoxysporumf.sp.vasinfectum)和立枯丝核菌(Rhizoctoniasolani)处理后,表达量均呈现先增加后降低趋势,但枯萎病菌处理后在3 d表达量最高,立枯丝核菌处理后5 d表达量最高,且超表达GhWRKY15转基因烟草植株可以增强对真菌的抗性。结合本研究结果,GhWRKY44对于病原菌响应时间与上述研究结果不完全一致,一方面可能是由于取样时间差异较大,另一方面可能是不同的WRKY对不同病原菌响应不同造成。
大量研究认为,水杨酸(SA)、茉莉酸(JA)和乙烯(ET)是植物抗病信号转导途径中重要的信号分子[21]。沈怀舜等[22]从水稻中克隆了一个含有2个WRKY结构域的基因OsWRKY30,研究表明该基因受SA、JA和病原菌等多种信号因子的诱导,与植物对逆境的应答密切相关。本研究结果表明,GhWRKY44能被SA和JA诱导,但对ET诱导响应不明显,与JA相比,SA对该基因诱导响应更为强烈,7个时间点的平均相对表达量约为JA处理的7倍,推测该基因主要通过SA信号传导途径调控下游相关基因的表达来参与棉花对枯萎病菌的抗性反应。Shi[23]研究发现,分别用外源激素SA和MeJA处理培养1周的棉花幼苗,其表达量分别在6和12 h达到最高,超表达GhWRKY39-1转基因烟草植株可以增强对细菌和真菌的抗性,在病原菌侵染后,对参与JA途径的PR4和SA途径的PR1c的转录水平有显著提高。在拟南芥中,WRKY70蛋白质参与两条抗性信号转导途径的调控,既通过激活SA介导的抗病信号转导途径,又抑制JA介导的抗病信号转导途径,从而调控拟南芥的抗病反应[21]。WRKY转录因子作为植物转录因子家族之一,对生物和非生物胁迫均能产生相应应答,因此,克隆棉花GhWRKY44基因,并对其表达特性进行分析,将有助于揭示该基因在棉花与病原菌互作中的作用,并为改良棉花抗病性提供新的候选基因。
参考文献:
[1]ZHANG J Y(张计育),QU SH CH(渠慎春),GUO ZH R(郭忠仁),etal.Biology function of bZIP transcription factors in plants[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2011,31(5):1 066-1 075(in Chinese).
[2]YU D,CHEN C,CHEN Z.Evidence for an important role of WRKY DNA binding proteins in the regulation ofNPR1 gene expression[J].ThePlantCellOnline,2001,13(7):1 527-1 540.
[3]HARA K,YAGI M,KUSANO T,etal.Rapid systemic accumulation of transcripts encoding a tobacco WRKY transcription factor upon wounding[J].MolecularandGeneralGeneticsMGG,2000,263(1):30-37.
[4]ROBATZEK S,SOMSSICH I E.Targets ofAtWRKY6 regulation during plant senescence and pathogen defense[J].Genes&Development,2002,16(9):1 139-1 149.
[5]ISHIGURO S,NAKAMURA K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and β-amylase from sweet potato[J].MolecularandGeneralGeneticsMGG,1994,244(6):563-571.
[6]EULGEM T,RUSHTON P J,etal.The WRKY superfamily of plant transcription factors[J].TrendsinPlantScience,2000,5(5):199-206.
[7]WU K L,GUO Z J,etal.The WRKY family of transcription factors in rice andArabidopsisand their origins[J].DNAResearch,2005,12(1):9-26.
[8]YU F,HUAXIA Y,LU W,etal.GhWRKY15,a member of the WRKY transcription factor family identified from cotton (GossypiumhirsutumL.),is involved in disease resistance and plant development[J].BMCPlantBiology,2012,12(1):144.
[9]LI L(李蕾),XIE B Y(谢炳炎),DAI X F(戴小枫),etal.WRKY transcription factors and their roles in plant defense responses[J].MolecularPlantBreeding(分子植物育种),2005,3(3):401-408(in Chinese).
[10]TAO Z,LIU H,QIU D,etal.A pair of allelicWRKYgenes play opposite roles in rice-bacteria interactions[J].PlantPhysiology,2009,151(2):936-948.
[11]DANG F F,WANG Y N,YU L,etal.CaWRKY40,a WRKY protein of pepper,plays an important role in the regulation of tolerance to heat stress and resistance toRalstoniasolanacearuminfection[J].Plant,Cell&Environment,2013,36(4):757-774.
[12]HIGASHI K,ISHIGA Y,INAGAKI Y,etal.Modulation of defense signal transduction by flagellin-induced WRKY41 transcription factor inArabidopsisthaliana[J].MolecularGeneticsandGenomics,2008,279(3):303-312.
[13]PENG SH(彭姗),LÜ X L(吕学莲),GAO F(高峰),etal.Study on a new rapid inoculation method forVerticilliumwilt andFusariumwilt of cotton[J].CottonScience(棉花学报),2008,20(3):174-178(in Chinese).
[14]HU G H(胡根海),YU SH X(喻树迅).Extraction of high-quality total RNA in cotton leaf with improved CTAB method[J].CottonScience(棉花学报),2007,19(1):69-70(in Chinese).
[15]YAMASAKI K,KIGAWA T,INOUE M,etal.Solution structure of anArabidopsisWRKY DNA binding domain[J].ThePlantCellOnline,2005,17(3):944-956.
[16]EULGEM T,RUSHTON P J,etal.The WRKY superfamily of plant transcription factors[J].TrendsinPlantScience,2000,5(5):199-206.
[17]QIU Y,JING S,FU J,etal.Cloning and analysis of expression profile of 13 WRKY genes in rice[J].ChineseScienceBulletin,2004,49(20):2 159-2 168.
[18]ISHIHAMA N,YOSHIOKA H.Post-translational regulation of WRKY transcription factors in plant immunity[J].CurrentOpinioninPlantBiology,2012,15(4):431-437.
[19]HWANG S H,YIE S W,HWANG D J.Heterologous expression ofOsWRKY6 gene inArabidopsisactivates the expression of defense related genes and enhances resistance to pathogens[J].PlantScience,2011,181(3):316-323.
[20]YU F,HUAXIA Y,LU W,etal.GhWRKY15,a member of the WRKY transcription factor family identified from cotton (GossypiumhirsutumL.),is involved in disease resistance and plant development[J].BMCPlantBiology,2012,12(1):144.
[21]LI J,BRADER G,PALVA E T.The WRKY70 transcription factor:a node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense[J].ThePlantCellOnline,2004,16(2):319-331.
[22]沈怀舜.WRKY 家族调控植物抗逆信号途径分子机制的初步研究[D].上海:复旦大学,2007.
[23]SHI W,HAO L,LI J,etal.TheGossypiumhirsutumWRKY geneGhWRKY39-1 promotes pathogen infection defense responses and mediates salt stress tolerance in transgenicNicotianabenthamiana[J].PlantCellReports,2014,33(3):483-498.
(编辑:宋亚珍)
Cloning and Expression Analysis ofGhWRKY44 in Cotton
ZHAO Zengqiang,HAN Zegang,LI Huihui,LI Xiaoling,ZHANG Xi,ZHANG Wei*
(College of Agronomy,Shihezi University,Shihezi,Xinjiang 832000,China)
Abstract:In this study,the WRKY gene fragment from a digital expression profiling of cotton root tissues infected byFusariumoxysporumf.sp.vasinfectum(Fov) was used as a probe,a WRKY transcription factor gene was cloned from the roots of ‘Zhongmiansuo 12’ through theinsilicocloning and RT-PCR,named asGhWRKY44(Genebank:KJ801807).Sequence analysis showed that the ORF ofGhWRKY44 was 1 197 bp,encoding 398 amino acids.GhWRKY44 contained two conserved WRKY domains and one C2H2 zinc finger structure,and belonged to group I of cotton WRKY transcription factor.Phylogenetic analysis showed thatGhWRKY44 closed toAtWRKY44.TheGhWRKY44 expression was detected by Real-time Quantitative PCR(qRT-PCR) and the results showed thatGhWRKY44 gene was predominantly expressed in resistant variety.With the duration of the treatment of Fov,the expression ofGhWRKY44 increased firstly and decreased,then increased again.When the treatment time was over 3 hours,the level ofGhWRKY44 expression reached the maximum in the resistant variety.However,the relative expression ofGhWRKY44 was significantly lower and the response was later in the susceptible variety than that in resistant variety and the level ofGhWRKY44 expression reached the maximum when the treatment time was over 6 hours.Both salicylic acid and jasmonic acid could induce the expression ofGhWRKY44.After the treatment of salicylic acid,the level ofGhWRKY44 expression increased rapidly and maintained at a high level.However,the expression ofGhWRKY44 firstly increased and then decreased when induced by jasmonic acid.Compared with salicylic acid,the induced expression levels ofGhWRKY44 were significantly lower than that of under jasmonic acid.The results demonstrated thatGhWRKY44 may be response to pathogen and hormone stress in cotton.
Key words:cotton;WRKY transcription factors;Fusariumoxysporumf.sp.vasinfectum;gene clone;expression analysis
中图分类号:Q785;Q786
文献标志码:A
作者简介:赵曾强(1985-),男,在读硕士研究生,主要从事棉花分子育种研究。E-mail:tlx4109@126.com*通信作者:张薇,博士,教授,主要从事棉花分子育种研究。E-mail:zhw_agr@shzu.edu.cn
基金项目:国家自然基金(31260358);农业部转基因生物新品种培育重大专项(2011ZX08005-005)
收稿日期:2014-9-15;修改稿收到日期:2014-12-09
文章编号:1000-4025(2015)01-0010-06
doi:10.7606/j.issn.1000-4025.2015.01.0010
