人输卵管内膜干细胞和输卵管间充质干细胞生物学特性的比较研究
2015-03-02王娇娇王蔼明赵勇武晓云
王娇娇,王蔼明,赵勇,武晓云
间充质干细胞(m esenchym al stem cell,MSC)是中胚层在早期发展过程中形成的多能成体干细胞,具有不断的自我更新能力,且在特定的培养条件下不仅可分化为骨细胞、软骨细胞、脂肪细胞、造血细胞、肌肉细胞等,还可跨越胚层界限分化为神经细胞、肝细胞、胰岛细胞等[1]。MSC由于来源广泛、容易分离、能快速扩增,且具有较低的免疫原性和免疫调节能力,目前已成为组织工程学、再生医学和免疫抑制治疗领域重要的种子细胞来源[2-4]。国际间充质及组织干细胞委员会提出了鉴定人MSC的3条最低标准:①塑料黏附性;②特定的细胞表面抗原表达;③多向分化潜能[5]。
目前,临床研究中应用的M SC主要来源于骨髓[6-7],但骨髓中干细胞比例极低,通过分离得到的数量极少。2009年,Jazed je等[8]首次证实外科手术废弃的输卵管(fallop ian tube,FT)组织中存在MSC。2012年Jazed je等[9]又报道将人输卵管间充质干细胞(fallopian tube m esenchym al stem cell,FTMSC)移植到骨损伤大鼠体内,可增强其骨再生能力。2013年Indum athi等[10]再次证实了输卵管中MSC的存在,并对FTMSC与骨髓MSC的生物学特性进行了比较,认为FTMSC可以取代骨髓MSC用于再生医学,作为一种新的干细胞来源。输卵管组织全层包括黏膜层、肌层及浆膜层,黏膜层又包括上皮和其下的纤维结缔组织层,后者又称为固有膜。输卵管内膜(fallopian tube m ucosa,FM)随月经周期发生周期性变化,经历反复损伤与再生。有研究表明MSC存在于多种人体组织黏膜中,如子宫内膜、口腔黏膜、小肠黏膜、筛窦黏膜及嗅黏膜[11-16],所以我们推测FM中存在丰富的干细胞。本实验验证了是否存在输卵管内膜干细胞(fallop ian tube m ucosa stem cell,FMSC),同时比较FMSC与FTM SC的细胞形态、细胞表型、克隆形成率、增殖能力和分化能力等生物学特性,旨在为临床研究提供依据。
1 材料与方法
1.1 主要材料 Ⅰ型胶原酶、明胶、胰蛋白酶、胰岛素、地塞米松、维生素C、β-甘油磷酸钠、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-m ethylxanthine,IBM X)、吲哚美辛、抗坏血酸、丙酮酸钠、地塞米松、脯氨酸、TGF-β3购于Sigm a公司,胎牛血清(fetal bovine serum,FBS)、DMEM干粉购于Life techno logy公司,CD13、CD73、CD105、CD166、HLA-ABC、CD 14、HLA-DR、CD 29、CD 90、CD 34、CD 44、CD 45、CD 19抗体均购于BD公司,胰岛素-转铁蛋白-硒添加物(insu lin-transferrinselen ium,ITS)、结晶紫染色液、茜素红染液、阿利新蓝染色液、油红O染液购于广州赛业公司。
1.2 方法
1.2.1 FM及输卵管组织的收集 收集行输卵管切除手术的6例患者的输卵管组织。患者年龄35~55岁,均因良性疾病需行输卵管切除术,输卵管切除术前至少3个月未服用激素治疗,术后病理均证实病变未累及输卵管组织。所有患者均签署知情同意书。将患者整条左侧输卵管收集在含DMEM培养基的无菌培养瓶内。手术中切下的整条右侧输卵管组织置于无菌培养皿内,解剖显微镜下或肉眼下将输卵管纵向剖开暴露FM,用镊子将FM剥离输卵管组织后收集在含DMEM的无菌培养瓶内,放入4℃恒温运输箱,24h内运送至实验室。
1.2.2 FTM SC及FMSC原代分离与传代培养 从无菌培养瓶内取出FM组织,用PBS液洗去表面残留血液,剪碎至1~2mm3组织块,用等体积的0.25%胰蛋白酶与组织块混匀,消化30m in,2500r/m in离心8m in,加入等体积的0.1%胶原酶Ⅰ过夜消化。2000r/m in离心8m in,收集细胞,洗涤2次;将细胞接种于含10%胎牛血清的DMEM培养基中,并加入5m l含10%胎牛血清的DMEM/F-12培养基,置入37℃、5%CO2、饱和湿度培养箱内培养,48h后移去未贴壁细胞,3~4d后更换新鲜培养基;当细胞生长至约80%融合时,按3000个/cm2的密度进行传代。传至5代后进行后续检测。对输卵管组织全层进行消化,方法同FM消化。
1.2.3 细胞增殖能力检测 将收获的P1~P5代FTMSC和FMSC进行细胞计数,然后计算每一代细胞的群倍数(popu lation doub ling,PD),公式为:PD=(lg Nh–lg Np)/lg2。Nh表示细胞的收获数;Np表示细胞的起始数。细胞累积群倍数(cum u lative popu lation doub lings,CPD)为这一代的PD加上前一代的PD。
1.2.4 细胞表型检测 分别取培养的生长良好的P5代FTMSC和FMMSC,0.25%胰蛋白酶消化,PBS洗涤3次,调整细胞密度为1.0×106/m l;同型对照管加入鼠IgG-FITC、IgG-PE、IgG-APC、IgG-PerCP,检测管分别加入鼠抗人抗体10μl,在4℃下孵育30m in,用PBS洗涤1次,1000r/m in离心5m in,用500μl的PBS重悬细胞,然后上流式细胞仪检测,进行对比。
1.2.5 细胞克隆形成率检测 FTMSC、FMMSC以1×103个/孔密度接种于6孔板,放入培养箱内,15d后取出,固定细胞并用结晶紫染色,细胞数大于40定义为克隆团,倒置显微镜下计算克隆团数量。
1.2.6 细胞分化检测 取P5代FTMSC和FMSC,以1×105个/孔密度接种于预铺1%明胶的6孔板中,待细胞达80%融合时更换成骨诱导培养基。成骨诱导培养基为添加了5%FBS、1μm o l/L地塞米松、50μg/m l维生素C、0.01m o l/L β-甘油磷酸钠的DMEM培养基。对照组为添加含10%胎牛血清的DMEM培养基。每3d换液,诱导21d后,95%乙醇固定,茜素红染色,显微镜下观察胞外钙基质沉积情况。
取P5代FTMSC和FMSC,以1×105/孔密度接种于6孔板中,待细胞达80%融合时更换为脂肪诱导培养基。脂肪诱导培养基为添加了5%FBS、10μg/m l胰岛素、1μm ol/L地塞米松、0.5mm o l/L IBMX、0.1mm o l/L吲哚美辛的DMEM培养基。对照组为添加含10%胎牛血清的DMEM培养基。每3d换液,诱导21d后,10%多聚甲醛固定,饱和油红O染液染色,显微镜下观察胞内着色脂滴。
软骨分化:调整细胞浓度为1.6×107/m l。取5μl细胞悬液,缓慢滴加至6孔板中间部位,培养2h,弃掉生长培养液及未贴壁细胞,加入成软骨诱导培养基。软骨诱导培养基为添加了50μg/m l抗坏血酸、50μg/m l ITS、100μg/m l丙酮酸钠、100nm ol/L地塞米松、40μg/m l脯氨酸、10ng/m l TGF-β3的DMEM培养基。对照组为添加含10%胎牛血清的DMEM培养基。每3d换液,每周换液2次,诱导分化21d后,10%多聚甲醛固定,阿利新蓝染色液染色并观察。
1.3 统计学处理 采用SPSS 17.0软件进行统计分析,实验数据以±s表示,两组间比较采用独立t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 细胞形态观察 输卵管细胞和FM细胞接种于含10%胎牛血清的DMEM培养基12h后有少量细胞贴壁,贴壁细胞呈单个分散或成簇生长,细胞形态多呈长梭形、纺锤形;此后贴壁细胞迅速增殖,体积增大,形态变得纤细、细长,立体感强,细胞集落明显增大、增多。培养至7d时,细胞达80%~90%融合。经传代,细胞逐渐表现为较均一的长梭形,并呈漩涡状生长,P5代FMSC较FTMSC形态更加均匀一致,排列更加致密整齐(图1)。
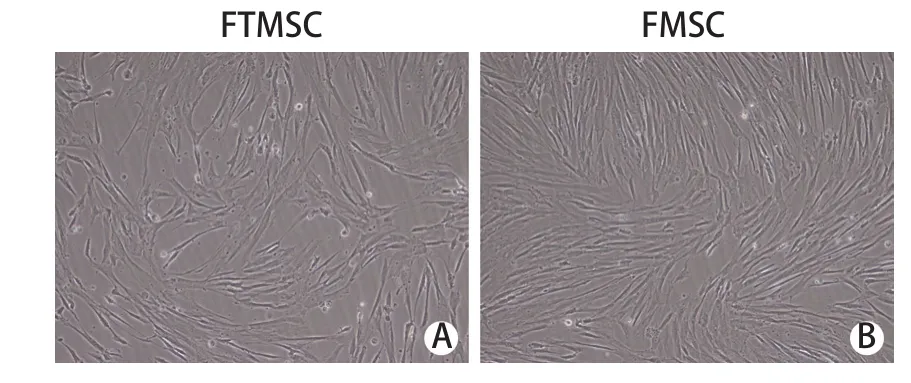
图1 两种干细胞的形态学特征(×200)Fig.1 Morphological features of FTMSC and FMSC (×200)
2.2 细胞增殖能力检测结果 计算P1~P5代FTMSC和FMSC的CPD,结果显示P1~P5代FMSC的CPD均高于FTMSC,差异均有统计学意义(P<0.05或P<0.01,图2)。
2.3 细胞表型检测结果 流式细胞术检测结果显示,FTMSC和FMSC均阳性表达CD 13、CD 29、CD 90、CD 105和HLA-ABC,阴性表达CD 14、CD19、CD45、CD34和HLA-DR。两种不同来源扩增的MSC表型无差异(图3)。
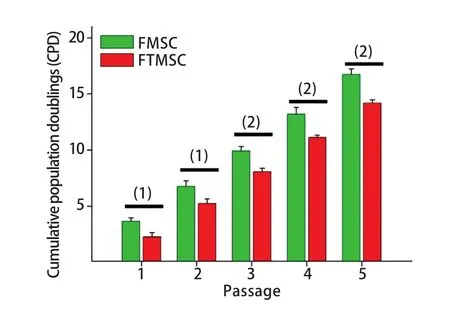
图2 两种干细胞的增殖能力(n=6)Fig.2 Pro liferation capacity of FTMSC and FMSC (n=6)(1)P<0.05, (2)P<0.01
2.4 细胞克隆形成率检测结果 将P5代输卵管及FM细胞以低密度(1×103个/cm2)进行接种培养,结果显示,输卵管细胞形成的克隆团为72±3个,FM细胞形成的克隆团为121±3个,FM细胞形成克隆团数目多于输卵管细胞,两者差异有统计学意义(P<0.01)。
2.5 细胞分化能力检测结果 成骨诱导分化鉴定结果显示,P5代FTM SC和FMSC经成骨诱导21d后,茜素红染色结节呈橘红色,边界清晰,表明有矿化基质沉积,提示两种干细胞均具有相似的成骨分化能力(图4A);成脂诱导分化鉴定结果显示,P5代FTMSC和FMSC经成脂诱导21d后,油红O染色显示有大量脂质沉积,提示两种干细胞均具有相似的成脂分化能力(图4B);成软骨诱导分化鉴定结果显示,P5代FTMSC和FMSC经成软骨诱导21d后,阿新蓝染色可见细胞质和细胞间质呈蓝绿色,提示两种干细胞均具有相似的成软骨分化能力(图4C)。
3 讨 论
目前再生医学研究仍然主要采用骨髓来源的MSC作为种子细胞,但越来越多的组织中发现存在MSC,许多学者提出尝试采用其他来源的MSC替代骨髓MSC进行临床研究[17-23]。输卵管为妇产科手术后常见的组织废弃物,输卵管组织中富含MSC,可实现自体移植,但输卵管作为干细胞来源用于再生医学尚存在一些局限性:①来源有限,临床上切除输卵管组织的患者毕竟是少数;②如果用于自体移植,则应用范围也有限,并不是所有患者都切除自体输卵管组织。本实验从输卵管内膜层组织分离培养干细胞,并证明FMSC符合2006年美国国际细胞治疗协会提出的MSC鉴定的最低标准,证实了FM中存在MSC;此外,通过与FTMSC生物学特性的对比,发现FMSC较FTMSC有更强的增殖能力,应用价值较大。人体细胞治疗所需的细胞数量为1×106/kg,体重50kg的成人需输注的细胞数量为5×107个。因此,如何在短时间内获得足够量的细胞,为患者赢得时间,显得特别重要,尤其对于自体移植来说,增殖能力强可以缩短体外培养的时间,细胞在较短时间内就能达到细胞移植的数量标准。FM可以通过现有的输卵管镜下获取,对患者侵袭较小,增加了自体获取来源,且提高了应用范围。
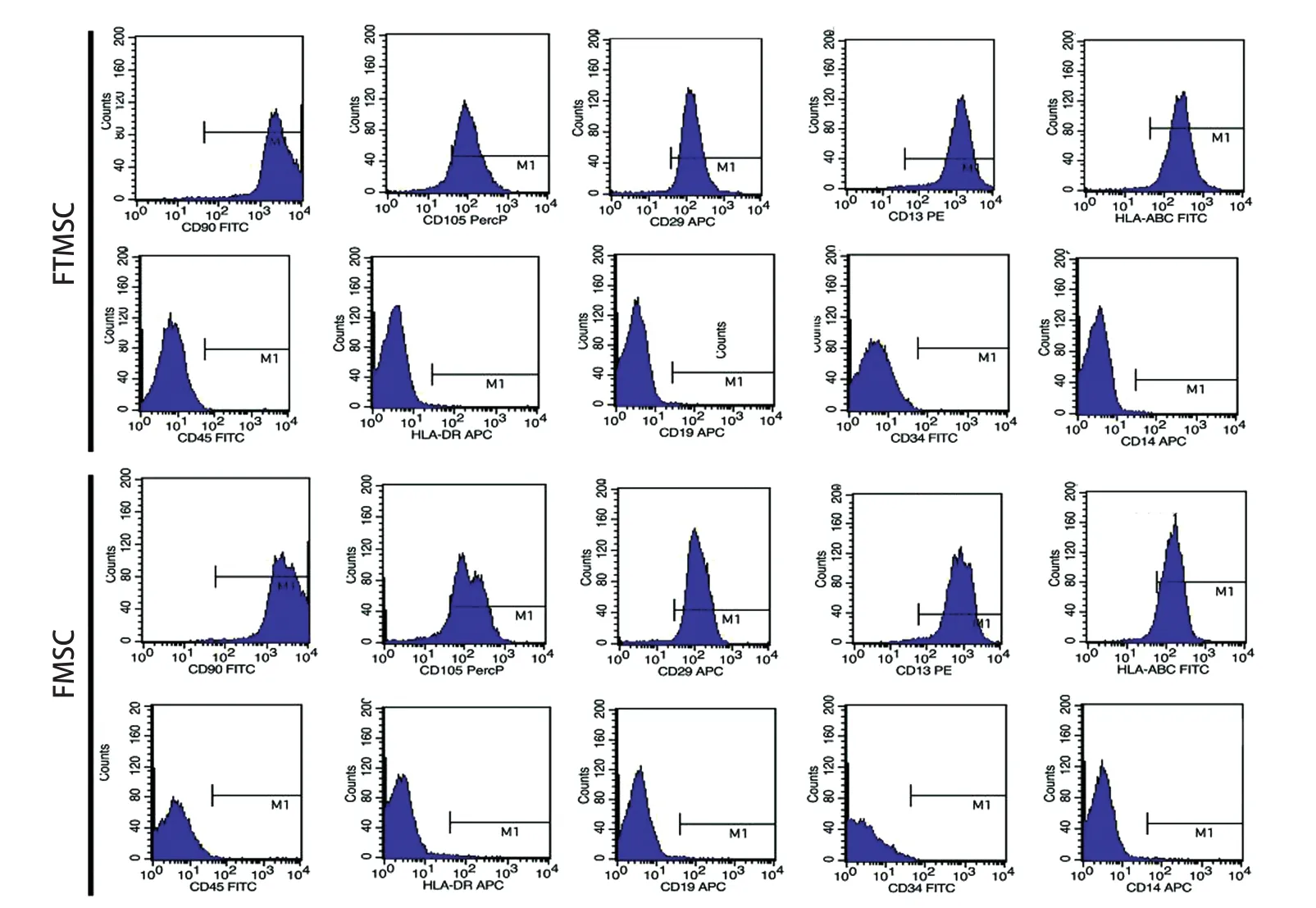
图3 两种干细胞的免疫表型Fig.3 Imm unopheno type of FTMSC and FMSC
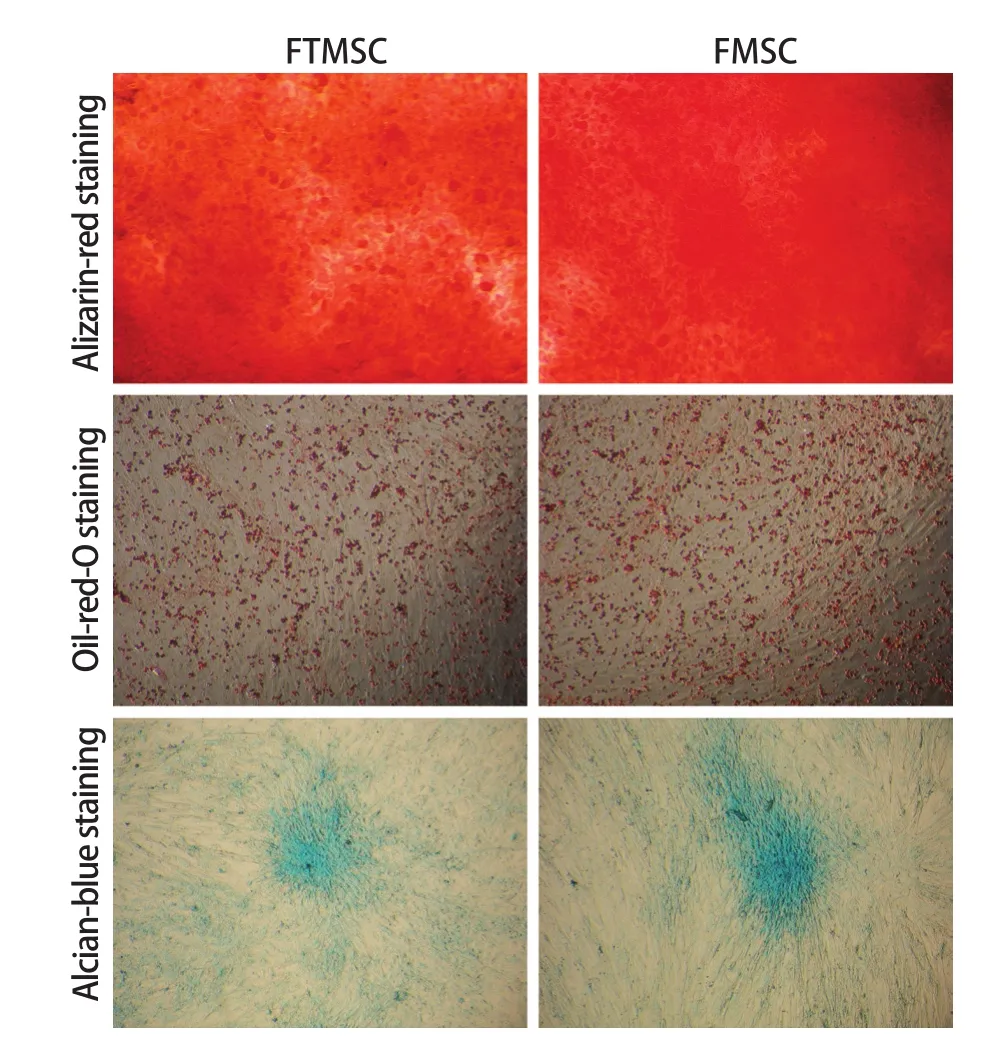
图4 两种干细胞的体外成骨诱导、成脂诱导及成软骨诱导分化能力(×400)Fig.4 In vitro osteogenic, adipogenic and chond rogenic d ifferen tiation capacity of FTMSC and FMSC (×400)
本实验表明,FTMSC和FMSC细胞形态细长,在P5代时,FMSC形态较FTMSC更加均匀一致,排列更加致密整齐,这可能是由于输卵管内膜层消化所获取的MSC可排除输卵管肌层、浆膜层的干扰,纯度相对较高。细胞增殖结果也显示与FTM SC比较FMSC增殖能力较强,这可能与FM随月经周期发生周期性变化,经历反复损伤与再生,再生能力强有关。细胞表型检测结果显示,在P5代时,两种不同来源的MSC表型无明显差别,体外诱导分化提示FTMSC及FMSC都具有向骨、脂肪及软骨方向分化的潜能。
多能干细胞移植修复生殖系统损伤是重建生殖功能的一种新方法[24-25]。FMSC移植可能是子宫内膜再生及生殖功能恢复的最佳选择,这是由于FM与子宫内膜两者之间具有极高的相似性,主要体现在以下两点:①输卵管与子宫都是由胚胎时期的副中肾管(苗勒管)分化、演变衍生而来[26];②FM是异位妊娠最常发生的部位,由细胞因子、趋化因子及黏附因子所组成的介导胚泡黏附的信号通路在FM与子宫内膜上的表达是相似的,两种内膜组织都具有介导胚泡植入发生妊娠的潜能[27]。
总之,FM组织取材较容易,对患者侵袭较小,来源及应用范围广泛,容易实现自体移植,且FMSC较FTMSC有更强的增殖能力,所以FMSC较FTMSC有更突出的优势及更高的临床应用价值,尤其对自身生殖道损伤的修复优势更为明显。
[1] Ding DC, Shyu WC, Lin SZ. Mesenchym al stem cells[J]. Cell Transp lan t, 2011, 20(1): 5-14.
[2] Meire lles Lda S, Fon tes AM, Covas DT, et al. Mechan ism s invo lved in the therapeutic p roperties of m esenchym al stem cells[J]. Cytokine Grow th Factor Rev, 2009, 20(5-6): 419-427.
[3] Chen LM, Xu RN, Lu S, et al. Ro le of hum an um bilical cord m esenchym al stem cells in the regu lation of activation and apop tosis of hepatic stellate cell[J]. Med J Chin PLA, 2014,39(1): 11-14. [陈黎明, 徐若男, 吕飒, 等. 脐带间充质干细胞对肝星状细胞活化、凋亡的调控作用研究[J]. 解放军医学杂志, 2014, 39(1): 11-14.]
[4] Li DL, He XH, Fan JJ, et al. A com parison of effects of bone m arrow stem cell m obilization and bone m arrow m esenchym al stem cell transp lan tation on the recovery of function and regeneration of rat liver tissue after m assive excision of liver[J].Med J Chin PLA, 2014, 39(8): 595-600. [李东良, 何秀华, 范敬静, 等. 骨髓动员与骨髓间充质干细胞移植促进极量肝切除大鼠肝再生作用的对照研究[J]. 解放军医学杂志, 2014,39(8): 595-600.]
[5] Dom inici M, Le Blanc K, Mue ller I, et al. M in im al criteria for defining m u ltipo ten t m esenchym al strom al cells. The International Society for Cellular Therapy position statem ent[J].Cyto therapy, 2006, 8(4): 315-317.
[6] Zhao KY, Wang HS, Hou MX, et al. Therapeu tic e ffect of m esenchym a l stem ce lls transp lan tation on pu lm onary hyperten tion m odel rats[J]. Med J Chin PLA, 2013, 38(10):830-833. [赵科研, 王辉山, 候明晓, 等. 骨髓间充质干细胞移植对肺动脉高压模型大鼠的作用[J]. 解放军医学杂志,2013, 38(10): 830-833.]
[7] Wu Y, Feng CJ, Enhe J, et al. Inhibition effect of bone m arrowderived m esenchym al stem cells on skin scar fo rm ation in mice[J]. Med J Chin PLA, 2013, 38(1): 34-38. [武艳, 冯长江,恩和吉日嘎拉, 等. 骨髓间质干细胞对小鼠皮肤瘢痕形成的抑制作用观察[J]. 解放军医学杂志, 2013, 38(1): 34-38.]
[8] Jazed je T, Perin PM, Czeresnia CE, et al. Hum an fallop ian tube:a new source of m u ltipo tent adu lt m esenchym al stem cells discarded in surgical p rocedures[J]. J Transl Med, 2009, 7: 46.
[9] Jazed je T, Bueno DF, Alm ada BV, et al. Hum an fallopian tube m esenchym al strom al cells enhance bone regeneration in a xenotransp lanted m odel[J]. Stem Cell Rev, 2012, 8(2): 355-362.
[10] Indum athi S, Harikrishnan R, Rajkum ar JS, et al. Prospective biom arkers of stem cells of hum an endom etrium and fallopian tube com pared with bone m arrow[J]. Cell Tissue Res, 2013,352(3): 537-549.
[11] Cho KS, Park HY, Roh HJ, et al. Hum an ethm oid sinus m ucosa:a p rom ising novel tissue sou rce of m esenchym al p rogenitor ce lls[J]. Stem Ce ll Res Ther, 2014, 5(1): 15.
[12] Gargett CE, Masuda H. Adu lt stem cells in the endom etrium[J].Mo l Hum Rep rod, 2010, 16(11): 818-834.
[13] Marynka-Kalm an i K, Treves S, Yafee M, et al. The lam ina p rop ria of adu lt hum an oral m ucosa harbors a novel stem cell popu lation[J]. Stem Ce lls, 2010, 28(5): 984-995.
[14] Powell DW, Pinchuk IV, Saada JI, et al. Mesenchym al cells of the intestinal lam ina p rop ria[J]. Annu Rev Physio l, 2011, 73: 213-237.
[15] Tomé M, Lind say SL, Ridde ll JS, et al. Iden tification of nonep ithelial m u ltipo tent cells in the em b ryonic o lfactory m ucosa[J]. Stem Ce lls, 2009, 27(9): 2196-2208.
[16] Zhang QZ, Nguyen AL, Yu WH, et al. Hum an oral m ucosa and gingiva: a unique reservoir for m esenchym al stem cells[J]. J Den t Res, 2012, 91(11): 1011-1018.
[17] Hem atti P, Kim J, Stein AP, et al. Potential role of m esenchym al strom al cells in pancreatic islet transp lantation[J]. Transp lant Rev (Orlando), 2013, 27(1): 21-29.
[18] Li X, Ling W, Pennisi A, et al. Hum an p lacenta-derived adherent cells p revent bone loss, stim ulate bone form ation, and supp ress g row th of m u ltip le m yelom a in bone[J]. Stem Ce lls, 2011,29(2): 263-273.
[19] Orozco L, Munar A, So le r R, et al. Treatm en t of knee osteoarthritis with autologous m esenchym al stem cells: a pilot study[J]. Transp lan tation, 2013, 95(12): 1535-1541.
[20] Chen G, Wang Y, Xu Z, et al. Neural stem cell-like cells derived from autologous bone m esenchym al stem cells for the treatm ent of patien ts with cerebral palsy[J]. J Transl Med, 2013, 11: 21.
[21] Xin Y, Wang YM, Zhang H, et al. Ag ing adverse ly im pacts b io log ica l p roperties of hum an bone m arrow-derived m esenchym al stem cells: im p lications for tissue engineering heart valve construction[J]. Artif Organs, 2010, 34(3): 215-222.
[22] Kang K, Wang AM, Yin SD, et al. Cu lture and identification of stem cells of uterine junctional zone[J]. Med J Chin PLA, 2015,40(3): 173-177 [康康, 王蔼明, 尹善德, 等. 子宫内膜结合带的培养与鉴定[J]. 解放军医学杂志, 2015, 40(3): 173-177].
[23] Zheng N, Zhang NK, Gao LR. Research p rogress of adult cardiac stem cells[J]. Med J Chin PLA, 2013, 38(4): 334-337. [郑楠, 张宁坤, 高连如. 成体心肌干细胞的研究进展[J]. 解放军医学杂志, 2013, 38(4): 334-337.]
[24] Gargett CE, Ye L. Endom etrial reconstruction from stem ce lls[J]. Fertil Steril, 2012, 98(1): 11-20.
[25] Nagori CB, Panchal SY, Patel H. Endom etrial regeneration using autologous adult stem cells fo llowed by concep tion by in vitrofertilization in a patient of severe Asherm an's synd rom e[J]. J Hum Rep rod Sci, 2011, 4(1): 43-48.
[26] Am so NN, Crow J, Lew in J, et al. A com parative m orphological and u ltrastructural study of endom etrial g land and fallop ian tube epithelia at different stages of the m enstrual cycle and the m enopause[J]. Hum Rep rod, 1994, 9(12): 2234-2241.
[27] Makrigiannakis A, Karam outi M, Petsas G, et al. The exp ression of recep tivity m arkers in the fallop ian tube ep ithelium[J].Histochem Ce ll Bio l, 2009, 132(2): 159-167.
