EZH2对HSC-T6细胞增殖活化的影响及其部分机制研究
2015-02-26陈小霞孟晓明
陈小霞,谢 娟,黄 成,孟晓明,李 俊
(安徽医科大学药学院,安徽医科大学肝病研究所,安徽省高校产业共性技术研究院,安徽合肥 230032)
EZH2对HSC-T6细胞增殖活化的影响及其部分机制研究
陈小霞,谢 娟,黄 成,孟晓明,李 俊
(安徽医科大学药学院,安徽医科大学肝病研究所,安徽省高校产业共性技术研究院,安徽合肥 230032)
中国图书分类号:R-332;R322.47;R329.24;R341;R575.202.2
摘要:目的 探讨Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)表达沉默对大鼠肝星状细胞HSC-T6细胞增殖活化的影响,及其部分调控机制。方法 应用EZH2的抑制剂DZNep(3-Deazaneplanocin A)作用于TGF-β1诱导活化的HSC-T6细胞,采用Western blot法检测蛋白EZH2、p-ERK、p-AKT和α-SMA的表达;根据EZH2的碱基序列设计并合成小干扰RNA(small interfering RNA,siRNA),通过脂质体LipofectamineTM2000转染到HSC-T6细胞内,应用四甲基偶氮唑盐(MTT)法检测HSC-T6细胞的增殖变化,Western blot法检测蛋白EZH2、p-ERK、p-AKT和α-SMA的表达。结果 将DZNep加入TGF-β1诱导活化的HSC-T6细胞后,EZH2蛋白水平明显降低,同时p-ERK、p-AKT和α-SMA蛋白水平亦明显降低;将EZH2-siRNA转染活化的HSC-T6细胞内,HSC-T6细胞的增殖可明显被抑制,同时EZH2、p-ERK、p-AKT和α-SMA蛋白水平亦明显降低。结论 抑制EZH2的表达可明显抑制HSC-T6细胞的增殖活化,EZH2可能是潜在的治疗肝纤维化的靶点。
关键词:组蛋白甲基化;肝星状细胞;Zeste基因增强子同源物2;DZNep;肝纤维化;p-ERK;p-AKT;α平滑肌肌动蛋白
网络出版时间:2015-7-22 10:42 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.010.html
肝纤维化是持续性肝脏损伤的共同病理改变过程,主要表现为细胞外基质(extracellular matrix,ECM)在肝脏中的大量沉积,其持续发展可形成肝硬化和肝细胞癌[1]。肝纤维化的形成机制目前尚不清楚,研究表明肝星状细胞(hepatic stellate cell,HSC)的增殖活化是肝纤维化形成的关键,抑制HSC的增殖活化成为防治肝纤维化的重点[2]。有文献报道,Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)在纤维化形成中起重要作用[3]。肝纤维化形成过程中,MAPK/ERK和PI3K/AKT通路被激活并起重要作用。研究发现,EZH2能够激活MAPK/ERK和PI3K/AKT通路,从而引起疾病[4]。本研究拟应用EZH2的抑制剂DZNep和小干扰RNA(small interfering RNA,siRNA)抑制EZH2的表达,考察其对HSC增殖活化的调控作用,探究其调控机制,以期为肝纤维化的防治提供新的靶点。
1 材料
1.1细胞株 大鼠肝星状细胞株HSC-T6购于南京凯基生物科技发展有限公司。
1.2试剂与仪器 DZNep购于Selleckchem公司;TGF-β1购于Peprotech公司;噻唑蓝MTT购于Sig-ma公司;DMSO购于Sigma公司;胰蛋白酶、DMEM培养基为Hyclone公司产品;胎牛血清购于杭州四季青公司;山羊抗小鼠IgG和山羊抗兔IgG购于北京中杉金桥生物技术有限公司;脂质体Lipofectami-neTM2000、Opti-MEM购于Invitrogen公司;EZH2、p-ERK、ERK、p-AKT和AKT抗体购于Cell Signaling公司;α-SMA抗体购于北京博奥森生物技术有限公司;β-actin抗体购于北京中杉金桥生物技术有限公司;倒置荧光显微镜(OLYMPUS公司,日本);酶标仪(bio-tekEL)。
2 方法
2.1HSC-T6细胞的培养 应用含10%胎牛血清的DMEM培养基,在37℃、5%CO2及饱和湿度条件下进行细胞培养,待细胞长至70%~80%密度时进行细胞传代。
2.2DZNep的应用 加入DZNep 24 h前,将细胞传代至6孔培养板,每孔2×105细胞。实验分正常组、应用TGF-β1刺激的模型组、TGF-β1刺激并加入DZNep的恢复组。正常组不做任何处理;模型组加入TGF-β1刺激终浓度为10 μg·L-1,TGF-β1作用于细胞的时间为48 h;恢复组加入TGF-β1刺激终浓度为10 μg·L-1,并加入DZNep刺激终浓度为1 μmol·L-1,DZNep作用于细胞的时间为24 h。
2.3siRNA的合成 根据siRNA设计原则,设计针对EZH2基因的siRNA序列,在GenBank表达序列标签(EST)数据库应用BLAST检索,并确认所设计siRNA序列的唯一性,靶向目的基因EZH2的序列设计的两条链,正义链:5′-GGGCAUCUUUAU-CAAAGAUTT-3′;反义链:5′-AUCUUUGAUAAAGAU GCCCTT-3′。同样方法构建阴性对照组的两条链,正义链:5′-UUCUCCGAACGUGUCACGUTT-3′;反义链:5′-ACGUGACACGUUCGGAGAATT-3′,与任何编码序列无同源性,由吉玛制药有限公司合成有效siRNA干粉制剂。
细胞培养及siRNA转染HSC-T6细胞培养于含10%胎牛血清的DMEM培养基,37℃、5%CO2培养。转染24 h前,传代至6孔培养板,每孔2×105细胞。实验分正常组、模型组、阴性对照组和EZH2-siRNA实验组。正常组不做任何处理;模型组加入TGF-β1;阴性对照组转染FAM标记的阴性对照siR-NA并加入TGF-β1;实验组转染EZH2-siRNA并加入TGF-β1。用Opti-MEM和脂质体作为转染试剂进行转染,使siRNA终浓度均为100 pmol·L-1,置于37℃、5%CO2培养箱转染6 h后,每组加入完全培养基含TGF-β1使刺激终浓度为10 μg·L-1,继续培养48 h,收获细胞。采用荧光倒置显微镜观察各组转染后的细胞形态并判断转染效果。
2.4细胞增殖实验 以MTT法检测HSC-T6细胞的增殖,分组同上。将培养的HSC-T6细胞以10%胎牛血清的DMEM制备成1×108·L-1的细胞悬液,接种于96孔板,每孔100 μL,过夜,待细胞贴壁后进行细胞转染,转染后6 h换液,每孔加入完全培养基200 μL含TGF-β1使刺激终浓度为10 μg· L-1,37℃、5%CO2培养箱中继续培养12、24、48、72 h,然后每孔加0.5%MTT贮存液20 μL继续孵育4 h,最后弃上清,每孔加入150 μL二甲基亚砜溶解细胞内结晶,置于恒温震荡器上震摇10 min,应用酶标仪于490 nm波长处测定吸光度值,以空白对照组作为对照组,其细胞存活率为100%,其余各组按:存活率/%=[(各实验组吸光度值-本底吸光度值)/(对照组吸光度值-本底吸光度值)]×100%。
2.5Western blot检测EZH2、p-ERK、p-AKT、α-SMA蛋白表达 细胞的培养、分组、处理同上。DZNep作用24 h或者转染EZH2-siRNA 48 h后,分别提取细胞总蛋白,应用BCA法测定蛋白浓度。应用10%SDS-PAGE凝胶进行电泳,在200 mA恒定电流下应用PVDF膜进行转膜,TBST洗膜后,使用5%牛奶封闭非特异性结合位点,TBST洗膜后,在4℃于一抗(1∶500)中孵育过夜,TBST洗膜后,加入辣根过氧化物酶标记的山羊抗小鼠或抗兔二抗(1∶10 000)室温中孵育1 h,TBST洗膜后,加入ECL发光剂反应20 s,电脑显影成像,实验重复3次或以上。
2.6统计学处理 采用SPSS 13.0软件进行统计分析,数据以±s表示。两组间比较采用t检验,多组间比较采用单因素方差分析。
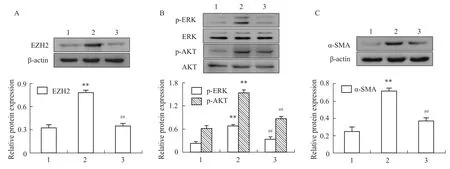
Fig 1 Protein expression of EZH2(A),p-ERK,p-AKT(B)and α-SMA(C)detected by Western blot after application of DZNep
3 结果
3.1Western blot法检测应用DZNep后HSC-T6细胞中EZH2、p-ERK、p-AKT和α-SMA蛋白表达变化 加入TGF-β1的模型组EZH2蛋白表达水平明显升高,与正常组相比差异有显著性(P<0.01),加入TGF-β1和DZNep的恢复组EZH2蛋白表达水平明显降低,与模型组相比差异有显著性(P<0.01),见Fig 1A;同时,模型组p-ERK和p-AKT蛋白表达水平明显升高,与正常组相比差异有显著性(P<0.01),恢复组p-ERK和p-AKT蛋白表达水平明显降低,与模型组相比差异有显著性(P<0.01),见Fig 1B;与此同时,模型组α-SMA蛋白表达水平明显升高,与正常组相比差异有显著性(P<0.01),恢复组α-SMA蛋白表达水平明显降低,与模型组相比差异有显著性(P<0.01),见Fig 1C。
3.2MTT法检测HSC-T6增殖活性 MTT实验结果显示,EZH2-siRNA瞬时转染对TGF-β1诱导的HSC-T6细胞的增殖有明显的抑制作用,EZH2-siR-NA实验组作用12 h细胞抑制率与阴性对照组、模型组之间差异无显著性(P>0.05);EZH2-siRNA实验组作用24、48、72 h细胞抑制率明显高于阴性对照组、模型组(P<0.05)。同时,作用24、48、72 h时模型组、阴性对照组与正常组之间差异有显著性(P <0.05),见Fig 2。
3.3Western blot法检测siRNA转染后HSC-T6细胞中EZH2、p-ERK、p-AKT和α-SMA蛋白表达变化 瞬时转染EZH2-siRNA 48 h后,EZH2蛋白表达明显降低,与阴性对照组相比差异有显著性(P<0.01),阴性对照组、模型组与正常组相比差异亦有显著性(P<0.01),见Fig 3A;同时,EZH2-siRNA实验组p-ERK和p-AKT蛋白表达也明显降低,与阴性对照组相比差异有显著性(P<0.01),阴性对照组、模型组与正常组相比差异亦有显著性(P<0.01),见Fig 3B;与此同时,EZH2-siRNA实验组α-SMA蛋白表达也明显降低,与阴性对照组相比差异有显著性(P<0.01),阴性对照组、模型组与正常组相比差异亦有显著性(P<0.01),见Fig 3C。
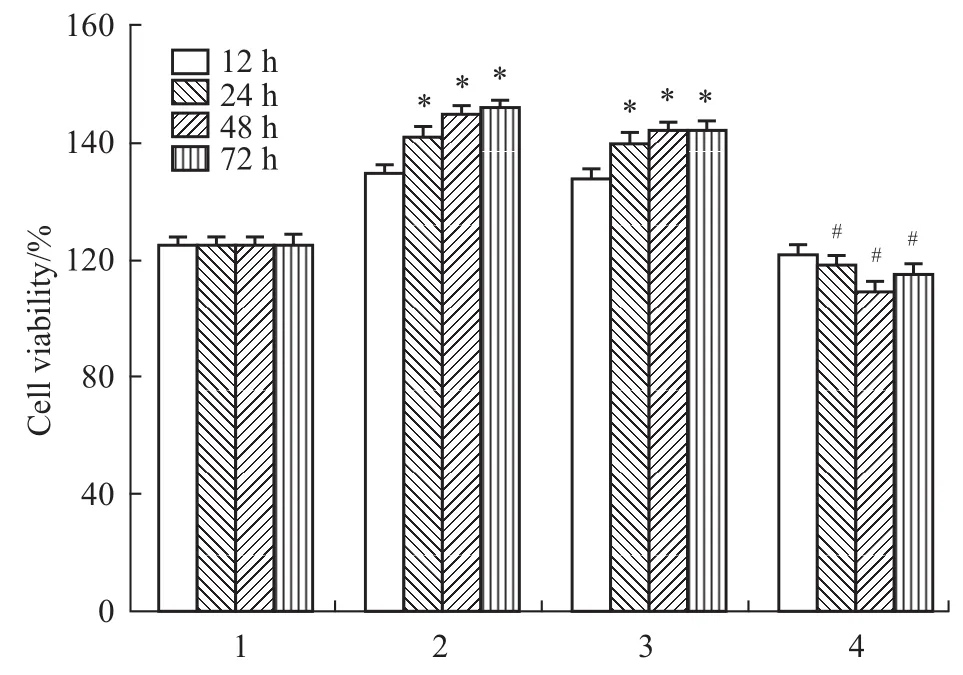
Fig 2 Proliferation of HSC cells determined by MTT after transfection with siRNA of EZH2
4 讨论
HSC的增殖活化是肝纤维化发生发展的关键环节,抑制HSC的增殖活化成为预防和治疗肝纤维化的重要手段之一[5]。近些年研究发现[6-9],表观遗传学(包括DNA甲基化、microRNA和组蛋白修饰等)在肝纤维化的发生发展中扮演重要角色。组蛋白修饰是指在组蛋白相关酶的作用下,组蛋白发生乙酰化、磷酸化、甲基化和泛素化等修饰的过程。组蛋白的甲基化修饰是由组蛋白甲基转移酶来实现的,组蛋白的甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,最终可导致基因的转录沉默或转录激活。研究发现[10],组蛋白的甲基化修饰与HSC的状态及转归密切相关。EZH2是一个重要的组蛋白甲基转移酶,通过特异性甲基化基因启动子区域组蛋白H3赖氨酸27,广泛参与了基因的转录沉默。在癌症的发生发展中,EZH2被认为是一个促癌基因,在子宫内膜癌、前列腺癌、肝癌等恶性肿瘤中高表达[11-13]。有研究发现,EZH2在肝纤维化形成中扮演重要角色,但是其具体机制尚不清楚。
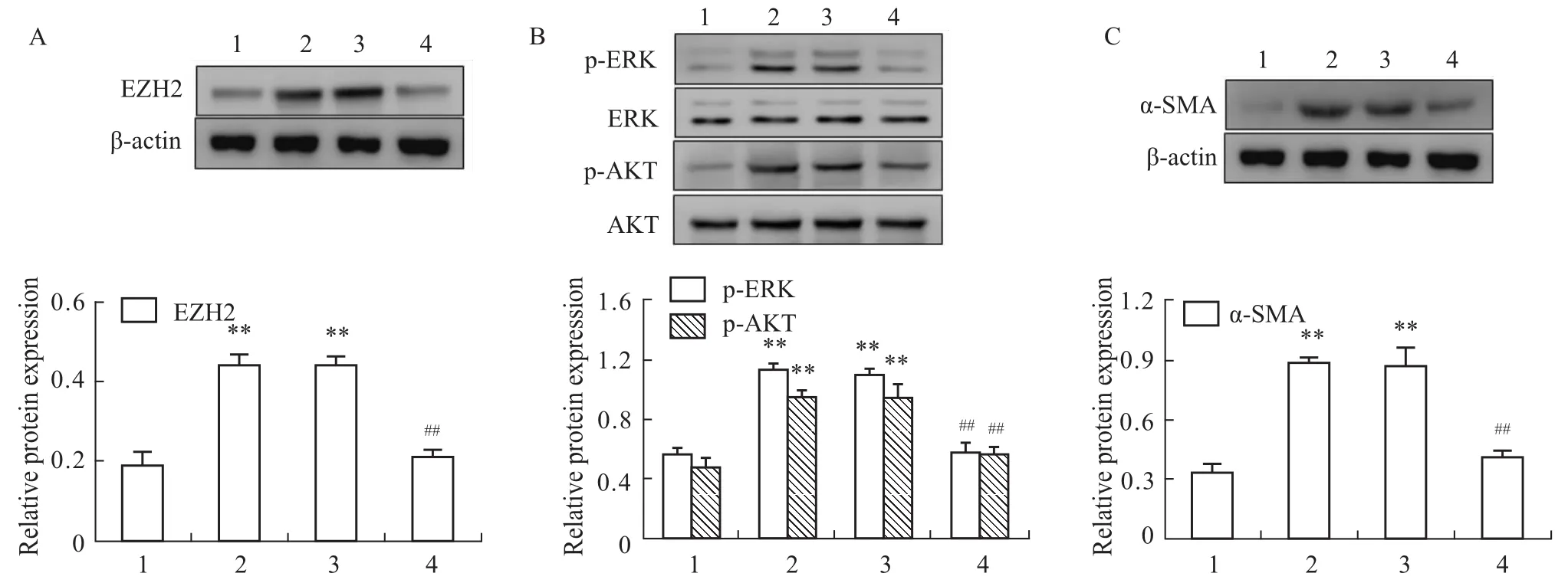
Fig 3 Protein expression of EZH2(A),p-ERK,p-AKT(B)and α-SMA(C)detected by Western blot after transfection with EZH2 siRNA
有文献报道[14-15],在生长因子TGF-β1等的刺激下,MAPK/ERK和PI3K/AKT信号通路被激活,进而影响到大鼠肝星状细胞HSC-T6的增殖活化。有研究发现,EZH2能够激活MAPK/ERK和PI3K/AKT信号通路从而引起疾病的发生。那么EZH2能否影响TGF-β1诱导的HSC的增殖活化,EZH2通过何种机制影响其增殖活化,目前尚未见文献报道。在该项研究中,应用TGF-β1诱导HSC增殖活化,同时应用EZH2的抑制剂DZNep和siRNA技术,抑制HSC-T6中EZH2的表达,观察EZH2表达下调后对TGF-β1诱导的HSC增殖活化的影响,及其对MAPK/ERK和PI3K/AKT信号通路的影响。应用EZH2的siRNA后,与阴性对照组比较,EZH2-siRNA实验组EZH2蛋白表达水平明显降低,表明瞬时转染实验成功。MTT法是评估细胞增殖的一种有效方法,MTT的结果表明,通过siRNA沉默EZH2的表达可明显抑制TGF-β1诱导的HSC-T6细胞的增殖。α-SMA是HSC活化的特征性标志,Western blot检测结果显示,应用抑制剂DZNep后,可明显降低α-SMA蛋白的表达;靶向干扰HSC-T6细胞中EZH2的表达,可明显降低α-SMA蛋白的表达。表明抑制EZH2的表达能影响TGF-β1诱导的HSC的增殖活化。结果进一步表明,应用TGF-β1刺激HSC-T6细胞可明显升高EZH2蛋白表达水平,也可明显升高p-ERK、p-AKT蛋白表达水平。应用抑制剂DZNep后可明显降低EZH2蛋白表达水平,也可明显降低p-ERK和p-AKT蛋白表达水平。靶向干扰HSC-T6细胞中EZH2基因的表达,可明显降低EZH2蛋白表达水平,也可降低p-ERK和p-AKT蛋白表达水平。表明抑制EZH2的表达能影响TGF-β1诱导的HSC中MAPK/ERK和PI3K/AKT信号通路的激活。抑制EZH2的表达能影响MAPK/ERK和PI3K/AKT信号通路的激活,是影响TGF-β1诱导的HSC增殖活化的机制。
综上,抑制HSC-T6细胞中EZH2基因的表达,能影响TGF-β1诱导的HSC中MAPK/ERK和PI3K/AKT信号通路的激活,从而抑制HSC的增殖活化。本研究从细胞分子水平阐明EZH2对HSC的增殖活化的调控作用及其可能的潜在调控机制。揭示了EZH2在肝纤维化发展中的重要作用,可能成为防治肝纤维化的潜在新靶点,还需要通过其它实验进一步验证。肝纤维化的形成过程非常复杂,EZH2如何调控基因的沉默,尚需进一步深入研究。
参考文献:
[1] Hernandez-Gea V,Friedman S L.Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011,6:425-56.
[2] Lee U E,Friedman S L.Mechanisms of hepatic fibrogenesis[J].Best Pract Res Clin Gastroenterol,2011,25(2):195-206.
[3] Mann J,Chu D C,Maxwell A,et al.MeCP2 controls an epige-netic pathway that promotes myofibroblast transdifferentiation and fibrosis[J].Gastroenterology,2010,138(2):705-14.
[4] Min J,Zaslavsky A,Fedele G,et al.An oncogene-tumor sup-pressor cascade drives metastatic prostate cancer by coordinately activating Ras and nuclear factor-κ B[J].Nat Med,2010,16 (3):286-94.
[5] Fallowfield J A.Therapeutic targets in liver fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2011,300(5):G709-15.
[6] 陶 辉,黄 成,杨晶晶,等.RNAi介导MeCP2基因沉默对HSC-T6细胞活化增殖的影响[J].中国药理学通报,2012,28(3):333-6.
[6] Tao H,Huang C,Yang J J,et al.Experimental study of prolifera-tion and activation of HSC-T6 cells through RNA inference targe-ting MeCP2[J].Chin Pharmacol Bull,2012,28(3):333-6.
[7] Bian E B,Huang C,Wang H,et al.Repression of Smad7 media-ted by DNMT1 determines hepatic stellate cell activation and liver fibrosis in rats[J].Toxicol Lett,2014,224(2):175-85.
[8] He Y,Huang C,Sun X,et al.MicroRNA-146a modulates TGF-betal-induced hepatic stellate cell proliferation by targeting SMAD4[J].Cell Signal,2012,24(10):1923-30.
[9] Mannaerts I,Eysackers N,Onyema O O,et al.ClassⅡHDAC inhibition hampers hepatic stellate cell activation by induction of microRNA-29[J].PloS One,2013,8(1):e55786.
[10]Perugorria M J,Wilson C L,Zeybel M,et al.Histone methyl-transferase ASH1 orchestrates fibrogenic gene transcription during myofibroblast transdifferentiation[J].Hepatology,2012,56 (3):1129-39.
[11]Jia N,Li Q,Tao X,et al.Enhancer of zeste homolog 2 is in-volved in the proliferation of endometrial carcinoma[J].Oncol Lett,2014,8(5):2049-54.
[12]Chinaranagari S,Sharma P,Chaudhary J.EZH2 dependent H3K27me3 is involved in epigenetic silencing of ID4 in prostate cancer[J].Oncotarget,2014,5(16):7172-82.
[13]Au S L,Wong C C,Lee J M,et al.Enhancer of zeste homolog 2 epigenetically silences multiple tumor suppressor microRNAs to promote liver cancer metastasis[J].Hepatology,2012,56(2):622-31.
[14]Bian E B,Huang C,Ma T T,et al.DNMT1-mediated PTEN hy-permethylation confers hepatic stellate cell activation and liver fi-brogenesis in rats[J].Toxicol Appl Pharmacol,2012,264(1):13-22.
[15]Fang L,Zhan S,Huang C,et al.TRPM7 channel regulates PDGF-BB-induced proliferation of hepatic stellate cells via PI3K and ERK pathways[J].Toxicol Appl Pharmacol,2013,272 (3):713-25.
EZH2 plays a role in HSC-T6 cell proliferation and activation affecting MAPK/ERK and PI3K/AKT pathway
CHEN Xiao-xia,XIE Juan,HUNANG Cheng,MENG Xiao-ming,LI Jun
(School of Pharmacy,Anhui Medical University,Institute of Liver Diseases of Anhui Medical University,Anhui Institute of Innovative Drugs,Hefei 230032,China)
Abstract:Aim To investigate the effects of cell pro-liferation and activation in HSC-T6 cells by inhibiting the expression of EZH2,and its partial relevant mech-anism.Methods By introducing the inhibitor DZNep in activated HSC-T6 cells stimulated by TGF-β1,the protein expression levels of EZH2,p-ERK,p-AKT and α-SMA were detected by Western blot.The siRNA targeting EZH2 was designed and synthesized according to its nucleotide sequence,and their corresponding ex-pression vectors were constructed and transfected into HSC-T6 cells with LipofectamineTM2000.The prolifer-ation of HSC-T6 cells was determined by MTT.And the protein expression levels of EZH2,p-ERK,p-AKT and α-SMA were measured by Western blot.Results By introducing the inhibitor DZNep in activated HSC-T6 cells stimulated by TGF-β1,it effectively de-creased the protein levels of EZH2 and also the protein levels of p-ERK,p-AKT and α-SMA.By introducing EZH2-siRNA in activated HSC-T6 cells,it effectively inhibited the cell proliferation,and also the protein levels of EZH2,p-ERK,p-AKT and α-SMA.Conclu-sion Silencing EZH2 expression inhibits HSC-T6 cell proliferation and activation,and EZH2 may be a poten-tial therapeutic target gene for hepatic fibrosis.
Key words:histone methylation;hepatic stellate cells;enhancer of zeste homolog 2;3-deazaneplanocin A;hepatic fibrosis;p-ERK;p-AKT;alpha-smooth muscle actin
作者简介:陈小霞(1987-),女,硕士,研究方向:抗炎免疫药物的筛选及其作用机制,E-mail:chenxiaoxiahuhongd@163.com;李 俊(1960-),男,博士,教授,博士生导师,研究方向:临床药理学、抗炎免疫药理学,通讯作者,Tel:0551-65161001,E-mail:lijun@ahmu.edu.cn
基金项目:国家自然科学基金资助项目(No 81273526);博士点基金资助项目(No 20123420120001);安徽省教育厅基金资助项目(No KJ2012A156);安徽省自然科学基金资助项目(No 1308085MH145);安徽医科大学基金资助项目(No XJ201118)
收稿日期:2015-03-07,修回日期:2015-04-12
文献标志码:A
文章编号:1001-1978(2015)08-1061-05
doi:10.3969/j.issn.1001-1978.2015.08.007