ALEX1在宫颈癌中的表达及对宫颈癌细胞生物学行为的影响
2015-02-26伍家燕张涵韬刘革力宋方洲
曾 帆,伍家燕,高 月,张涵韬,白 鑫,刘革力,宋方洲
(重庆医科大学分子医学与肿瘤研究中心,生物化学与分子生物学教研室,重庆 400016)
ALEX1在宫颈癌中的表达及对宫颈癌细胞生物学行为的影响
曾 帆,伍家燕,高 月,张涵韬,白 鑫,刘革力,宋方洲
(重庆医科大学分子医学与肿瘤研究中心,生物化学与分子生物学教研室,重庆 400016)
中国图书分类号:R329.24;R329.28;R737.33;R979.1
摘要:目的 研究ALEX1基因在宫颈癌组织与癌旁组织中的表达情况,探讨ALEX1基因对宫颈癌细胞生物学行为的影响。方法 应用免疫组化检测临床宫颈癌组织与癌旁组织中ALEX1的表达情况,通过小干扰RNA技术沉默ALEX1,并通过流式细胞仪检测沉默ALEX1后HeLa细胞的周期、凋亡变化情况,利用CCK-8检测其增殖情况及对抗癌药物白藜芦醇敏感性的影响。结果 免疫组化结果显示,临床宫颈癌组织中ALEX1高表达。与对照组HeLa细胞相比,沉默ALEX1实验组细胞生长受到明显抑制,并且增强白藜芦醇对其的抑制作用,细胞周期阻滞在S期。结论 沉默ALEX1能有效阻滞HeLa细胞的生长能力及增强白藜芦醇对HeLa细胞的抑制作用。
关键词:ALEX1;宫颈癌;白藜芦醇;RNA干扰;细胞增殖;细胞凋亡;细胞周期
网络出版时间:2015-9-14 14:53 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150914.1453.048.html
宫颈癌是一种严重影响女性身心健康的疾病,据世界卫生组织报告发病率占所有癌症的12%,仅次于乳腺癌[1]。估计到2020年,将有1600万新增病例,年龄主要集中在15至44岁之间[2]。报道显示有80%以上宫颈癌是由人类乳头瘤病毒(HPV)感染引起,HPV可以激活宫颈中原癌基因或抑制抑癌基因,使宫颈肿瘤的病毒DNA整合到染色体DNA中,从而增强细胞增殖能力导致宫颈癌的发生[3-4]。
ARM重复蛋白家族是指含有多个armadillo re-peat结构的蛋白,其成员在肿瘤形成、细胞间通信以及细胞骨架形成等方面发挥着重要作用[5]。Arma-dillo repeat结构包含了3个螺旋结构,分别为H1、 H2和H3[5-6]。ALEX蛋白是一个新的ARM重复蛋白家族成员,主要由ALEX1、ALEX2和ALEX3组成。其中ALEX1(arm proteins lost in epithelial canc-ers on chromosome X1)蛋白序列含有两个Armadillo repeat结构,其N端具有一个疏水的跨膜区。目前研究表明,在大多正常组织中均有广泛的表达,在上皮组织来源的肿瘤中低表达或者不表达[7]。有关报道也证明ALEX1参与肿瘤的发生发展[8],过表达ALEX1能抑制直肠癌细胞的克隆形成[9]。但有关ALEX1在宫颈癌中的作用及其机制尚未见报道。为此我们将探讨ALEX1在宫颈癌中的表达情况,并研究其对宫颈癌细胞的相关生物学行为的影响。
1 材料与方法
1.1材料 HeLa细胞由重庆医科大学分子医学与肿瘤研究中心提供。采用含10%胎牛血清的DMEM培养基,在37℃、5%CO2培养箱中培养。DMEM培养基、胎牛血清购自Hyclon公司;Opti-MEM购自Gibco公司;Lipofectamine RNAiMAX购自Invitrogen公司;siRNA由上海吉玛公司合成;BCA试剂购自碧云天公司;CCK-8试剂盒购自Promega公司;DAB底物显色试剂盒购自Beyotime公司;SP9002免疫组化染色试剂购自北京中杉金桥生物技术公司;鼠抗人ALEX1单克隆抗体、兔抗人β-ac-tin多克隆抗体购自Santa Cruz公司;宫颈癌临床组织来源于重庆医科大学第一附属医院。
1.2方法
1.2.1免疫组化检测宫颈癌及其癌旁组织中的表达水平 收集的临床组织用4%的多聚甲醛固定24 h,体积分数为0.5乙醇90 min、体积分数为0.7乙醇90 min、体积分数为0.85乙醇90 min、体积分数为0.9乙醇90 min、无水乙醇60 min脱水,石蜡包埋及切片。切片的免疫组化:烘片、脱蜡与水化、封闭、加一抗、加二抗、DAB显色、镜检。根据组织的染色强度和染色阳性细胞比例进行综合性量化评分。染色强度评分标准:阴性(-),0分;弱阳性(+),1分;中等阳性(),2分;强阳性(),3分。染色阳性细胞比例评分标准:未染色细胞,0分;染
色阳性细胞比例<10%,1分;染色阳性细胞比例10%~50%,2分;染色阳性细胞比例>50%,3分。总分值=染色强度分值+染色阳性细胞比例分值。
1.2.2siRNA的合成及转染 利用Promega软件系统设计ALEX1 mRNA的3条siRNAs序列片段。序列分别为:RNAi-1,正义链:5′-CCUGGAGCGA ACAAAUGAUTT-3′,反义链:5′-AUCAUUUGUUCGC UCCAGGTT-3′;RNAi-2,正义链:5′-GCCUGCUACU-GUGUAUACATT-3′,反义链:5′-UGUAUACACAGU AGCAGGCTT-3′;RNAi-3,正义链:5′-GCUGGGCU AAGACUGUUAATT-3′,反义链:5′-UUAACAGUCU-UAGCCCAGCTT-3′;control siRNA,正义链:5′-UU-CUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGA CACGUUCGGAGAATT-3′,由上海吉玛公司合成。干粉siRNA用DEPC水溶解稀释成20 μmol·L-1,-20℃保存。HeLa细胞在含10%胎牛血清的DMEM培养基,在37℃、5%CO2培养箱中培养。转染前将细胞制成悬浮液接种于6孔板中在37℃、5%CO2培养箱中培养,当细胞生长到50%~60%时,加入4 μL的Lipofectamine和8 μL的siRNA溶液并补齐2 mL含10%胎牛血清的DMEM培养基培养48 h。实验共4组:RNAi-1组、RNAI-2组、RNA-3组以及control siRNA组。
1.2.3Western blot检测siRNA对ALEX1的干扰效率 收集转染siRNA 48 h后的HeLa细胞,并进行蛋白提取,采用BCA法测定蛋白浓度。按50 μg/孔蛋白量上样,经8%SDS-PAGE胶分离后,将目的蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h,加一抗4℃孵育过夜,TBST洗膜3次,每次15 min,再用二抗室温孵育2 h,ECL化学发光检测结果。
1.2.4流式细胞技术检测细胞周期 SiRNA转染HeLa细胞48 h后,胰酶消化收集各组细胞,1 000 r ·min-1离心5 min,弃上清液,PBS重悬清洗,1 000 r·min-1离心5 min,重复1次,再加入1 mL PBS混匀,转移至1.5 mL EP管中。最后加入5 μL An-nexin V-FITC,振荡均匀后4℃孵育15 min,再加入5 μL碘化丙啶(PI),孵育5 min,流式细胞仪检测细胞凋亡的情况,实验重复3次。
1.2.5流式细胞技术检测细胞凋亡 SiRNA转染HeLa细胞48 h后,胰酶消化收集各组细胞,1 000 r ·min-1离心5 min,弃上清液,PBS重悬清洗,1 000 r·min-1离心5 min,弃上清液,重复1次,体积分数为0.7乙醇重悬细胞,放置冰箱4℃,12 h。离心弃去上清,PBS清洗1次,加入含0.01%NaN 3和 0.1%BSA的缓冲液500 μL复溶细胞。加入2.5 μL RNase(100 mg·L-1),37℃孵育15 min,加入25 μL(10 μg·mL-1)PI染液,避光放置15 min。流式细胞仪检测分析各组细胞的DNA含量,计算细胞周期,实验重复3次。
1.2.6CCK-8测定细胞增殖 SiRNA转染HeLa细胞48 h后,胰酶消化重悬细胞,血球计数板计数细胞,以每孔3 000个细胞接种于96孔板中,每组3个复孔,待贴壁后分别测定0、24、48、72、96 h的细胞生长状况。每孔加入10 μL CCK-8试剂,37℃孵育2 h,酶标仪450 nm测定OD值。
1.2.7CCK-8检测细胞对白藜芦醇药物的敏感性SiRNA转染HeLa细胞48 h后胰酶消化重悬细胞,血球计数板计数细胞,以每孔3 000个细胞接种于96孔板中。配制浓度为1 mmol·L-1的白藜芦醇溶液,待贴壁后加入0、5、10、15 μL的白藜芦醇溶液,使其终浓度分别为0、50、100、150 μmol·L-1,按Promega公司的CCK-8测定细胞生长48 h的抑制率,每组3个复孔。每孔加入10 μL CCK-8试剂,37℃孵育2 h,酶标仪450 nm测定OD值。
1.2.8统计学分析 应用SPSS 17.0统计软件,数据以±s表示。两组数据间的比较采用独立样本t检验,多组数据间的比较采用单因素方差分析。
2 结果
2.1宫颈癌及其癌旁组织中ALEX1的表达检测通过免疫组化对比分析显示:与癌旁组织相比,癌组织中ALEX1的表达明显增加。此外,在癌旁组织中ALEX1的表达主要定位在细胞核中,而在癌组织中ALEX1的表达主要定位在细胞质中(Fig 1)。表明ALEX1在宫颈中的表达情况与宫颈是否发生癌变有关,推测ALEX1参与宫颈癌的发生和形成。
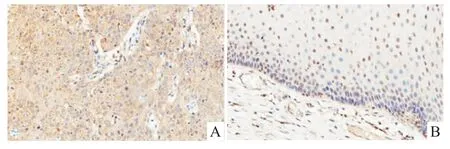
Fig 1 ALEX1 protein expression in cervical cancer tissues and adjacent non-cancerous tissues
2.2siRNA对ALEX1干扰效率的检测 Western blot结果显示:与对照组相比,实验组RNAi-3中ALEX1的蛋白表达明显下降(Fig 2)。说明在3组干扰序列中RNA-3的干扰效率最好,后续实验干扰
采用RNA-3序列。
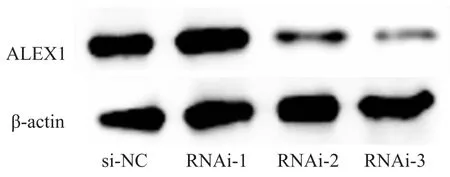
Fig 2 Efficiency of siRNA silencing of ALEX1 gene detected by Western blot
2.3沉默ALEX1基因表达,检测HeLa细胞周期变化 流式细胞检测周期结果显示:空白组和对照组中S期细胞比例分别为16.53%和14.41%,G2期细胞比例分别为7.38%和8.30%。实验组中S期细胞比例为30.00%,G2期细胞比例为1.72%。空白组与对照组相比,差异无统计学意义;实验组与对照组和空白组相比较,S期细胞明显增多,G2期细胞明显减少,差异有统计学意义(P<0.05),表明沉默ALEX1的表达阻滞HeLa细胞的周期进程(Fig 3)。
2.4沉默ALEX1基因表达,检测HeLa细胞凋亡变化 流式细胞检测凋亡结果显示:空白组和对照组中凋亡率分别为2.31%和3.15%,实验组凋亡比例分别为16.41%。空白组与对照组相比,差异无统计学意义;实验组与对照组和空白组相比较,凋亡明显增多,差异有统计学意义(P<0.05),表明沉默ALEX1的表达促进HeLa细胞的凋亡发生(Fig 4)。
2.5沉默ALEX1基因表达,检测HeLa细胞增殖变化 CCK-8结果显示:与对照组和空白组相比较,实验组在72、96 h细胞生长明显受抑制,差异有统计学意义(P<0.05),表明沉默ALEX1的表达抑制HeLa细胞的增殖(Fig 5)。
2.6沉默ALEX1基因表达,检测HeLa细胞对白藜芦醇敏感性变化 CCK-8结果显示:与对照组和空白组相比较,实验组在细胞生长明显受抑制,特别当浓度为50、100 μmol·L-1抑制最为明显,表明沉默ALEX1的表达能提高HeLa细胞对白藜芦醇的敏感性,增加白藜芦醇对HeLa细胞的致死能力(Fig 6)。
3 讨论
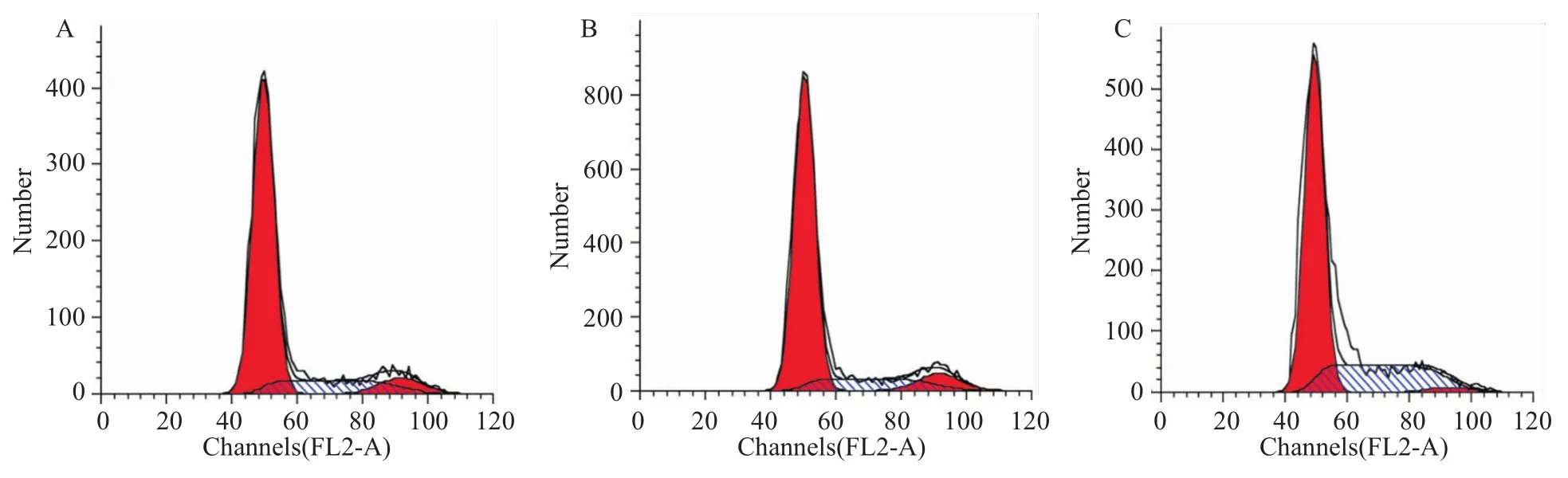
Fig 3 Cell cycle distribution detected by flow cytometric analysis
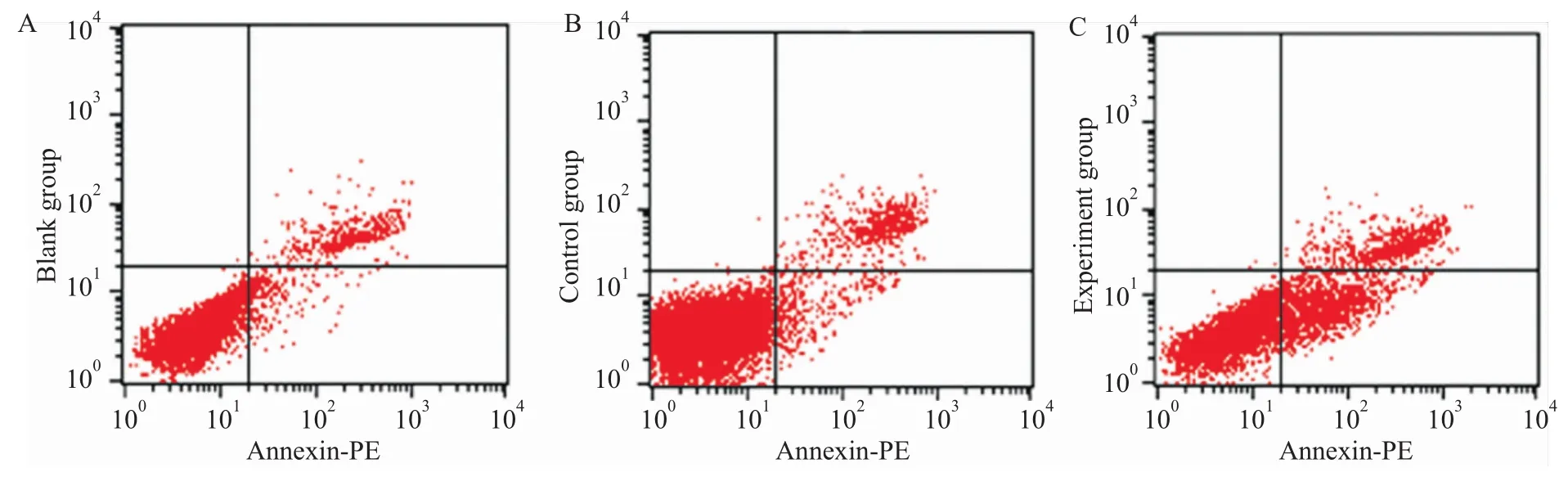
Fig 4 Cell apoptosis distribution detected by flow cytometric analysis
Armadillo repeat结构首次发现于果蝇极性基因armadillo,该基因在果蝇胚胎形成、维持上皮组织完
整性和早期细胞极性形成中起重要作用[10]。Arm repeat结构的特点是在真核和原核生物中都具有保守的三维结构,其结构是由大约42个氨基酸形成3 个α-螺旋,再由前后2个Arm repeat结构相互折叠,形成1个右手超螺旋结构[11]。Arm repeat蛋白家族是指含有多个Armadillo repeat结构的蛋白家族,其家族蛋白在肿瘤形成、发展、细胞间通讯,维持组织完整性等多方面发挥着重要作用[12]。

Fig 5 Effects of ALEX1 silence on cell growth in HeLa cells analysed by CCK-8
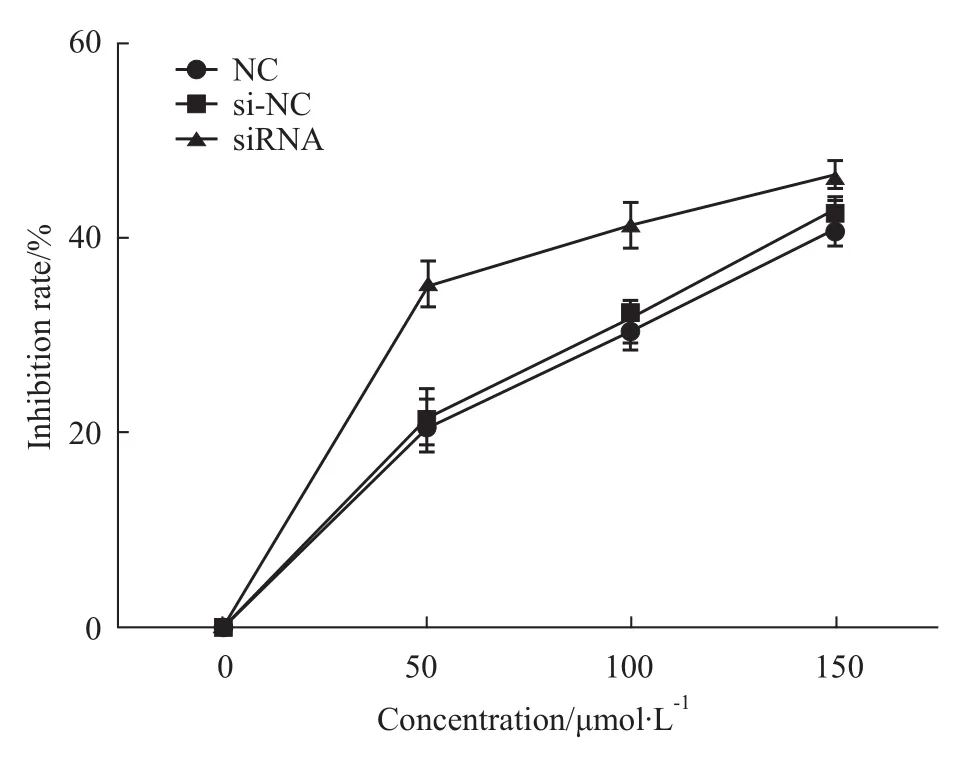
Fig 6 Effects of ALEX1 silence to resveratrol on cell growth in HeLa cells analysed by CCK-8
ALEX1蛋白是Kurochin在用酵母双杂交技术寻找与pp110蛋白相互作用时发现的,属于Arm re-peat蛋白家族新成员。ALEX1在Xq21.33-q22.2上,其基因全长为4.2 kb,含有4个外显子,编码着453个氨基酸,蛋白质分子质量为49 ku,含有两个arm repeat结构,包括8个潜在的蛋白激酶C和5个酪蛋白激酶Ⅱ结合位点[7-8]。近年来研究表明,ALEX1能够抑制人直肠癌细胞的克隆形[9],ALEX1 mRNA在心脏、脑、睾丸、前列腺、卵巢、结肠等大多正常组织组织中高表达,在人肿瘤组织中没有表达或低于其正常组织的表达。在细胞系中,ALEX1 mRNA在胶质瘤细胞系和骨肉瘤细胞系中有表达,在永生上皮细胞系、肺癌细胞系和乳腺癌细胞系中不表达,而在正常的乳腺上皮细胞系中有表达[7,13]。这些研究表明ALEX1基因有可能参与了肿瘤的发生发展。
2010年日本学者Iseki等[9]在直肠癌中研究ALEX1基因时发现:在直肠癌和胰腺癌中环腺苷反应元件和E-box基因定点突变会削弱ALEX1基因启动子的活性,过表达反应元件结合蛋白和过表达β-catenin能促进ALEX1基因的表达。表明环腺苷反应元件和E-box是调控ALEX1基因启动子的重要元件,ALEX1基因本身是被反应元件结合蛋白和β-catenin蛋白调节的。除此之外ALEX1也受Wntβ-catenin信号通路的调控[8]。
为了探讨ALEX1基因在宫颈癌中的表达情况以及对宫颈癌细胞生物学作用的影响。本研究采用免疫组化检测ALEX1在宫颈癌及其癌旁组织中的表达情况,应用siRNA干扰技术研究ALEX1对宫颈癌HeLa细胞的生物学形态影响。研究结果发现,ALEX1在宫颈癌组织中的表达高于其对应癌旁组织,沉默ALEX1表达后,HeLa细胞的周期、增殖受到抑制、促进HeLa细胞凋亡的发生,同时增强了白藜芦醇对HeLa细胞的抑制作用,说明ALEX1与宫颈癌的发生发展有着密切联系。Wnt/β-catenin信号通路异常活化是肿瘤重要发病原因之一,Wnt/β-catenin通路可以通过调控核内β-catenin的累积,激活Wnt相关靶基因[14]。ALEX1基因在宫颈癌中的激活,也有可能是Wnt/β-catenin异常活化所导致的。此外,本研究还发现,沉默ALEX1后能增强白藜芦醇对HeLa细胞增殖的抑制作用,这可能是因白藜芦醇降低了细胞内的β-catenin蛋白水平,从而抑制了Wnt/β-catenin通路的活性[15],导致ALEX1的表达受抑制,促进了细胞的凋亡。
本研究首次证明,ALEX1在宫颈癌组织中高表达于其癌旁组织,沉默ALEX1能够抑制宫颈癌细胞的增殖能力,这些结果为进一步研究ALEX1在肿瘤的发生发展中的作用及其机制奠定了理论基础。同时,ALEX1有望能作为一个新的宫颈癌标志物,用于临床诊断和基因药物的开发。
(致谢:本实验完成于重庆医科大学分子医学与肿瘤研究中心,在此感谢本实验室的老师及实验管理人员,同时也
感谢我的指导老师宋方洲教授在实验过程的指导及帮助。)
参考文献:
[1] Barnett K B,McRee A L,Reiter P L,et al.Cervical cancer pre-vention services at college health centers:historically black colle-ges and universities(HBCUs)compared to predominantly white institutions(PWIs)[J].Cancer Epidemiol Biomarkers Prev,2015,24:758-72.
[2] Bhatt A N,Mathur R,Farooque A,et al.Cancer biomarkers-cur-rent perspectives[J].Indian J Med Res,2010,132:129-49.
[3] Senapathy J G,Umadevi P,Kannika P S.The present scenario of cervical cancer control and HPV epidemiology in India:an outline [J].Asian Pac J Cancer Prev,2011,12(5):1107-15.
[4] Sun Z Q,Wang H J,Zhao Z L,et al.Significance of HPV infec-tion and genic mutation of APC and K-ras in patients with rectal cancer[J].Asian Pac J Cancer Prev,2013,14(1):121-6.
[5] Striegl H,Andrade-Navarro M A,Heinemann U.Armadillo motifs involved in vesicular transport[J].PLoS One,2010,5(2):e8991.
[6] Choi H J,Weis W I.Structure of the armadillo repeat domain of plakophilin 1[J].J Mol Biol,2005,346(1):367-76.
[7] Kurochkin I V,Yonemitsu N,Funahashi S I,et al.ALEX1,a novel human armadillo repeat protein that is expressed differential-ly in normal tissues and carcinomas[J].Biochem Biophys Res Commun,2001,280(1):340-7.
[8] Iseki H,Takeda A,Andoh T,et al.Human Arm protein lost in epithelial cancers,on chromosome X 1(ALEX1)gene is tran-scriptionally regulated by CREB and Wnt/beta-catenin signaling [J].Cancer Sci,2010,101(6):1361-6.
[9] Iseki H,Takeda A,Andoh T,et al.ALEX1 suppresses colony formation ability of human colorectal carcinoma cell lines[J].Cancer Sci,2012,103(7):1267-71.
[10]Riggleman B,Wieschaus E,Schedl P.Molecular analysis of the armadillo locus:uniformly distributed transcripts and a protein with novel internal repeats are associated with a Drosophila seg-ment polarity gene[J].Genes Dev,1989,3(1):96-113.
[11]Ketal M.Importin alpha nuclear localization signal binding sites for STAT1,STAT2,and influenza A virus nucleoprotein[J].J Biol Chem,2003,278(30):28193-200.
[12]Hatzfeld M.The armadillo family of structural proteins[J].Int Rev Cytol,1999,186:179-224.
[13]Zender L,Xue W,Zuber J,et al.An oncogenomics-based in vivo RNAi screen identifies tumor suppressors in liver cancer[J].Cell,2008,135(5):852-69.
[14]朱智杰,阮君山,李 尧,等.Wnt信号通路诱导肿瘤细胞上皮间质转化的研究进展[J].中国药理学通报,2012,28(7):904 -7.
[14]Zhu Z J,Ruan J S,li R,et al.Research progress of Wnt signaling pathway induced EMT in tumor cells[J].Chin Pharmacol Bull,2012,28(7):904-7.
[15]袁霜雪,王东旭,伍秋香,等.白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J].中国药理学通报,2015,31(4):537-41.
[15]Yuan X X,Wang D X,Wu Q X,et al.Study on the relationship between anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J].Chin Pharmacol Bull,2015,31(4):537-41.
ALEX1 expression in cervical cancer tissues and effect of ALEX1 on cervical cancer cell biology behavior
ZENG Fan,WU Jia-yan,GAO Yue,ZHANG Han-tao,BAI Xin,LIU Ge-li,SONG Fang-zhou
(Dept of Biochemistry and Molecular Biology,Chongqing Medical University,Chongqing 400016,China)
Abstract:Aim To investigate ALEX1 gene expres-sion in cervical cancer tissues and adjacent non-can-cerous tissues,and to explore the ALEX1 genetic influ-ence on cell proliferation,cycle and apoptosis of human cervical cancer cell line HeLa.Methods ALEX1 protein expression in cervical cancers and in non-can-cerous cervical tissues was evaluated using immunohis-tochemical method.A small interference RNA targeting ALEX1 gene was transfected into HeLa cells′,and the effect of ALEX1 interference on HeLa cells′cycle and apoptosis was analysed by flow cytometry.The effect of ALEX1 interference on HeLa cells′proliferation and sensitivity to resveratrol was analysed by CCK-8 assay.Results ALEX1 protein expression was significantly increased in cervical cancer tissues compared with non-cancerous tissues.HeLa cells′proliferation was inhibi-ted compared with control group and blank group.He-La cells′sensitivity to resveratrol was enhanced com-pared with control group blank group.Conclution SiRNA silencing of ALEX1 gene could significantly in-hibit HeLa cells′proliferation and enhance resveratrol ability of inhibiting HeLa cells′proliferation.
Key words:ALEX1;cervical cancer;resveratrol;siRNA;cell proliferation;cell apoptosis;cell cycle
作者简介:曾 帆(1988-),男,硕士,研究方向:肿瘤基因功能,E-mail:zengf719@163.com;宋方洲(1956-),男,博士,教授,博士生导师,研究方向:肿瘤基因功能,通讯作者,Tel:023-68485958
基金项目:高等学校博士学科点专项科研基金资助课题(No 20125503110012)
收稿日期:2015-06-29,修回日期:2015-07-20
文献标志码:A
文章编号:1001-1978(2015)10-1447-05
doi:10.3969/j.issn.1001-1978.2015.10.024
