3-酰胺基喹唑啉酮类化合物合成与环氧合酶-2分子对接抗炎活性预测研究
2015-02-22马养民任德成付方辉
张 金, 刘 佳, 马养民, 任德成, 李 姣, 付方辉
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
3-酰胺基喹唑啉酮类化合物合成与环氧合酶-2分子对接抗炎活性预测研究
张金, 刘佳, 马养民, 任德成, 李姣, 付方辉
(陕西科技大学 化学与化工学院 教育部轻化工助剂化学与技术重点实验室, 陕西 西安710021)
摘要:采用以纳米氧化铜为催化剂,乙醇为溶剂,靛红酸酐、酰肼、芳香醛为底物,80 ℃条件下一锅法合成得到了一系列3-酰胺基喹唑啉酮类化合物,产物通过核磁共振氢谱、核磁共振碳谱、红外等手段进行结构表征.利用Autodock 4.0分子对接软件对得到的系列化合物进行分子对接模拟.结果显示其对参与生物体抗炎活动的环氧合酶-2(COX-2)有潜在的抑制活性,可以作为一种潜在的抗炎药物.
关键词:3-酰胺基喹唑啉酮类化合物; 环氧合酶-2; 分子对接; 抗炎活性
Synthesis and molecular docking analysis of
0引言
环氧合酶-1(COX-1)和环氧合酶-2(COX-2)是参与生物体抗炎过程中两种重要的异构酶[1].选择性环氧合酶-2(COX-2)抑制剂是新型非甾体(NSAIDS)抗炎药,能避免传统抗炎药导致的胃溃疡、出血等副作用,成为目前的研究热点[2-4].以COX-2酶的选择性抑制药物celecoxib[5]为先导,近年来对以噻唑、咪唑、吡啶、嘧啶、喹唑啉酮等为中心环三环骨架类的COX-2选择性抑制剂研究比较广泛[6-10].其中喹唑啉酮类化合物是一种重要的含氮杂环类化合物,大约有150种从天然产物中分离的生物碱具有喹唑啉酮环骨架[11].
基于一些天然产物喹唑啉酮类化合物rutaecarpine和tryptanthrin等[12]已报道的抗炎活性,2011年,E.Manivannan等[7]设计合成一系列2,3-二芳基取代的喹唑啉酮类化合物,结果显示2,3-二芳基喹唑啉酮是一类潜在的抗炎药物新骨架;2014年一系列基于席夫碱取代,苯环上有不同取代基的喹唑啉酮类化合物经研究显示有抗炎活性,尤其是苯环上有硝基和氯原子吸电子基团取代时有更强的活性[13].K.Deepak等[14]合成一系列N杂和噻唑类取代的喹唑啉酮类化合物,研究结果显示这类化合物是一种潜在的非甾体类抗炎镇痛药物.2013年,Mieria1 I.等[15]合成出3位酰胺基取代的喹唑啉酮类化合物,并对其抗氧化能力进行研究.
本研究选取一种简洁高效合成喹唑啉酮类化合物的方法,采用纳米氧化铜作为一种高效绿色可回收的催化剂,以喹唑啉酮环为骨架,在2位和3位引入不同电性的取代基,合成系列3-酰胺基喹唑啉酮类化合物.并利用Autodock 4.0分子对接软件[16],将10种化合物与COX-2酶(PDB:1CX2)[17]活性位点进行对接模拟,对其活性进行预测,为下一步生物实验进行理论铺垫,与原有的配体SC558进行比较,探索分子结构与活性的构效关系,推测其抗炎作用机理,可指导设计新的具有抗炎活性的药化合物.
1实验部分
1.1 试剂和仪器
(1)试剂:纳米CuO(粒径40 nm),北京德科岛金;靛红酸酐,萨恩化学技术有限公司;对甲氧基苯甲酰肼,北京偶合科技有限公司;3-吡啶甲酰肼,北京偶合科技有限公司;苯甲醛,天津市化学试剂二厂;对甲氧基苯甲醛,国药集团化学试剂有限公司;间硝基苯甲醛,北京偶合科技有限公司;肉桂醛,国药集团化学试剂有限公司;香草醛,天津市百世化工有限公司;枯茗醛,上海晶纯试剂;对二甲氨基苯甲醛,阿拉丁试剂有限公司;无水乙醇,天津市河东区红岩试剂厂.所用试剂均为分析纯.
(2)仪器:XT5型显微熔点仪,北京市科仪电光仪器厂;VECTOR-22型傅立叶红外光谱仪,德国布鲁克Bruker公司;ADVANCE Ⅲ 400 MHz核磁共振仪,TMS内标,德国Bruker公司;旋转蒸发仪,上海亚荣科技有限公司;DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司.
1.2 3-酰胺基喹唑啉酮类化合物的合成与表征
1.2.1合成方法
称取1.5 mmol靛红酸酐,1.5 mmol芳香酰肼,1.6 mmol芳香醛,以3 mL的无水乙醇为溶剂,5 mol%纳米氧化铜为催化剂.在80 ℃条件下反应5 h.反应结束后,利用柱层析(乙酸乙酯和石油醚不同梯度洗脱)对产物分离纯化,粗品进一步重结晶得到纯净的化合物.
1.2.2表征
化合物采用核磁共振氢谱、核磁共振碳谱、红外等手段进行结构表征.
(1)2-苯基-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4a)
白色固体,熔点:204 ℃~206 ℃;1H NMR (400 MHz,CDCl3) δ8.29 (s,1H),8.00(d,J=7.7 Hz,1H),7.66-7.52(m,3H),7.51(s,1H),7.39(dd,J=15.5 8.3 Hz,4H),6.96(dd,J=17.8,10.1 Hz,2H),6.78(d,J=8.7 Hz, 2H),6.69(d,J=8.1 Hz,1H),6.42(s,1H),3.81(s,3H).13C NMR (101 MHz,CDCl3)δ163.94,162.11,146.12,136.94,133.90,129.43,128.91,128.74,128.53,128.37,128.23,127.43,127.05,119.08,114.05,113.19,74.57,54.87;IR(KBr)νmax:3 296,3 066,3 007,2 965,2 930,2 838,2 047,1 907,1 652,1 580,1 510,1 385,1 294,1 176,1 109,1 030,896,837,750,603,551,485,415 cm-1.
(2)2-(4-甲氧基苯基)-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4b)
白色固体,熔点:193 ℃~195 ℃;1H NMR (400 MHz,DMSO)δ10.26(s,1H),7.70(d,J=7.8 Hz,1H),7.62(d,J=8.8 Hz,2H),7.45(d,J=8.6 Hz,2H),7.35(dd,J=11.8,4.8 Hz,1H),7.27(s,1H),6.95(t,J=9.0 Hz,4H),6.80(dd,J=16.3,8.0 Hz,2H),6.11(s,1H),3.79(s,3H),3.74(s,3H);13C NMR(101 MHz,DMSO)δ164.85,163.35,161.94,159.80,148.06,133.82,129.96,129.40,129.31,127.99,124.32,117.69,114.55,113.78,113.53,113.45,74.06,55.34,55.13;IR(KBr)νmax:3 301,3 009,2 837,1 609,1 503,1 459,1 392,1 316,1 289,1 258,1 174,1 111,1 027,844,754,699,626,511 cm-1.
(3)2-(3-硝基苯基)-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4c)
黄色固体,熔点:219 ℃~221 ℃;1H NMR (400 MHz,DMSO)δ10.40(s,1H),8.43(s,1H),8.26(dd,J=8.2,1.6 Hz,1H),7.96(d,J=7.7 Hz,1H),7.77~7.72(m, 1H),7.69(t,J=7.9 Hz,1H),7.63(d,J=8.8Hz,2H),7.51 (s,1H),7.42~7.32(m,1H),6.96(d,J=8.9 Hz,2H),6.83(dd,J=7.7,6.0 Hz,2H),6.34(s,1H),3.79(s,3H);13C NMR (101 MHz,DMSO)δ164.96,162.76,162.10,153.17,147.53,147.39,140.62,134.80,134.18,129.88,129.29,128.01,124.02,123.97,122.69,118.15,114.66,113.64,73.51,55.35;IR(KBr)νmax:3 363,3 200,2 980,2 840,1 640,1 532,1 441,1 348,1 260,1 179,1 097,1 026,846,753,683,615,548,526 cm-1.
(4)2-(4-(二甲基氨基)苯基)-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4d)
白色固体,熔点:185 ℃~186 ℃;1H NMR (400 MHz,DMSO)δ10.19 (s,1H),7.70(dd,J=7.8,1.2 Hz,1H),7.65(d,J= 8.9 Hz,2H),7.33(q,J=3.2 Hz,3H),7.16(s,1H),6.95(d,J=8.9 Hz,2H),6.82(d,J=8.1 Hz, 1H),6.77(t,J=7.5Hz,1H),6.69(d,J=8.8 Hz,2H),6.06(s,1H),3.79(s,3H),2.88(s,6H).13C NMR (101 MHz,DMSO)δ164.86,163.46,161.92,150.95,148.21,133.69,129.35,128.83,127.98,125.09,124.51,114.52,113.84,113.49,111.59,74.34,55.33,40.02.IR(KBr)νmax:3 276,2 998,2 829,1 641,1 506,1 254,1 176,751,599 cm-1.
(5)2-(4-异丙基苯基)-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4e)
白色固体,熔点:196 ℃~198 ℃;1H NMR (400 MHz,DMSO)δ11.66(s,1H),10.26(s,1H),8.43(s,1H),7.92(d,J=8.8 Hz,1H),7.77~7.62(m,2H),7.60(d,J=8.9 Hz,1H),7.45(d,J=8.1 Hz,1H),7.33(dd,J=13.8,6.7 Hz,2H),7.26(d,J=8.1 Hz,1H),7.07(d,J=8.8 Hz,1H),6.94(d,J=8.9 Hz,1H),6.79(dd,J=14.2,7.7 Hz,1H),3.84(s,3H),3.01~2.85(m,1H),1.23(d,J=6.9 Hz,6H).13C NMR (101 MHz,DMSO)δ163.14,161.95,149.37,147.94,135.67,133.83,132.13,129.35,128.01,127.06,126.77,126.09,117.63,114.52,113.77,113.48,74.25,55.40,33.34,23.64. IR(KBr)νmax:3 263,2 962,1 650,1 606,1 505,1 282,1 254,1 023,1 179,1 060,843,618 cm-1.
(6)2-苯乙烯基-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4f)
淡黄色固体,熔点:179 ℃~181 ℃;1H NMR(400 MHz,DMSO)δ10.57(s,1H),7.86(t,J=16.0 Hz,2H),7.68(t,J=10.5 Hz,1H),7.43(d,J=7.1 Hz,2H),7.40~7.31(m,3H),7.28(d,J=7.2 Hz,1H),7.24(d,J=10.0 Hz,1H),7.01(d,J=8.9 Hz,2H),6.84(d,J=8.0 Hz,1H),6.77(t,J=7.5 Hz,1H),6.71(d,J=15.8 Hz,1H),6.45(dd,J=15.8,7.7 Hz,1H),5.64(d,J=7.5 Hz,1H),3.80(s,3H).13C NMR(101 MHz,DMSO)δ164.81,162.07,147.43,135.62,133.81,133.51,129.40,128.68,128.24,127.89,126.64,125.95,124.38,117.59,115.59,114.67,113.74,113.67,73.59,55.35.IR(KBr)νmax:3 409,3 263,2 968,2 838,1 648, 1 500,1 258,1 029,837,749,685,592,481 cm-1.
(7)2-(4-羟基-3-甲氧基苯基)-3-(4-甲氧基苯甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4g)
白色固体,熔点:201 ℃~202 ℃;1H NMR(400 MHz,DMSO)δ10.18(s,1H),7.90(d,J=8.8 Hz,1H),7.71(d,J=6.4 Hz,1H),7.61(d,J=8.9 Hz,2H),7.39~7.31(m,1H),7.22(s,1H),7.14(d,J=1.9 Hz,1H),7.06(d,J =8.8 Hz,1H),6.96(d,J=8.9 Hz,2H),6.85(t,J=6.7 Hz,2H),6.79(t,J=7.1 Hz,1H),6.71(d,J=8.0 Hz,1H),6.06(s,1H),3.87~3.82(m,3H),3.81~3.77(m,3H).13C NMR(101 MHz,DMSO)δ164.81,163.49,161.92,148.12,147.36,133.76,129.40,129.24,128.46,127.99,125.78,124.49,121.06,117.67,115.44,114.62,113.87,113.54,111.79,74.42,55.33.IR(KBr)νmax:3 329,2 962,2 835,1 666,1 607,1 259,1 029,854,762,534 cm-1.
(8)2-苯乙烯基-3-(3-吡啶甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4h)
淡黄色固体,熔点:187 ℃~188 ℃.1H NMR(400 MHz,DMSO)δ8.98(d,J=1.6 Hz,1H),8.74(dd,J=4.8,1.5 Hz,1H),8.26(d,J=4.9 Hz,1H),8.22~8.15(m,1H),7.70(d,J=6.9 Hz,1H),7.53(dd,J=8.0,5.0 Hz,1H),7.45(d,J=7.3 Hz,2H),7.40~7.33(m,3H),7.32(d,J=3.2 Hz,1H),7.29(d,J= 7.2 Hz,1H),6.85(d,J=8.1 Hz,1H),6.79(d,J=7.3 Hz,1H),6.73(s,1H),6.46(dd,J=15.8,7.8 Hz,1H),5.67(d,J=7.7 Hz,1H).13C NMR(101 MHz,DMSO)δ164.07,162.20,152.56,148.37,147.44,135.53,135.25,133.84,128.82,128.70,128.05,127.93,127.13,126.68,125.64,123.66,117.68,114.74,113.50,73.57.IR(KBr)νmax:3 193,2 998,2 815,1 611,1 515,1 293,1 182,982,757,691 cm-1.
(9)2-(4-(二甲基氨基)苯基-3-(3-吡啶甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4i)
淡黄色固体,熔点:193 ℃~195 ℃;1H NMR(400 MHz,DMSO)δ10.58(s,1H),8.70(s,2H),7.97(dt,J=8.0,1.9 Hz,1H),7.72(dd,J=7.8,1.2 Hz,1H),7.49(dd,J=7.9,4.9 Hz,1H),7.39~7.31(m,3H),7.27(s,1H),6.84(d,J=8.0 Hz,1H),6.79(t,J=7.5 Hz,1H),6.72(d,J=8.8 Hz,2H),6.07(s,1H),2.89(s,6H),13C NMR(101 MHz,DMSO)δ164.07,163.39,152.38,151.07,148.31,148.26,135.17,133.89,128.88,128.12, 128.03,124.62,123.56,119.56,117.64,114.63,113.60,111.62,74.30,40.02.IR(KBr)νmax:3 192,2 998,1 611,1 482,1 293,1 183,982,892,759,705 cm-1.
(10)2-(4-羟基-3-甲氧基苯基)-3-(3-吡啶甲酰胺基)-2-氢喹唑啉-4(1H)-酮(4j)
淡黄色固体,熔点:187 ℃~189 ℃.1H NMR(400 MHz,DMSO)δ10.55(s,1H),9.25(s,1H),8.76~8.64(m,2H),7.95(dt,J=7.9,1.9 Hz,1H),7.73(dd,J=7.8,1.2 Hz,1H),7.49(dd,J=7.8,4.8 Hz,1H),7.36(dd,J=11.2,4.2 Hz,1H),7.32(s,1H),7.16(d,J=1.8 Hz,1H),6.91~6.84(m,2H),6.81(t,J=7.5 Hz,1H),6.75(d,J=8.0 Hz,1H),6.08(s,1H),3.76(d,J=8.5 Hz,3H).13C NMR(101 MHz,DMSO)δ164.02,163.36,152.42,148.19,148.18,147.55,147.36,135.08,133.94,128.13,128.04,123.58,121.14,117.80,114.70,113.64,111.73,74.39,55.51.IR(KBr)νmax:3 343,1 643,1 501,1 370,1 265,1 033,851,757,587 cm-1.
1.3 3-酰胺基喹唑啉酮与COX-2环氧合酶的分子对接实验
为了说明合成得到的3-酰胺基喹唑啉酮类化合物具有潜在的抑制COX-2酶的作用,选用分子对接软件Autodock 4.0模拟化合物对COX-2活性位点的结合作用,对接实验中使用拉马克遗传算法进行计算,获得最小结合能以及抑制常数.最小结合能及抑制常数的大小可为判断并筛选出潜在抗炎活性较好的化合物提供理论依据.通过进一步分析化合物与COX-2的蛋白活性位点的氨基酸间的氢键作用,推测其潜在抗炎的作用机理.
2结果与讨论
2.1 3-酰胺基喹唑啉酮的合成
如表1所示,在纳米氧化铜催化下,乙醇作为溶剂成功合成得到了10种3-酰胺基喹唑啉酮.首先,选用对甲氧基苯甲酰肼作为氮源,与不同芳香醛反应得到了7种相应化合物(如表1中4a~4g所示),产物产率较好,连有供电子基团的芳香醛对应产物产率比连有吸电子基团的芳香醛的产物产率高.进一步考察芳杂酰肼对反应的影响,选用3-吡啶甲酰肼作为底物与之反应得到了3种化合物,产率优良(如表1中4h~4j所示).

表1 3-酰胺基喹唑啉酮系列化合物的合成
2.2 分子对接结果分析
对接的每个配体得到排名前十的构象,选取最佳构象进行具体分析如表2所示.
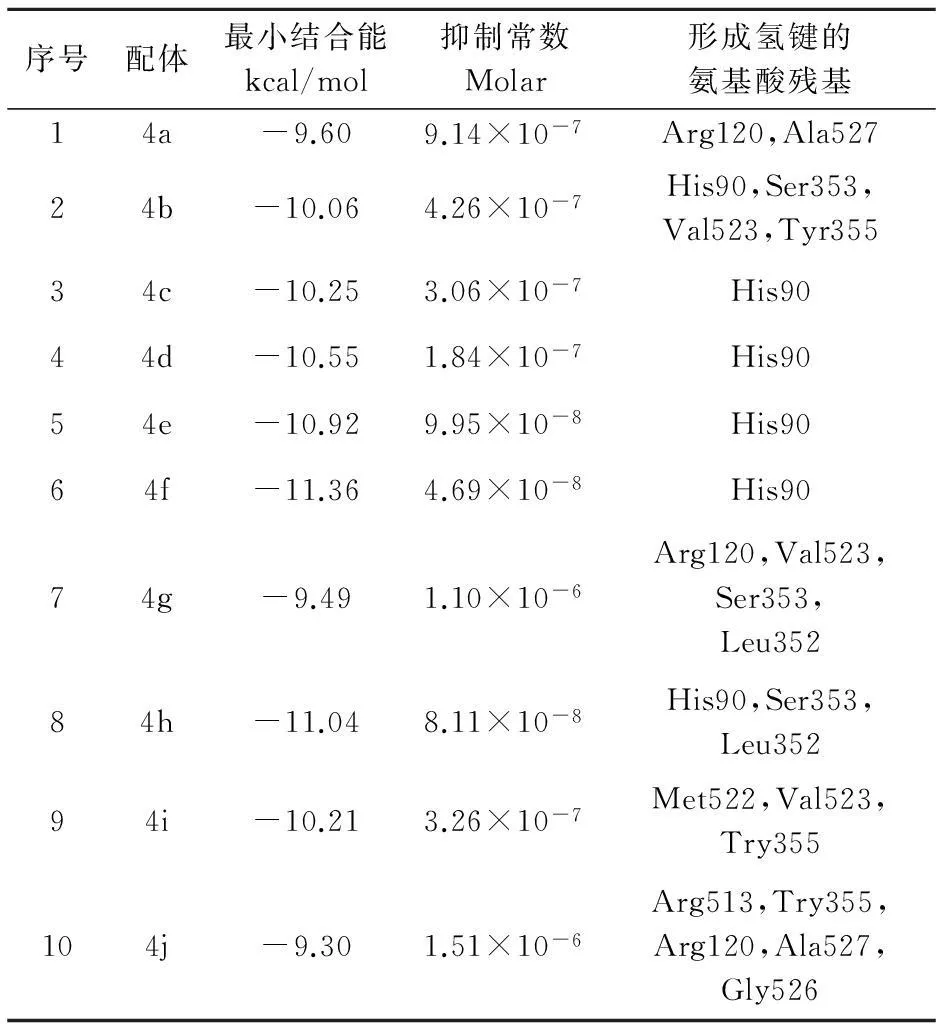
表2 3-酰胺基喹唑啉酮类化合物与COX-2酶分子对接结果
从表2计算结果可知,所有化合物的最小结合能绝对值均大于9 kcal/mol,抑制常数均在微摩数量级,与氨基酸残基His90,Arg120,Leu352,Ser353等有氢键作用,因此,预测所有化合物均对COX-2蛋白有较好的抑制效果.
由表2可知,3号位对甲氧基苯甲酰胺基取代的化合物与3-吡啶酰胺基取代的化合物相比,其与COX-2蛋白的结合能较高.在芳环取代基上引入供电子基团会使最小结合能绝对值略有增加(如表2中4a~4f所示),但在喹唑啉酮2号位的苯环上引入羟基时,由于化合物与蛋白质之间疏水作用的减弱从而导致与蛋白质结合能的减小(如表2中4g与4j所示);当喹唑啉酮环的2号位被苯乙烯基取代时,化合物结合能相对较小(如表2中4f和4h所示),由此可以预测具有双键的化合物的抗炎活性较好,这与文献[13]中的结论是一致的.
将化合物4f和4h的对接构象与原配体SC558比较分别如图1和图2所示.从图中可知,化合物4f和4h对接时的构象与原选择性配体SC558的三环骨架对接方式基本吻合.其中4f与氨基酸残基His-90形成分子间氢键,4h与氨基酸残基His90,Ser353,Leu352形成氢键.氢键的作用增加了分子间的亲和力,增加了化合物与蛋白质的结合能,从而预测此系列化合物的抗炎活性较好,为进一步的生物实验进行理论支持.
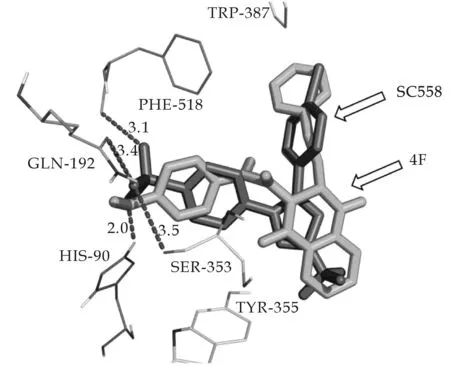
图1 化合物4f与原COX-2配体SC558比较

图2 化合物4h与原COX-2配体SC558比较
3结论
本文采用一种简洁高效的合成方法获得了一系列3-酰胺基喹唑啉酮类化合物.得到的系列化合物与COX-2蛋白(PDB:1CX2)分子对接模拟结果显示,所有化合物均具有潜在的抗炎活性,此类化合物可以作为一种潜在的抗炎药物.尤其在3-酰胺基喹唑啉酮的2位被苯乙烯基取代时,化合物与蛋白质间结合能最小,预测其潜在抗炎活性最好,这为进一步优化生物实验和分子结构提供理论支持.
参考文献
[1] J.R.Vane,Y.S.Bakhle,R.M.Botting.Cyclooxygenases 1 and 2[J].Annual Review of Pharmacology and Toxicology,1998,38(1):97-120.
[2] A.Kulik,K.Bykov,N.K.Choudhry,et al.Non-steroidal anti-inflammatory drug administration after coronary artery bypass surgery:Utilization persists despite the boxed warning[J].Pharmacoepidemiology and Drug Safety,2015,24(6):647-653.
[3] H.Yuhara,D.A.Corley,F.Nakahara,et al.Aspirin and non-aspirin NSAIDs increase risk of colonic diverticular bleeding:A systematic review and meta-analysis[J].Journal of Gastroenterology,2014,49(10):1 440.
[4] 王海为,李剑勇,杨亚军,等.非甾体抗炎药物研究进展[J].动物医学进展,2011,31(1):77-80.
[5] T.D.Penning,J.J.Talley,S.R.Bertenshaw,et al.Synthesis and biological evaluation of the 1,5-diarylpyrazole class of cyclooxygenase-2 inhibitors:Identification of 4-[5-(4-Methylphenyl)-3-(trifluoromethyl)-1H-pyrazol-1-yl]benzenesulfonamide (SC-58635,Celecoxib)[J].Journal of Medicinal Chemistry,1997,40(9):1 347-1 365.
[6] G.Dannhardt,W.Kiefer.Cyclooxygenase inhibitors-current status and future prospects[J].European Journal of Medicinal Chemistry,2001,36(2):109-126.
[7] E.Manivannan,S.C.Chaturvedi. Analogue-based design, synthesis and molecular docking analysis of 2,3-diaryl quinazolinones as non-ulcerogenic anti-inflammatory agents[J].Bioorganic & Medicinal Chemistry,2011,19(15):4 520-4 528.
[8] E.Rajanarendar,S.Rama Krishna,D.Nagaraju, et al. Environmentally benign synthesis,molecular properties prediction and anti-inflammatory activity of novel isoxazolo[5,4-d]isoxazol-3-yl-aryl-methanones via vinylogous henry nitroaldol adducts as synthons[J].Bioorganic & Medicinal Chemistry Letters,2015,25(7):1 630-1 634.
[9] S.A.Galal,S.H.Khairat,F.A.Ragab,et al.Design, synthesis and molecular docking study of novel quinoxalin-2(1H)-ones as anti-tumor active agents with inhibition of tyrosine kinase receptor and studying their cyclooxygenase-2 activity[J].European Journal of Medicinal Chemistry,2014,86:122-132.
[10] 李秀艳,郑艳,李顺来,等.新型二芳基取代-1,2,4-三唑类化合物的抗炎构效关系和分子对接研究[J].计算机与应用化学,2008,25(5):603-606.
[11] S.B.Mhaske,N.P.Argade.The chemistry of recently isolated naturally occurring quinazolinone alkaloids[J].Tetrahedron,2006,62(42):9 787-9 826.
[12] R.Nanthakumar,P.Muthumani,K.Girija.Anti-inflammatory and antibacterial activity study of some novel quinazolinones[J].Arabian J.Chem.,2014,7(6):1 049-1 054.
[13] K.P.Rakesh,H.M.Manukumar,D.C.Gowda.Schiff's bases of quinazolinone derivatives:Synthesis and SAR studies of a novel series of potential anti-inflammatory and antioxidants[J].Bioorganic & Medicinal Chemistry Letters,2015,25(5):1 072-1 077.
[14] K.Deepak,L.Roshan,R.Sarita.Synthesis of some new substituted azetidinonyl and thiazolidinonyl quinazolon-4(3H)-ones as potential non-steroidal anti-inflammatory and analgesic agents[J].International Journal of Innovation and Applied Studies,2014,8(4):1 798-1 813.
[15] Mierina I,Tetere Z,Zicane D,et al.Synthesis and antioxidant activity of new analogs of Quin-C1[J].Chemistry of Heterocyclic Compounds,2013,48:1 824-1 831.
[16] G.M.Morris,R.Huey,W.Lindstrom,et al.AutoDock4 and AutoDockTools4:Automated docking with selective receptor flexibility[J].Journal of Compute Chemistry,2009,30(16):2 785-2 791.
[17] R.G.Kurumbail,A.M.Stevens,J.K.Gierse,et al.Structural basis for selective inhibition of cyclooxygenase-2 by anti-inflammatory agents[J].Nature,1996,384(6 610):644-648.
3-acylaminoquinazolin-4(1H)-ones as potential
anti-inflammatory agents
ZHANG Jin, LIU Jia, MA Yang-min, REN De-cheng,
LI Jiao, FU Fang-hui
(College of Chemistry and Chemical Engineering, Key Laboratory of Auxiliary Chemistry & Technology for Chemical Industry, Ministry of Education, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:3-Acylaminoquinazolin-4(1H)-ones were synthesised by a one-pot three components reaction of isatoic anhydride,aldehydes and hydrazides in the presence of nano-CuO in ethanol. The structures of products were characterized by1H-NMR,13C-NMR,IR spectrum. The results of molecular docking showed that all the compounds have potential anti-inflammatory inhibitory activity by Autodock 4.0.
Key words:3-acylaminoquinazolin-4(1H)-ones; cyclooxygenases-2; molecular docking; anti-inflammatory activity
作者简介:张金(1985-),男,黑龙江北安人,讲师,博士,研究方向:反应方法学
基金项目:陕西省科技厅自然科学基础研究计划项目(2014JQ2064); 陕西科技大学博士科研启动基金项目(BJ12-26)
*收稿日期:2015-09-13
中图分类号:O626
文献标志码:A
*文章编号:1000-5811(2015)06-0094-05
