半胱胺抑制催乳素依赖性肿瘤的机制
2015-02-19蒋忠军
王 松, 蒋忠军, 包 铮, 胡 聂, 罗 平
半胱胺抑制催乳素依赖性肿瘤的机制
王松,蒋忠军,包铮,胡聂,罗平

【摘要】目的通过半胱胺(Cysteamine,CS)对体外催乳素依赖性肿瘤细胞的影响与催乳素受体(prolactin receptor,PRLr)的相关性研究,来探讨CS抑制催乳素依赖性肿瘤的机制。方法以人宫颈癌CasKi细胞株、乳腺癌MDA-MB-231细胞株、结肠癌SW480细胞株为研究对象,MTT法检测CS对细胞增殖的影响,Western Blot检测CS对各细胞中PRLr的表达量影响,直线相关统计分析CS的细胞增殖抑制率与PRLr表达量的关系。结果102mmol/L的CS细胞增殖抑制率最高,10-5mmol/L以下无增殖抑制作用,抑制效益呈剂量依赖性;CS对催乳素依赖性肿瘤细胞的抑制作用在24h时细胞抑制率最高,且对宫颈癌CasKi细胞株增殖抑制作用最大,乳腺癌MDA-MB-231细胞株次之,结肠癌SW480细胞株最低。PRLr在宫颈癌CasKi细胞株中表达量最高,乳腺癌MDA-MB-231细胞株次之,结肠癌SW480细胞株最低;CS抑制宫颈癌CasKi细胞株、乳腺癌MDA-MB-231细胞株增殖的效应与抑制hPRLr的表达成负相关。结论低浓度CS能在体外抑制催乳素依赖性肿瘤宫颈癌CasKi细胞、乳腺癌MDA-MB-231细胞的增殖,可能与降低细胞内的PRLr表达水平有关。
【关键词】半胱胺;催乳素;催乳素受体;宫颈癌;乳腺癌;结肠癌;直线相关分析
Mechanisms of cysteamine inhibit prolactin-dependent tumorsWANGSong,JIANGZhongjun,BAOZheng,HUNie,LUOPing.(DepartmentofThyroidandBreastoncologicalsurgery,AffiliatedNanhuaHospital,UniversityofSouthChina,Hengyang421002,China)
Correspondingauthor:JIANGZhongjun,E-mail: 284065205@qq.com
Abstract:ObjectiveThis study was to investigate the relationship between the effects of CS and prolactin-dependent tumor cells in vitro and PRLr,so as to explore inhibition mechanism of CS on prolactin-dependent tumors. MethodsCervical cancer CasKi cells、breast cancer MDA-MB-231 cells and colon cancer SW480 cells were treated with different concentrations of CS,cell proliferation rate was detected by MTT assay,the expression of PRLr was detected by using Western blot,the relationship between cell proliferation rate and expression of PRLr was detected by linear correlation statistical analysis.Results102mmol/L CS had highest rate of cell proliferation,but 10-5mmol/L and lower had not,it showed a dose-dependent inhibition efficiency;the cell inhibition rates of CS in 24 h to prolactin-dependent tumor cells were the highest,largest on cervical cancer cell,followed on breast cancer,minimum on colon cancer,the same as the expression of PRLr. The cell proliferation inhibition of cervical cancer,breast cancer and the expression of PRLr had a negative correlation.ConclusionsThe low concentration CS could inhibit prolactin-dependent tumor cells on CasKi cervical cancer,breast cancer MDA-MB-231 cells in vitro,with the relevant of decreased levels intracellular expression of the PRLr.
Keywords:Cysteamine;prolactin;prolactin receptor;cervical cancer;breast cancer;colon cancer; Linear correlation analysis
半胱胺(Cysteamine,CS)是一种氨基硫醇类抗氧化剂,具有多种细胞活性,如对生长抑素、催乳素、生长激素、胰岛素、甲状腺激素等多种激素都产生影响,从而起到调节内分泌、调节免疫、抗氧化、缓解应激等生理效应[1-2]。研究表明,作为已知的化疗增敏剂和辐射保护剂CS具有体外抑制多种肿瘤细胞增殖的作用[3],但其具体抗肿瘤机制尚不清楚。近年来研究发现,催乳素(prolactin,PRL)有促进宫颈癌、乳腺癌、前列腺癌细胞增殖的作用[4-6],而CS是体内的PRL抑制剂。因此,CS是否对宫颈癌、乳腺癌、前列腺癌等激素依赖性肿瘤细胞具有抑制作用,并且其抑制效果是否与PRL水平以及催乳素受体(prolactin receptor,PRLr)表达水平有关,目前尚不明确,也未见有CS对激素依赖性肿瘤细胞抑制效果以及机制的研究报道。本研究将从PRLr表达水平上来研究CS对激素依赖性肿瘤细胞的抑制作用,期待初步阐明相关机制。
1材料与方法
1.1细胞来源与主要试剂
人宫颈癌CasKi细胞购自中南大学湘雅中心实验室,人乳腺癌MDA-MB-231细胞、人结肠癌SW480 细胞购自上海市中科院细胞库,上述细胞均保存在南华大学肿瘤研究所;抗人催乳素受体(anti-hPRLr,90kDa)半胱胺盐酸盐、抗β-actin(anti-β-actin,42 kDa) 购自Sigma-Aldrich公司。
1.2方法
1.2.1细胞培养3种细胞均以含10%小牛血清和1×105IU/L青霉素及1×105IU/L链霉素的 RPMI-1640培养基培养于37 ℃、5%CO2、饱和湿度培养箱中,细胞单层贴壁生长,2~3 d传代 1次。取对数生长期细胞用于实验。
1.2.2MTT比色法实验分为9组。空白对照组:加入细胞及培养基,用生理盐水处理;CS组:浓度分别为102~10-5mmol/L 8个浓度组。MTT比色法测定细胞增殖抑制率,取生长良好、对数生长期的3种癌细胞用于实验,以0.25%胰酶消化后制成单细胞悬液,调整浓度至5×105个/ml,接种于96孔培养板,每孔100 μl,每组5个平行孔,置于37 ℃、5%CO2、饱和湿度培养箱中培养,培养 24 h后,更换培养基,加入CS,之后置于培养箱中培养24 h,在培养结束前4 h于培养板中每孔加入5 g/L的MTT液20 μl,继续置于培养箱中培养。终止培养后,轻轻吸弃孔内培养上清液,每孔加入DMSO 150 μl,置于振荡器上震荡10 min,待紫蓝色沉淀充分溶解,于酶标仪570 nm波长测吸光度值(A值),计算细胞抑制率(细胞抑制率=1-用药组A值/对照组A值×100%)。
1.2.3蛋白质印迹法检测PRLr蛋白的表达实验分为4组。空白对照组:加入细胞及培养基,用生理盐水处理;CS组:分别为10-4、10-2和100mmol/L 3个浓度组。取培养24 h处于对数期的细胞提取细胞总蛋白。
1.3统计学方法
2结果
2.1MTT法检测细胞抑制率结果分析
CS对宫颈癌CasKi细胞、乳腺癌MDA-MB-231细胞、结肠癌 SW480 细胞增殖的作用比较见表1。
由表1显示,10-4~102mmol/L CS能抑制CasKi细胞、MDA-MB-231细胞增殖(P<0.05),在10-4~101mmol/L CS之间抑制效应具有浓度依赖性(P<0.05),但在101~102mmol/L CS之间无浓度依赖性(P>0.05);10-1~102mmol/L CS能抑制SW480细胞增殖,100~101mmol/L CS有浓度依赖性(P<0.05),但10-4~10-2mmol/L CS没有抑制效应(P>0.05),10-5mmol/L CS表现为促进细胞增殖(P<0.05)。
2.2蛋白质印迹法检测CS对3种肿瘤细胞系中PRLr表达差异的比较
图1及表2显示,在对照组中,CasKi、MDA-MB-231和SW480 细胞中PRLr表达的印迹区带的灰度面积扫描值分析,3种肿瘤细胞系中PRLr表达差异显著,以宫颈癌细胞中表达量最高,乳腺癌细胞次之,结肠癌细胞最低(P<0.05)。图2及表2示,100mmol/L、10-2mmol/L、10-4mmol/L CS对3种肿瘤细胞系中PRLr表达的印迹区带的灰度面积扫描值分析,3种浓度CS对CasKi细胞、MDA-MB-231细胞中PRLr表达差异有统计学意义(P<0.01),而对SW480 细胞中PRLr表达差异无统计学意义(P>0.05)。
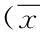
表1 CS对3种肿瘤细胞系的生长抑制作用的比较±s)
注:与对照组比较*P<0.05,相邻组间比较#P<0.05。
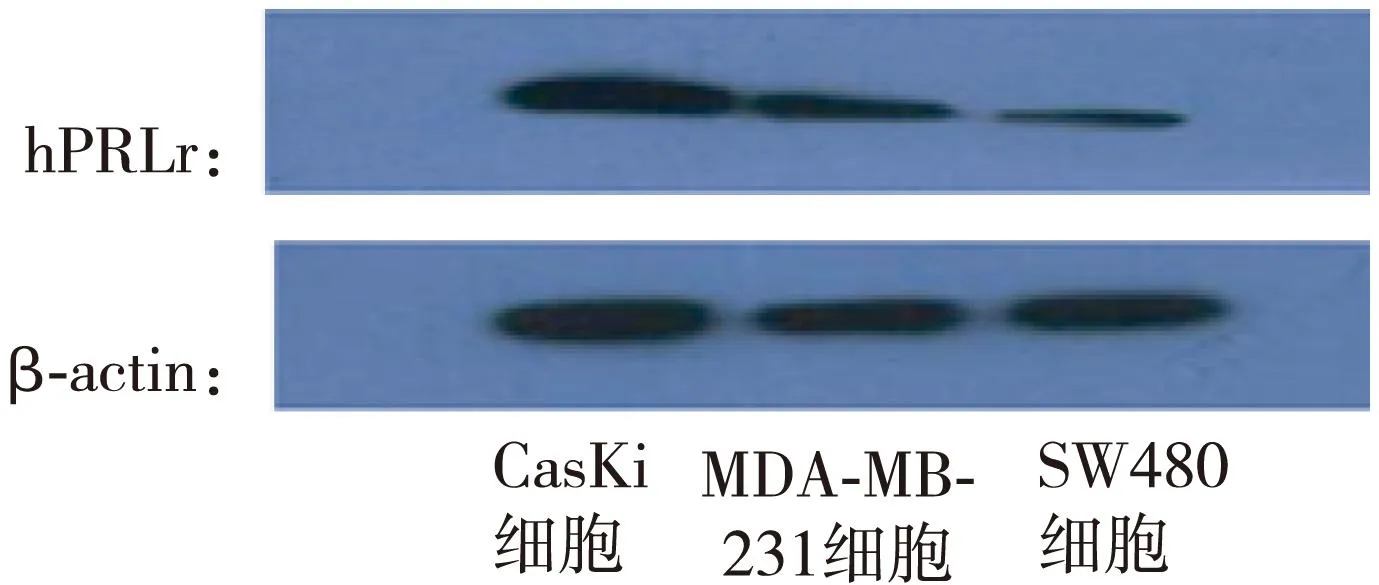
图1 hPRLr在3种肿瘤细胞中PRLr表达印迹区带图

图2 CS对3种肿瘤细胞系PRLr表达印迹区带图比较

表2 蛋白质印迹法检测CS对3种肿瘤细胞系中
注:与对照组比较*P<0.05,与对照组中CasKi细胞比较#P<0.05。
2.3CS的细胞抑制率与PRLr细胞表达量的相关性分析
图3显示,由spearman秩相关检验发现,CS的CasKi细胞、MDA-MB-231细胞增殖抑制率与该药处理前后细胞PRLr表达量呈负相关趋势(RCasKi=-0.928 6;RMDA-MB-231=-0.886 2,P<0.05),而在SW480细胞无相关趋势(RSW480<0.05;P>0.05),说明一定浓度的CS是通过调节PRLr表达来抑制CasKi细胞、MDA-MB-231细胞增殖的。
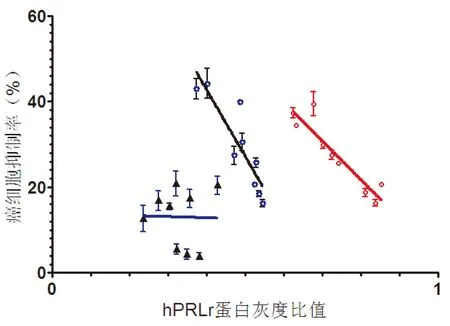
图3 CS的细胞抑制率与细胞中hPRLr表达量相关性分析比较图
3讨论
CS是细胞内抗氧化物,能有效地保护正常细胞,减轻放化疗的毒副作用,作为肿瘤放化疗的辅助用药已用于临床,安全性已经被证实。在体外实验中,CS本身或纳米颗粒或其他共轭化合物能抑制神经源性肿瘤、乳腺癌、黑色素瘤等细胞的增殖,由此预见CS的抗肿瘤研究前景可观[7-11]。
本研究结果表明,10-4~102mmol/L CS在体外抑制宫颈癌CasKi细胞与乳腺癌MDA-MB-231细胞、结肠癌SW480细胞的增殖,且在一定浓度范围内(10-4~101mmol/L)呈现浓度依赖性,这一结果与Dominy等[9]的实验结果相似。但是针对CS对乳腺癌、宫颈癌、结肠癌细胞的增殖抑制率差异比较中发现CS在体外抑制宫颈癌、乳腺癌细胞系的效应较结肠癌明显。而有研究发现宫颈癌CasKi细胞、乳腺癌MDA-MB-231细胞有一共同特征,是能够通过自分泌或者旁分泌PRL的细胞系,是PRL激素依赖性肿瘤[5]。而PRL具有促进乳腺癌、宫颈癌等肿瘤增殖生长的作用[12]。在本研究中我们发现低浓度(10-4~100mmol/L)的CS对宫颈癌、乳腺癌细胞增殖具有抑制作用,并且发现该浓度的CS可以抑制宫颈癌、乳腺癌细胞系中PRLr表达,从而可以说明CS是通过抑制细胞中PRL/PRLr信号通路来抑制肿瘤增殖的。
本研究还发现高浓度(10-1~102mmol/L)CS抑制结肠癌SW480细胞增殖,而低浓度(10-5mmol/L)CS却促进细胞增殖。此双重作用分析如下:高浓度CS抑制癌细胞增殖可能与CS的氧化性有关[2],亦可能与肿瘤细胞基质金属蛋白酶有关[13],低浓度(10-5mmol/L)CS促进癌细胞增殖作用可能与其抑制生长抑素有关[14]。目前研究证实,生长抑素及其类似物能通过抑制Wnt/β-catenin信号通路抑制结肠癌SW480细胞增殖,而CS是生长抑素抑制剂,所以揣测CS是通过耗竭生长抑素从而激活Wnt/β-catenin信号通路促进肿瘤细胞增殖[14],但是详细机制尚有待进一步深入研究。而Iishi等[15]研究发现,在动物实验中CS抑制结肠癌肿瘤增殖的机制可能与降低组织去甲肾上腺素的水平有关。
综上所述,本研究证实CS能在一定的低浓度范围内呈浓度依赖性地抑制宫颈癌、乳腺癌等催乳素依赖性癌细胞的增殖,且与PRLr表达水平有关,为CS治疗癌症患者提供了理论依据,同时也为研究CS在PRL/PRLr信号通路中的作用做了铺垫。由于本研究仅为体外细胞实验,CS的临床实用抗肿瘤作用机制还有待于进一步的动物实验及临床实验研究。
参考文献:
[1]蒋忠军.半胱胺的作用机制及应用研究进展[J].中国现代医药杂志,2011,13(6):124-126.
[2]Jeitner TM,Lawrence DA. Mechanisms for the cytotoxicity of cysteamine[J]. Toxicol Sci,2001,63(1):57-64.
[3]Inano H,Onoda M,Suzuki K,et al. Inhibitory effects of WR-2721 and cysteamine on tumor initiation in mammary glands of pregnant rats by radiation[J]. Radiat Res, 2000,153(1):68-74.
[4]Liby K,Neltner B,Mohamet L,et al. Prolactin overexpression by MDA-MB-435 human breast cancer cells accelerates tumor growth[J]. Breast Cancer Res Treat,2003,79(2):241-252.
[5]Leav I,Merk FB,Lee KF,et al. Prolactin receptor expression in the developing human prostate and in hyperplastic, dysplastic,and neoplastic lesions[J]. Am J Pathol, 1999,154(3):63-70.
[6]Nowak RA,Mora S,Diehl T,et al. Prolactin is an autocrine or paracrine growth factor for human myometrial and leiomyoma cells[J]. Gynecol Obstet Invest,1999,48(2):127-132.
[7]Ozcan Arican G. Cytoprotective effects of amifostine and cysteamine on cultured normal and tumor cells treated with paclitaxel in terms of mitotic index and 3H-thymidine labeling index[J]. Cancer Chemother Pharmacol, 2005,56(2):221-229.
[8]Inano H,Onoda M,Suzuki K,et al. Inhibitory effects of WR-2721 and cysteamine on tumor initiation in mammary glands of pregnant rats by radiation[J]. Radiat Res, 2000,153(1):68-74.
[9]Dominy JE Jr, Simmons CR, Hirschberger LL,et al.Discovery and characterization of a second mammalian thiol dioxygenase,cysteamine dioxygenase[J]. J Biol Chem, 2007, 282(35):25189-25198.
[10]Jeon JH, Lee HJ, Jang GY,et al.Different inhibition characteristics of intracellular transglutaminase activity by cystamine and cysteamine[J]. Exp Mol Med, 2004,36(6):576-581.
[11]Besouw M,Masereeuw R,van den Heuvel L,et al. Cysteamine: an old drug with new potential[J]. Drug Discov Today, 2013,18(15-16):785-792.
[12]何伟,魏钦俊,刘然,等. PRL促进乳腺癌细胞增殖及与microRNA表达谱变化的相关性研究[J]. 南京医科大学学报(自然科学版),2013,(3):303-307.
[13]Fujisawa T,Rubin B,Suzuki A,et al. Cysteamine suppresses invasion, metastasis and prolongs survival by inhibiting matrix metalloproteinases in a mouse model of human pancreatic cancer[J]. PLoS One, 2012,7(4):e34437.
[14]Song W, Zheng B, QingMo L, et al.Octreotide stimulate Somatostatin receptors induced apoptosis of SW480 colon cancer cells by activation of Glycogen Synthase Kinase-3β,A Wnt/β-catenin pathway modulator [J]. Hepato-gastroenterology,2013,60(127):13-20.
[15]Iishi H, Tatsuta M, Baba M, et al. Protection by oral phenylalanine against gastric carcinogenesis induced by N-methyl-N’-nitro-N-nitrosoguanidine in Wistar rats[J].Br J Cancer,1990,62(2): 173-176.
论著
[收稿日期:2015-04-24][本文编辑:李筱蕾]
文章编号:1674-4136(2015)04-0205-04
doi:10.3969/j.issn.1674-4136.2015.04.001
通讯作者:蒋忠军,男,硕士,主治医师,研究方向:乳腺甲状腺疾病防治研究,E-mail: 284065205@qq.com
基金项目:作者单位: 421002湖南衡阳,南华大学附属南华医院甲乳肿瘤外科;第一作者: 王松,男,硕士,主治医师,研究方向:乳腺甲状腺疾病防治研究,E-mail: wangmomo1983@sohu.com
