农杆菌介导的西瓜枯萎病菌遗传转化
2015-02-14任俊杰王丽霞高洪波吕桂云
任俊杰, 王丽霞, 高洪波, 吕桂云
(河北农业大学,保定 071001)
农杆菌介导的西瓜枯萎病菌遗传转化
任俊杰, 王丽霞, 高洪波, 吕桂云*
(河北农业大学,保定 071001)
为获得带GFP标记的西瓜枯萎病菌转化株,用于后期观察病原菌侵染过程,采用农杆菌介导的方法,对西瓜枯萎病菌1号生理小种进行了遗传转化。结果表明:共培养时间为36 h,枯萎病菌孢子和农杆菌AGL1比例为1∶1时该菌株的遗传转化效率最高,可以达到117.33个转化子/107个孢子。转化株的孢子、菌丝体及萌发的孢子均能发出稳定而强的绿色荧光。转化株的致病力检测显示其致病力与转化前的野生菌株致病力无明显差异。结果表明本研究获得的带GFP标记的西瓜枯萎病菌转化株可用于观察病菌在西瓜根系的侵染过程。
枯萎病菌; 西瓜; 遗传转化; 绿色荧光蛋白
西瓜枯萎病是由尖孢镰刀菌西瓜专化型(Fusarium oxysporumf.sp.niveum)引起的一种毁灭性土传真菌病害,在世界范围广泛发生,该病害在我国的发生面积约占西瓜总栽培面积的42%,是危害最为严重,造成经济损失最大的西瓜病害之一[1-3]。尖孢镰刀菌西瓜专化型共有4个生理小种,分别为0号、1号、2号和3号,目前在世界生产中造成危害的主要是1号生理小种[4-6]。
绿色荧光蛋白(green fluorescent protein,GFP)最早是从水母中分离出来的,在紫外或蓝光激发下发出绿色荧光,是目前能在活细胞中表达的发光蛋白之一[7]。GFP检测方便,荧光稳定,且可以进行活体无损伤检测。Skadsen等用GFP转化F.graminearum详细研究了其对大麦和拟南芥的侵染模式[8]。Lagopodi等运用GFP研究了番茄根腐病菌(F.oxysporumf.sp.radicis-lycopersici)对番茄根的侵染过程[9]。玉米与轮枝镰孢菌(F.verticillioides)早期互作过程[10],拟南芥(Arabidopsis thaliana)与病原菌Colletotrichum destructivum互作研究[11],都充分体现了GFP作为标记基因的优越性。根癌农杆菌介导的遗传转化已经被广泛地作为各种真菌插入突变的主要方法,目前在F.oxysporum0 685[12]、玉米大斑病菌[13]、甘蓝枯萎病菌[14]、香蕉枯萎病菌[15]及甜瓜蔓枯病菌[16]上都已建立了根癌农杆菌介导的遗传转化体系。肖荣凤利用PEG-CaCl2介导的原生质体转化方法,将gfp基因成功转入到西瓜枯萎病菌(F.oxysporumf.sp.niveum)FOV-135菌株中[17],但还未见关于西瓜枯萎病菌根癌农杆菌介导的gfp基因转化的报道。
本试验以西瓜枯萎病菌1号生理小种为材料,以根癌农杆菌AGL1为介导,将带有gfp基因T-DNA片段整合到西瓜枯萎病菌1号生理小种中,以期获得携带GFP标记的西瓜枯萎病菌转化子,为观察病原菌在西瓜抗、感寄主根系中的侵染过程提供工具,同时为揭示西瓜与枯萎病菌的互作和致病机理奠定基础。
1 材料和方法
1.1 材料
1.1.1 病原材料
西瓜枯萎病菌(Fusarium oxysporumf.sp.niveum)1号生理小种(FON1),为本实验室鉴定并保存。
1.1.2 根癌农杆菌的来源
Agrobacterium tumefaciensAGL1(带有pCH-sGFP质粒)由中国农业科学院蔬菜花卉研究所谢丙炎研究员惠赠,sGFP在来源于Cochliobolus heterostrophus的glyceraldehydes-3-phosphate dehydrogenase基因启动子下,筛选标记hygromycin B phosphotransferase基因(hph)在Aspergillus nidulanstrpC启动子下(图1)。

图1 pCH-sGFP质粒结构图Fig.1 Construction of the vector pCH-sGFP
1.1.3 植物材料
西瓜[Citrullus lanatus(Thunb.)Matsum.& Nakai]枯萎病的鉴别寄主材料‘Black Diamond’(感病,S),‘Sugar Baby’(感病,S),‘Crimson Sweet’(中抗,M),‘Charleston’(中抗,M),‘Calhoun Gray’(抗病,R),‘PI296341-FR’(抗病,R),用于对转化株进行致病力鉴定。
1.2 方法
1.2.1 根癌农杆菌及西瓜枯萎病菌1号生理小种(FON1)菌液的准备
1.2.1.1 根癌农杆菌的活化
取-80℃保存带有pCH-sGFP质粒的AGL1号农杆菌在YEB培养基上画线培养,挑取单菌落于液体MM培养基中,摇培20~24 h(28℃、200 r/ min)。离心集菌,将所集菌混到IM液体培养基,(调节A600至0.18~0.22),摇培约6 h,使A600达到0.3~0.45。
1.2.1.2 西瓜枯萎病菌孢子悬浮液的制备
将培养于PDA培养基中的枯萎病菌接种于PL培养基中,置于28℃恒温摇床中,125 r/min培养5 d后即可使用,用血球计数板计数,调整孢子浓度为5×106个/m L。
1.2.2 不同转化条件对转化效率的影响
枯萎病菌孢子和经诱导后的农杆菌AGL1不同比例的筛选:枯萎病菌孢子悬浮液5×106个/mL和经诱导后的农杆菌AGL1按1∶1、2∶1、1∶2三个比例混合,分别取400μL混合液均匀地涂到铺有灭菌滤纸条的共培养平板上,每个比例涂4个板,28℃下避光共培养36 h。将滤纸条揭下,反铺到含hygB(50μg/ mL)和头孢霉素(200μg/mL)的选择培养基(PDA培养基)上,28℃培养2~3 d。揭下滤纸条,在28℃培养1~3 d,每天检查是否有新的抗hygB的单菌落出现。挑取选择培养基上能抗hygB的单菌落至二筛板(含hygB的PDA培养基)上进一步筛选验证。
共培养时间筛选:枯萎病菌孢子悬浮液5×106个/mL和经诱导后的农杆菌AGL1按1∶1比例的混合菌液共培养时间分别设置为24、36、48、60 h,其他同上,最后分别进行转化效率的计算分析。
1.2.3 用荧光显微镜观察菌丝和分生孢子的荧光表型
将尖孢镰刀菌西瓜专化型转化菌株转接到添加hygB的PDA培养基平板上,观察生长情况。同时通过荧光显微镜观察菌丝和分生孢子的荧光强度。
1.2.4 对转化子的抗病性鉴定
6个西瓜枯萎病的鉴别寄主材料种子用1.5%次氯酸钠溶液消毒20 min,常规浸种和催芽。
接种:将西瓜枯萎病菌1号生理小种及其转化菌株配制成浓度为5×106个/mL的孢子悬浮液,西瓜播种8~10 d后待子叶展平时进行接种,采用浸根法接种15 min,每个野生菌株及其转化菌株接种30株,以无菌水接种为空白对照。接种后在温室26~30℃条件下培养,记录发病情况。
发病率(%)=萎蔫株数/调查株数×100[18]。
2 结果与分析
2.1 共培养条件对转化效率的影响
2.1.1 枯萎病菌孢子悬浮液和农杆菌AGL1比例对转化效率的影响
由图2可知,在共培养时间为36 h,枯萎病菌孢子悬浮液和诱导后的农杆菌AGL1比例为1∶2、2∶1时的转化效率分别为74.67、42.00个转化子/107个孢子,但当其比例为1∶1时,转化效率达到117.33个转化子/107个孢子,极显著高于其他比例处理。
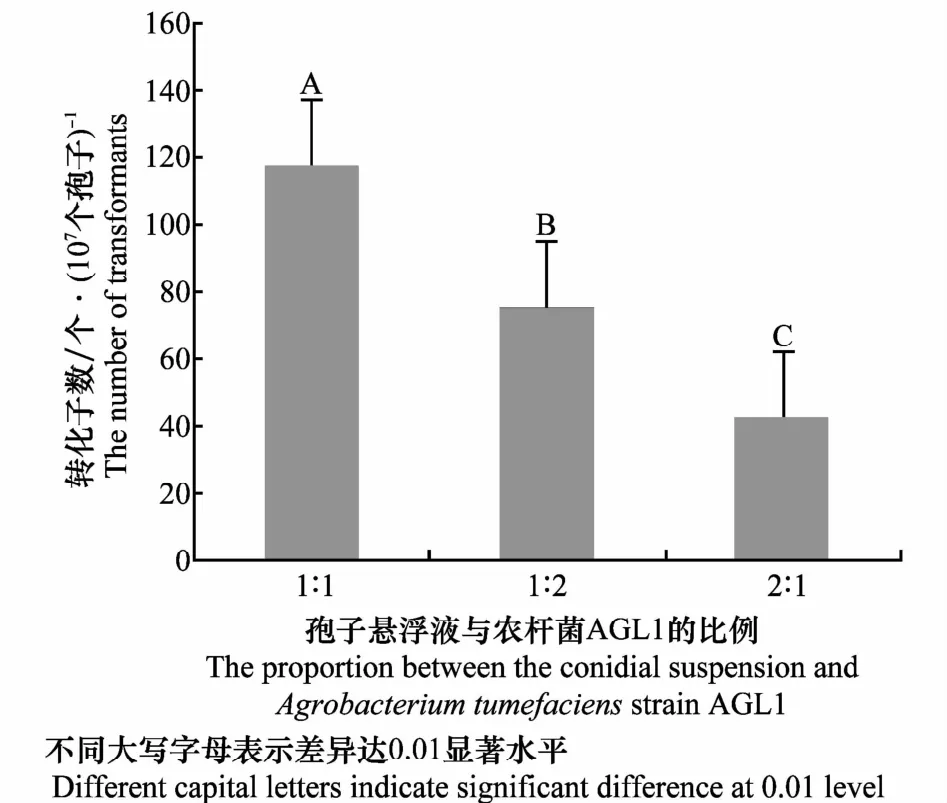
图2 孢子悬浮液与农杆菌AGL1比例对转化效率的影响Fig.2 Effects of the proportion between the conidial suspension andAgrobacterium tumefaciensstrain AGL1 on transformation efficiency
2.1.2 共培养时间对转化效率的影响
在枯萎病菌孢子悬浮液和农杆菌AGL1比例为1∶1的条件下,共培养24、48、60 h的转化效率分别为30.67、72.67、17.33个转化子/107个孢子(图3)。而共培养36 h的转化效率为117.33个转化子/107个孢子,极显著高于其他共培养时间下的转化效率,表明将西瓜枯萎病菌分生孢子与农杆菌AGL1共培养36 h转化效率最高。
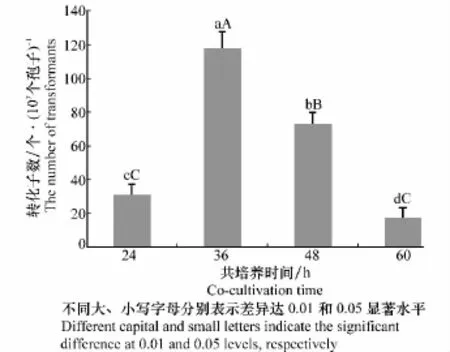
图3 共培养时间对转化效率的影响Fig.3 Effects of co-cultivation time on transformation efficiency
2.1.3 共培养条件
由以上两个条件的筛选可知,当孢子和诱导后农杆菌AGL1比例为1∶1,共培养时间为36 h时,转化效率高,当同时满足这两个条件时,转化效率达到最高,为117.33个转化子/107个孢子。
2.2 转化子的荧光检测
按前面叙述的方法,共获得西瓜枯萎病菌转化株352个,随机挑选出10个进行荧光观察,其转化株4号荧光表型如图4,转化子所有菌体包括菌丝(图4a)、分生孢子(图4b)、孢子萌发的芽管(图4c)、继代培养后的菌体都有稳定而强的荧光信号,但在细胞质中的液泡无荧光信号(图4d)。结果表明gfp在西瓜枯萎病菌的转化株中得到了稳定而持续的表达。选择菌丝、分生孢子荧光信号表达稳定而强的转化子5个,进行下一步研究。
2.3 转化子的致病力检测
对从2.2转化子的荧光检测中筛选出的5个转化株,通过人工接种,在无菌的条件下进行致病力的检测,由表1可见,其中4号转化子在不同品种上的致病力分别为85.67、93.00、67.67、52.33、10.00、5.00,与转化前的FON1在西瓜抗、感鉴别寄主上的表现无明显差异,将该菌株命名为FON1-sGFP,说明GFP的转化和表达对枯萎病菌4号转化子的致病力无明显影响。

图4 绿色荧光蛋白在西瓜枯萎病菌转化子中的表达Fig.4 Expression of green fluorescent protein in transformants of watermelonFusarium oxysporumf.sp.niveum

表1 FON1及转化子在西瓜抗、感寄主上致病力鉴定1)Table 1 Incidence of resistant and susceptible watermelon cultivars inoculated with transformants
3 小结与讨论
本试验是在参考前人关于根癌农杆菌介导的真菌转化方法的基础上进行的[12-16,19],成功地将gfp基因转化到西瓜枯萎病菌1号生理小种中,单孢继代培养多代后仍能够稳定遗传,且转化效率高,操作简单方便。
本研究最优良的转化条件为共培养时间36 h,枯萎病菌孢子的悬浮液和农杆菌AGL1比例为1∶1,转化效率可以达到117.33个转化子/107个孢子。这与其他病菌的转化条件不太相同,在玉米大斑病菌(Setosphaeria turcica)的转化中,张娇等得出在20℃条件下与根癌农杆菌共培养48 h,共培养介质为微孔滤膜时转化效果最佳[19]。香蕉枯萎病菌1号生理小种(F.oxysporumf.sp.cubenserace 1)遗传转化体系的最优转化体系是农杆菌A600为0.15,共培养时间为48 h[15]。甜瓜蔓枯病的最优转化体系为农杆菌悬浮液A600为0.15,共培养时间与香蕉枯萎病菌一致,病菌的分生孢子悬浮液浓度为1×106个孢子/mL[16]。Mullins[12]对尖孢镰刀菌的农杆菌转化的研究中表明,影响转化效率的因素主要有两个,一是共培养之前在培养基中加入乙酰丁香酮(AS);二是共培养时间,在培养基中加入AS,共培养时间为48 h时,转化效率最高,达到300~500个转化子/106个孢子,远远高于本试验的转化效率,可能是因为载体的构成不同造成的。肖荣凤等[17]利用PEG-CaCl2介导的原生质体转化体系,成功地将绿色荧光蛋白基因转入到西瓜尖孢镰刀菌FOV-135中,每微克质粒可获得4~6个转化子,转化效率较低。说明遗传转化效率与转化条件、转化方法、载体的构成及病菌本身的遗传特性等都有关系。
对转化株进行荧光观察,发现转化子菌体的菌丝、分生孢子、孢子萌发的芽管、继代培养后的菌体都具有稳定而强的荧光信号,但在细胞质中的液泡却无荧光信号,在荧光显微镜下呈暗黑色。在番茄的枯萎病菌[9](F.oxysporumf.sp.radicis-lycopersici)和水稻稻瘟病菌(Magnaporthe oryzae)[20]的gfp转化株中发现了同样现象。本试验获得的带gfp的西瓜枯萎病菌的转化株,可以用来观察病菌在寄主根系内的侵染过程,为进一步揭示西瓜与枯萎病菌的互作和致病机理提供了工具。
参考文献
[1] Miguel A,Maroto J V,San Bautista A,et al.The grafting of triploid watermelon is an advantageous alternative to soil fumigation by methyl bromide for control ofFusariumwilt[J]. Scientia Horticulturae,2004,103:9 17.
[2] 钱伟,余杭,孙耘子,等.西瓜砧木抗逆性研究[J].中国西瓜甜瓜,1995,1(4):8 10.
[3] 管怀骥,陈莉,丁克坚.几种药剂防治西瓜枯萎病的初步研究[J].安徽农学通报,2001,7(6):43 45.
[4] Martyn R D,Netzer D.Resistance to races 0,1 and 2 ofFusariumwilt of watermelon inCitrullussp.PI296341-FR[J]. HortScience,1991,26(4):429 432.
[5] Zhou X G,Everts K L,Bruton B D.Race 3,a new and highly virulent race ofFusariumoxysporumf.sp.niveumcausingFusariumwilt in watermelon[J].Plant Disease,2010,94(1):92 98.
[6] Zhang Z,Zhang J,Wang Y,et al.Molecular detection ofFusarium oxysporumf.sp.niveumandMycosphaerella melonisin infected plant tissues and soil[J].FEMS Microbiology Letters,2005,249(1):39 47.
[7] 徐进,莫明和,张克勤.绿色荧光蛋白(GFP)在真菌研究中的应用[J].生物技术,2004,14(6):74 77.
[8] Skadsen R W,Hohn T M.Use ofFusarium graminearumtransformed withgfpto follow infection patterns in barley andArabidopsis[J].Physiological and Molecular Plant Pathology,2004,64(1):45 53.
[9] Lagopodi A L,Ram A F,Lamers G E,et al.Novel aspects of tomato root colonization and infection byFusariumoxysporumf.sp.radicis-lycopersicirevealed by confocal laser scanning microscopic analysis using the green fluorescent protein as a marker[J].Molecular Plant-Microbe Interactions,2002,15(2):172 179.
[10]Oren L,Ezrati S,Cohen D,et al.Early events in theFusarium verticillioides-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate[J].Applied and Environmental Microbiology,2003,69(5):1695 1701.
[11]O′Connell R,Herbert C,Sreenivasaprasad S,et al.A novelArabidopsis-Colletotrichumpathosystem for the molecular dissection of plant-fungal interactions[J].Molecular Plant-Microbe Interactions,2004,17(3):272 282.
[12]Mullins E D,Chen X,Romaine P,et al.Agrobacterium-mediated transformation ofFusarium oxysporum:an efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,91(2):173 180.
[13]刘建光,王艳辉,张国珍,等.农杆菌介导的玉米大斑病菌的遗传转化[J].植物病理学报,2007,37(6):675 678.
[14]李二峰,王殿东,杨宇红,等.根癌农杆菌介导甘蓝枯萎病菌的遗传转化[J].中国蔬菜,2011,1(14):28 34.
[15]林妃,曾涛,曾会才.香蕉枯萎病菌1号生理小种遗传转化体系的建立[J].热带作物学报,2010,31(10):1790 1796.
[16]任海英,方丽,李岗,等.农杆菌介导的甜瓜蔓枯病菌遗传转化体系的建立[J].生物工程学报,2010,26(6):802 808.
[17]肖荣凤,朱育菁,李燕丹,等.西瓜尖孢镰刀菌FOV-135的绿色荧光蛋白基因转化[J].福建农业学报2009,24(6):521 524.
[18]耿丽华,郭绍贵,吕桂云,等.西瓜枯萎病菌生理小种鉴定技术体系的建立和验证[J].中国蔬菜,2010,1(20):52 56.
[19]张娇,谷守芹,李青为,等.根癌农杆菌介导的玉米大斑病菌转化条件的优化[J].河北农业大学学报,2010,33(4):85 88,108.
[20]Campos-Soriano L,San Segundo B.Assessment of blast disease resistance in transgenicPRmsrice using agfp-expressingMagnaporthe oryzaestrain[J].Plant Pathology,2009,58:677 689.
Agrobacterium tumefaciens-mediated transformation ofFusarium oxysporumf.sp.niveum
Ren Junjie, Wang Lixia, Gao Hongbo, LüGuiyun
(Agricultural University of Hebei,Baoding071001,China)
The purpose of this study is to obtain GFP-tagged transformants ofFusarium oxysporumf.sp.niveumrace 1,which can be used to study colonization of watermelon roots by the pathogen ofFusariumwilt.F.oxysporumf.sp.niveumrace 1 was transformed with the pCH-sGFP transformation vector usingAgrobacterium tumefaciensAGL1.The results indicated that the transformation efficiency was the highest at 117.33 transformants/107conidia when the mix was co-cultivated for 36 h with an equal volume of conidial suspension andA.tumefaciensAGL1.The expression of green fluorescent protein in the hyphae,conidia and germinating spores of the transformants were stable with strong green fluorescent signal.Pathogenicity tests confirmed that the mean disease severity caused by the isolate FON-sGFP was not significantly different from that of the wild-type isolate FON1.FON1-sGFP might be a useful tool for visualizing colonization process of watermelon roots byF.oxysporumf.sp.niveum.
Fusarium oxysporumf.sp.niveum; watermelon; transformation; green fluorescent protein
S 436.5
A
10.3969/j.issn.0529 1542.2015.01.018
2014 02 17
2014 05 28
国家自然科学基金项目(31201632);河北省自然科学基金项目(C2012204072);河北省高等学校科学技术研究青年基金项目(2011173)
*通信作者 E-mail:guiyunlv@hebau.edu.cn
