烟草叶片分泌物及植株挥发物释放规律研究
2015-02-14胡保文董文霞
李 祥, 杨 真, 胡保文, 戴 勋, 董文霞
(1.云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201;2.红塔烟草(集团)有限责任公司,玉溪 653100)
研究报告
烟草叶片分泌物及植株挥发物释放规律研究
李 祥1#, 杨 真1#, 胡保文2, 戴 勋2, 董文霞1*
(1.云南农业大学植物保护学院,农业生物多样性与病害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,昆明 650201;2.红塔烟草(集团)有限责任公司,玉溪 653100)
烟草次生物质不仅对多种害虫的定向、产卵等行为具有调控作用,还能吸引天敌进行间接防御。本研究利用溶剂漂洗法提取了烟草旺长期和成熟期的叶片分泌物,利用顶空吸附法收集了烟草旺长期植株的挥发物,并利用气相色谱(GC)/质谱(MS)联用技术测定了烟草次生物质的成分及含量。结果表明,烟草叶片分泌物中共检测出36种化合物,其中旺长期有33种,成熟期有31种。烟草旺长期植株挥发物中共检测出48种挥发物组分。其中36种组分的日周期释放规律表现为随光照加强和温度升高,释放量呈现上升趋势;11:00-15:00时段的释放量显著高于其他各个时段(P<0.05)。而其中9种组分表现为在夜间的释放量显著升高。
烟草; 溶剂漂洗法; 顶空吸附法; 次生物质
昆虫通常依靠自身的化学感受器与周围环境中的化学信息产生关联,为其寻找适宜的寄主植物,以达到最大程度的成功繁殖[1-2]。多数植食性昆虫向寄主植物的远距离定向和降落过程中,其嗅觉起主导作用,所依赖的嗅觉信息正是植物体释放的挥发性次生物质[3-4]。接触植物后,植食性昆虫便对植物表面的非挥发性次生物质和结构特征等做出评价,决定离开或进行取食、产卵等行为[5]。
烟草(Nicotiana tabacumLinnaeus)是我国重要的经济作物之一。大量研究表明,烟草次生物质不仅对烟夜蛾[Helicoverpa assulta(Guenée)]、棉铃虫[Helicoverpa armigera(Hübner)]、烟粉虱[Bemisia tabaci(Gennadius)]等昆虫的定向、产卵等行为具有显著的调控作用[6-9],某些挥发性次生物质还能吸引中红侧沟茧蜂[Microplitismediator(Haliday)]、棉铃虫齿唇姬蜂[Campoletis chlorideae(Uchida)]等天敌进行间接防御[10-12]。烟草提取物对朱砂叶螨[Tetranychus cinnabarinus(Boisduval)]、小菜蛾[Plutella xylostella(Linnaeus)]等害虫也具有一定的毒杀作用[13-15]。烟草上主要害虫烟夜蛾、马铃薯麦蛾[Phthorimaea operculella(Zeller)]等都具有昼伏夜出的活动规律,De Moraes等的研究表明,烟草挥发物在不同时段的释放差异,与其主要害虫的为害习性有明显的相关性[16]。
然而,关于烟草次生物质的研究,至今尚未有全面系统的报道。已有的研究主要集中在挥发物的提取与鉴定[17-19]。关于挥发性较弱的叶片分泌物成分,以及烟草次生物质在不同生育期和日周期不同时段的释放规律至今未见报道。本研究利用气相色谱(GC)/质谱(MS)联用技术测定了烟草次生物质的组成,明确了烟草旺长期与成熟期叶片分泌物的成分差异,以及烟草旺长期植株挥发性物质的成分及其日周期释放规律,为今后探明烟草次生物质与昆虫间的作用机理以及从化学生态学角度进行害虫防治提供一定的依据。
1 材料与方法
1.1 材料
烟草品种为‘K326’,是我国各大烟区广泛栽种的品种,烟草包衣种子由玉溪中烟种子有限责任公司提供。于2013年3月间在人工气候箱(FLI2000H型,日本EYELA公司)内采取漂浮育苗的方式进行催芽,出芽后移栽至云南农业大学温室种植,于2013年6月进行试验。烟草生长期间不喷施任何农药,植株长势良好。
1.2 方法
1.2.1 烟草不同生育期叶片分泌物的收集
溶剂漂洗法参照Udayagiri和Mason的方法[20],并稍作改进:试验前1 d用蒸馏水洗净试验所需的叶片,并覆盖保鲜袋。试验时,于12:00从温室剪取、称量50 g健康的烟草旺长期和成熟期中部叶片,在4个存有50 mL二氯甲烷(色谱纯,>99.9%,天津四友)的烧杯中依次漂洗叶片5~10 s,将漂洗液用滤纸过滤2遍,加入癸烷和乙酸苄酯各2 000 ng作为内标,用氮吹法浓缩至2 mL,于-20℃冷藏待用。上述所有试验操作均在冰盒中进行,重复4次,取等量二氯甲烷重复以上过程作为空白对照。
1.2.2 烟草旺长期植株挥发物的收集
烟草旺长期植株挥发物的收集采用动态顶空吸附法。试验时选取长势良好、无病虫害的旺长期植株6株,用保鲜膜和锡箔纸依次包裹土壤,在干燥洁净的玻璃干燥器中静置3 d,使其适应系统环境。试验前更换玻璃干燥器,并通气10 min去除其中的气味。玻璃干燥器上部通入两根装有吸附剂(700 mg Porapak Type Q,80~100 mesh,Waters)的巴斯德管,其中一根用Teflon管连接大气采样仪(QC-1S型,北京市劳动保护科学研究所);另一根与活性炭相连接,作为净化空气的入口。收集时,控制空气流量为600 mL/ min,连续吸附24 h,保持环境通风、无异味,光源为自然光。收集完成后的样品用2 mL正己烷(色谱纯,>98.0%,Merck)洗脱至棕色样品瓶中,加入癸烷和乙酸苄酯各2 000 ng作为内标,用氮吹法浓缩至100μL,于-20℃冷藏待用。重复4次,系统为空白对照。4次重复所用烟草植株的总重量(不含根系)依次为337.68、309.44、284.80、318.36 g。
1.2.3 烟草旺长期植株不同时段挥发物的收集
试验于2013年6月进行,此时,昆明市05:30天色开始变亮,06:30天色完全变亮;19:30天色开始变暗,20:30天色完全变暗。挥发物日周期释放规律试验于以下5个不同时段进行收集:A,06:30-10:30时段;B,11:00-15:00时段;C,15:30-19:30时段;D,20:30-00:30时段;E,01:00-05:00时段。每次试验前更换新的收集装置。收集方法参照1.2.2。4次重复所用烟草植株的总重量(不含根系)依次为94.53、113.62、109.76、99.67 g。
1.2.4 烟草叶片分泌物和植株挥发物组分的分离与鉴定
利用气相色谱(GC)/质谱(MS)联用仪(Agilent 6890A/5973MS,美国Agilent公司)对烟草叶片分泌物和挥发物进行分析,氢火焰离子检测器FID,色谱柱为HP-5毛细管柱(30 m×0.25 mm×0.25μm);程序升温:起始温度40℃,以3℃/min升温至80℃,再以5℃/min升温至260℃;柱前压100 kPa,载气为高纯氦气,流速1.0 mL/min,分流进样,分流比为10∶1,进样量2.0μL。质谱条件:EI离子源,电子能量70eV,质子扫描范围35~500 amu,四级杆温度150℃,离子源温度230℃,传输线温度250℃,柱压100 kPa。通过核对标准谱库(Wiley7n.l)与标准化合物的质谱图,根据标准化合物的保留时间对提取物组分进行定性分析;并通过峰面积归一法和内标法对各组分进行定量分析。
1.3 数据处理
试验数据采用Excel和SPSS 18.0软件进行分析,利用Duncan氏新复极差法进行显著性检验。
2 结果与分析
2.1 烟草不同生育期叶片分泌物的组成及含量
2.1.1 烟草不同生育期叶片分泌物的组成及含量
利用溶剂漂洗法从烟草叶片分泌物中共计检测出36种化合物。其中旺长期叶片中共检测出33
种,成熟期叶片中共检测出31种。在烟草不同生育期叶片分泌物中均存在的化合物有28种。烟草旺长期叶片中特有的化合物为十三烷、十四烷、十五烷、邻苯二甲酸二(2-乙基己基)酯、苯并噻唑;烟草成熟期叶片中特有的化合物为1-十八碳烯、十四烷酸、4-甲基苯乙酮(表1)。
烟草不同生育期叶片分泌物组分主要包括萜类、芳香族和脂肪族化合物;其中脂肪族化合物不仅含量较高,而且种类丰富,包括烃类、酸类、酰胺类、酯类和醛类化合物,其中以烃类化合物的含量最高(表1)。烟草从旺长期至成熟期间,其叶片分泌物总量呈上升趋势,但两者不存在显著差异(P>0.05)。随着烟草的生长,叶片分泌物成分中,萜类、酸类化合物含量逐渐上升,芳香族、酯类化合物含量逐渐下降,在烟草旺长期和成熟期间存在显著差异(P<0.05)(表1)。烟碱在叶片分泌物所有组分中含量最高,也是变化量最大的物质,在旺长期和成熟期时,其含量分别占提取物总量的15.00%和24.01%(表1)。
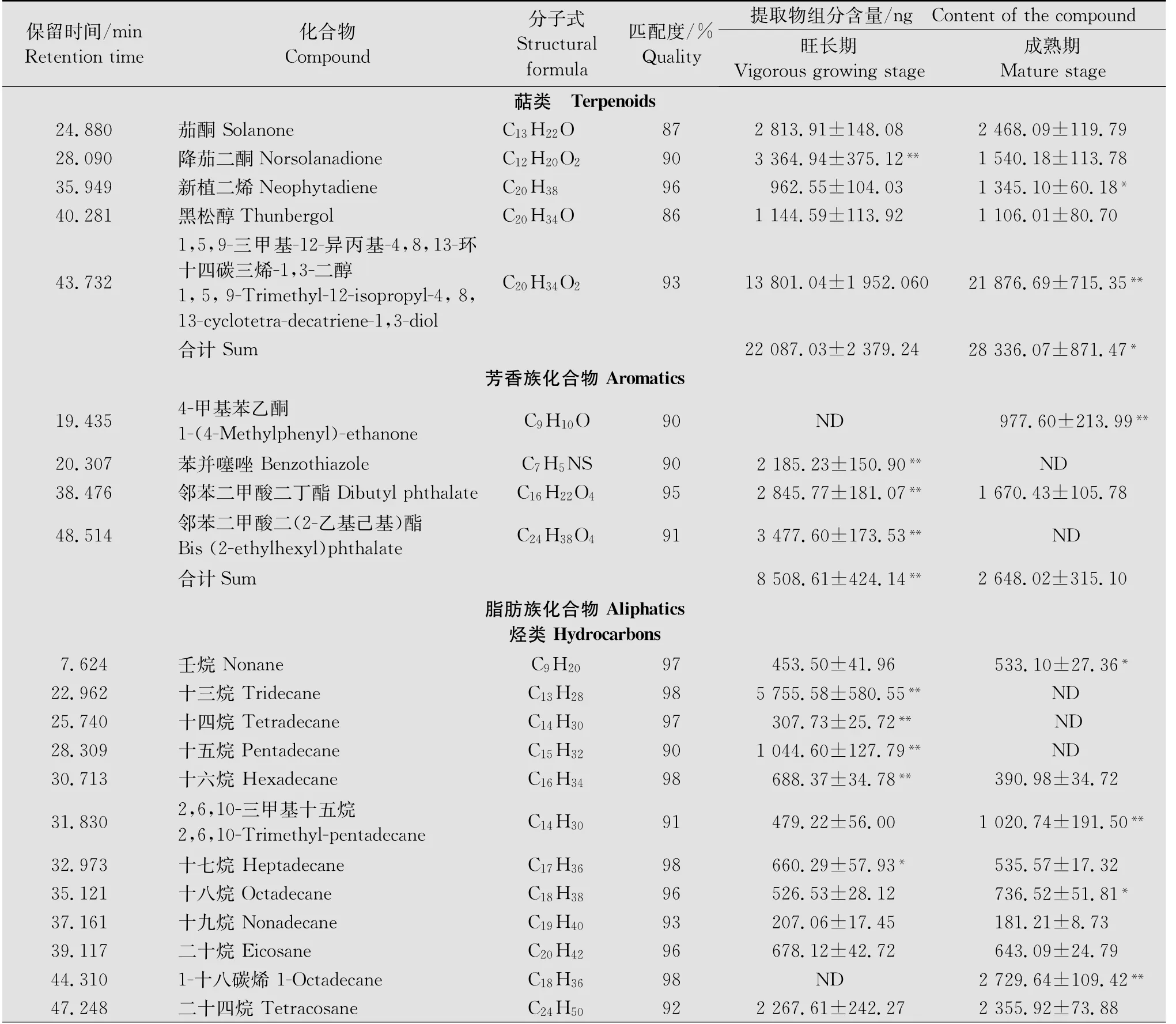
表1 烟草不同生育期叶片分泌物组成1)Table 1 Quantities of cuticular components of tobacco leaves during different growth stages
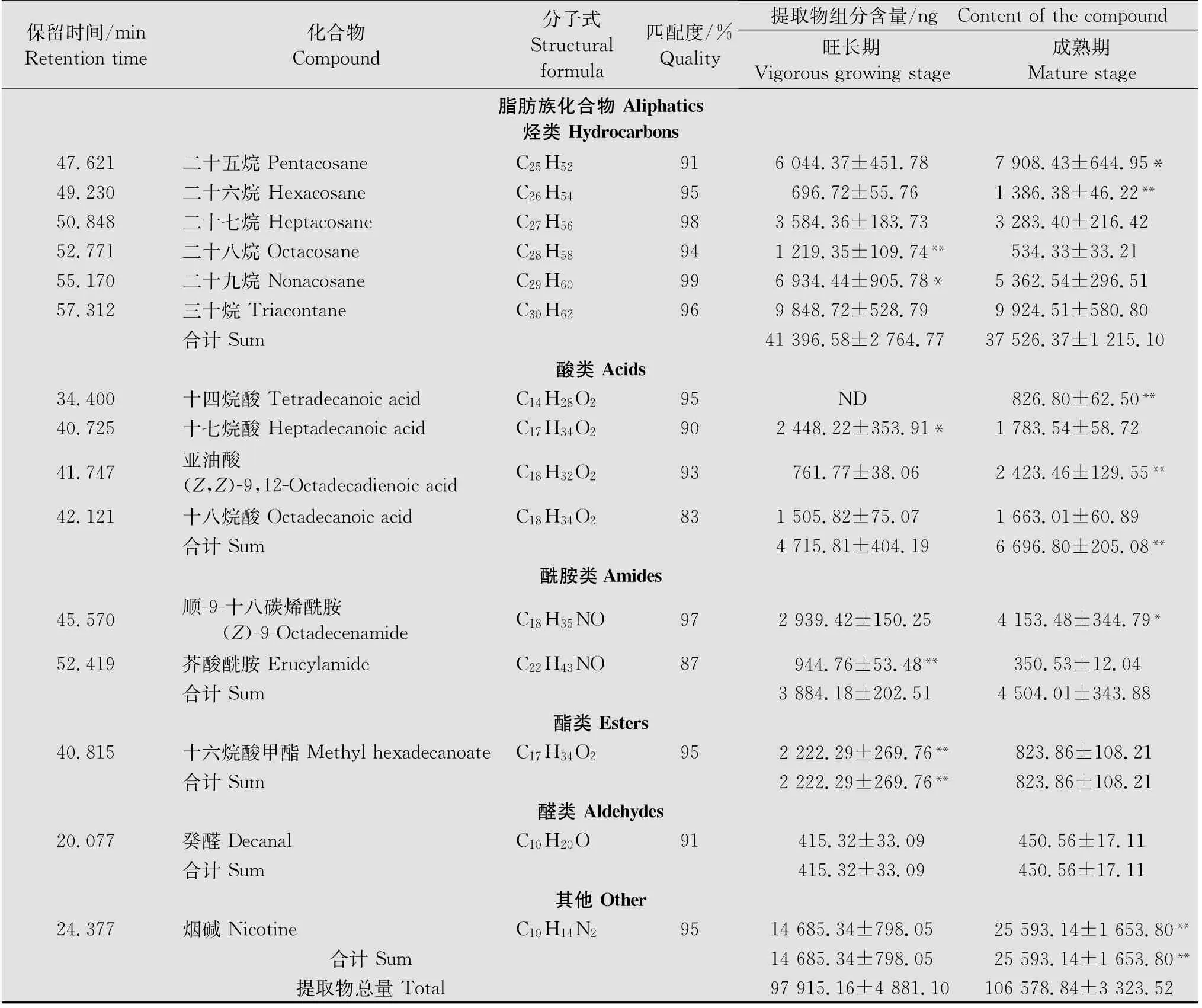
续表1 Table 1(Continued)
2.1.2 烟草不同生育期叶片分泌物中萜类和芳香族化合物的组成及含量
随着烟草生长,萜类化合物的含量显著升高(P<0.05)。其中,1,5,9-三甲基-12-异丙基-4,8,13-环十四碳三烯-1,3-二醇为含量最高的萜类化合物,其旺长期和成熟期含量分别占提取物总量的14.09%和20.53%,从烟草旺长期至成熟期间显著升高(P<0.05)。降茄二酮在旺长期的含量是成熟期的2.18倍,是变化率最大的萜类化合物(表1)。
芳香族化合物的含量变化很大,成熟期叶片中的芳香族化合物含量仅为旺长期的31.12%。所鉴定出的4种芳香族化合物中,4-甲基苯乙酮仅存在于成熟期烟草叶片中;苯并噻唑仅存在于旺长期烟草叶片中。邻苯二甲酸二(2-乙基己基)酯是烟草叶片分泌物中含量最高的芳香族化合物,但仅存在于旺长期叶片分泌物中。邻苯二甲酸二丁酯在不同生育期烟草叶片中均能检测到,从旺长期到成熟期间,其含量约下降了(1 175.34±193.97)ng(表1)。
2.1.3 烟草不同生育期叶片分泌物中脂肪族化合物的组成及含量
从烟草不同生育期叶片分泌物中共鉴定出18种烃类化合物,旺长期叶片中含有17种化合物,成熟期叶片中仅含有15种化合物。除2,6,10-三甲基十五烷外,均为直链烷烃。十三烷、十四烷、十五烷仅存在于旺长期叶片中,其总量约占旺长期叶片中烃类化合物总量的17.17%。1-十八碳烯是唯一的不饱和烷烃,该物质仅存在于成熟期叶片分泌物中。三十烷是含量最高的烃类化合物,占烟草叶片分泌物总量的10%左右。随着烟草的生长,十六烷、十七烷、二十八烷、二十九烷的含量逐渐降低;壬烷、十八烷、二十五烷、二十六烷的含量逐渐升高,均在旺长期和成熟期间存在显著差异(P<0.05)(表1)。
4种酸类化合物均为直链烷酸,其中,亚油酸是唯一的不饱和烷酸。除十八烷酸外,另外3种酸类化合物的含量在旺长期和成熟期间变化显著(P<0.05)。十四烷酸仅存在于成熟期叶片分泌物中,约占提取物总量的0.78%。酰胺类化合物在烟草旺长期和成熟期叶片分泌物中含量较低,分别仅占提取物总量3.97%和4.23%。在旺长期至成熟期间,顺-9-十八碳烯酰胺的含量表现为显著升高;芥酸酰胺的含量表现为显著降低(P<0.05),但酰胺类化合物的总量在烟草旺长期和成熟期间无显著差异(P>0.05)(表1)。
2.2 烟草旺长期植株挥发物的组成及含量
2.2.1 烟草旺长期植株挥发物的组成及含量
利用顶空吸附法从烟草旺长期植株挥发物中共计鉴定出48种挥发物组分,其总量约为(82 047.52± 7 202.70)ng(表2)。主要包括绿叶气味、萜类、芳香族和脂肪族化合物。其中,脂肪族化合物的含量较高,约占挥发物总量的41.39%,包括烃类、醛类、酸类、酮类、酯类和醇类化合物,其中烃类化合物的含量显著高于其他类别的脂肪族化合物(P<0.05)。萜类化合物和芳香族化合物含量较为接近,分别为(21 357.93±2 061.12)ng和(21 895.67±2 818.66)ng。绿叶气味物质的含量较低,不足挥发物总量的5%(表2)。
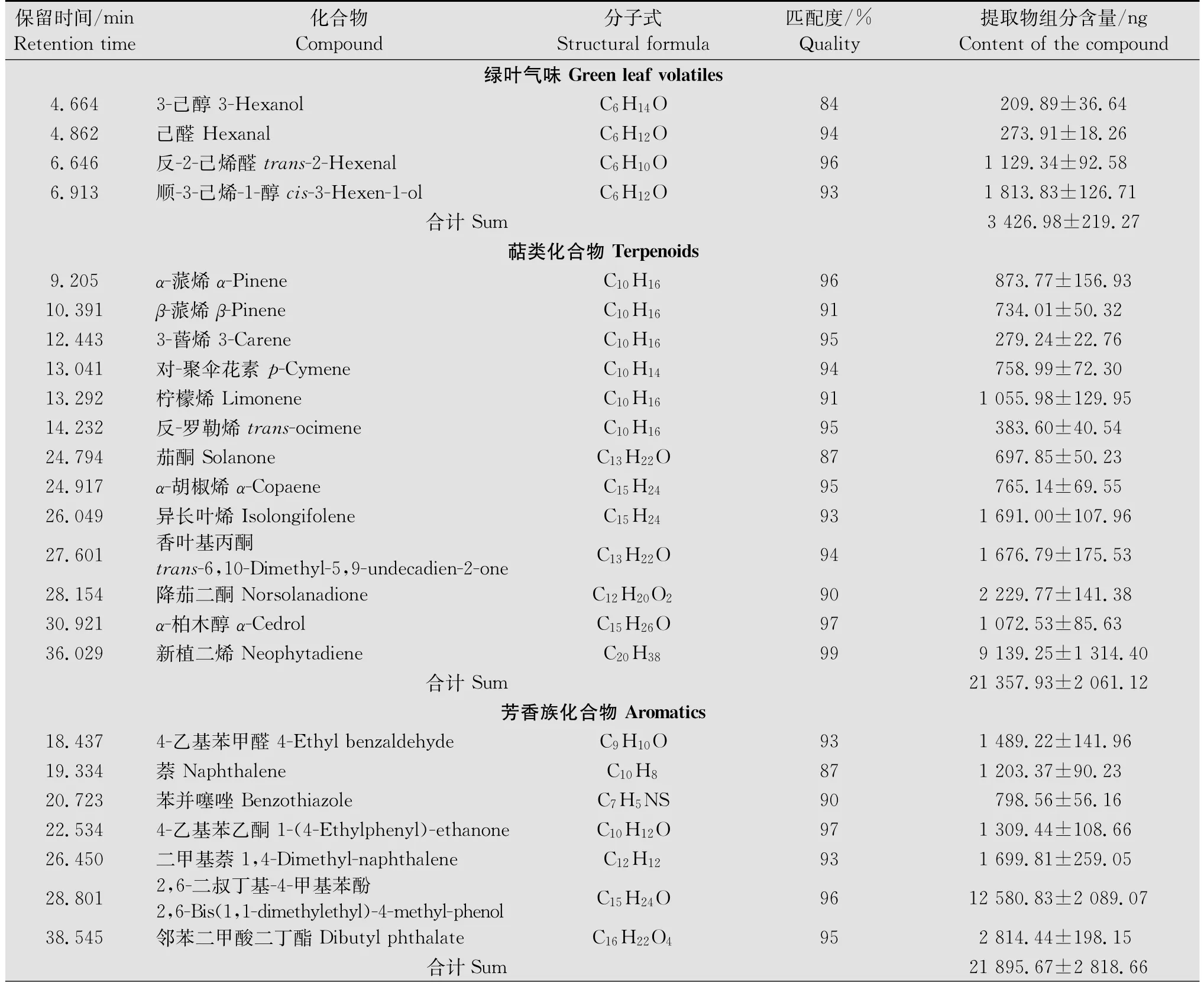
表2 烟草旺长期植株挥发物组成Table 2 Component quantities of volatile compounds from tobacco plants at vigorous growing stage
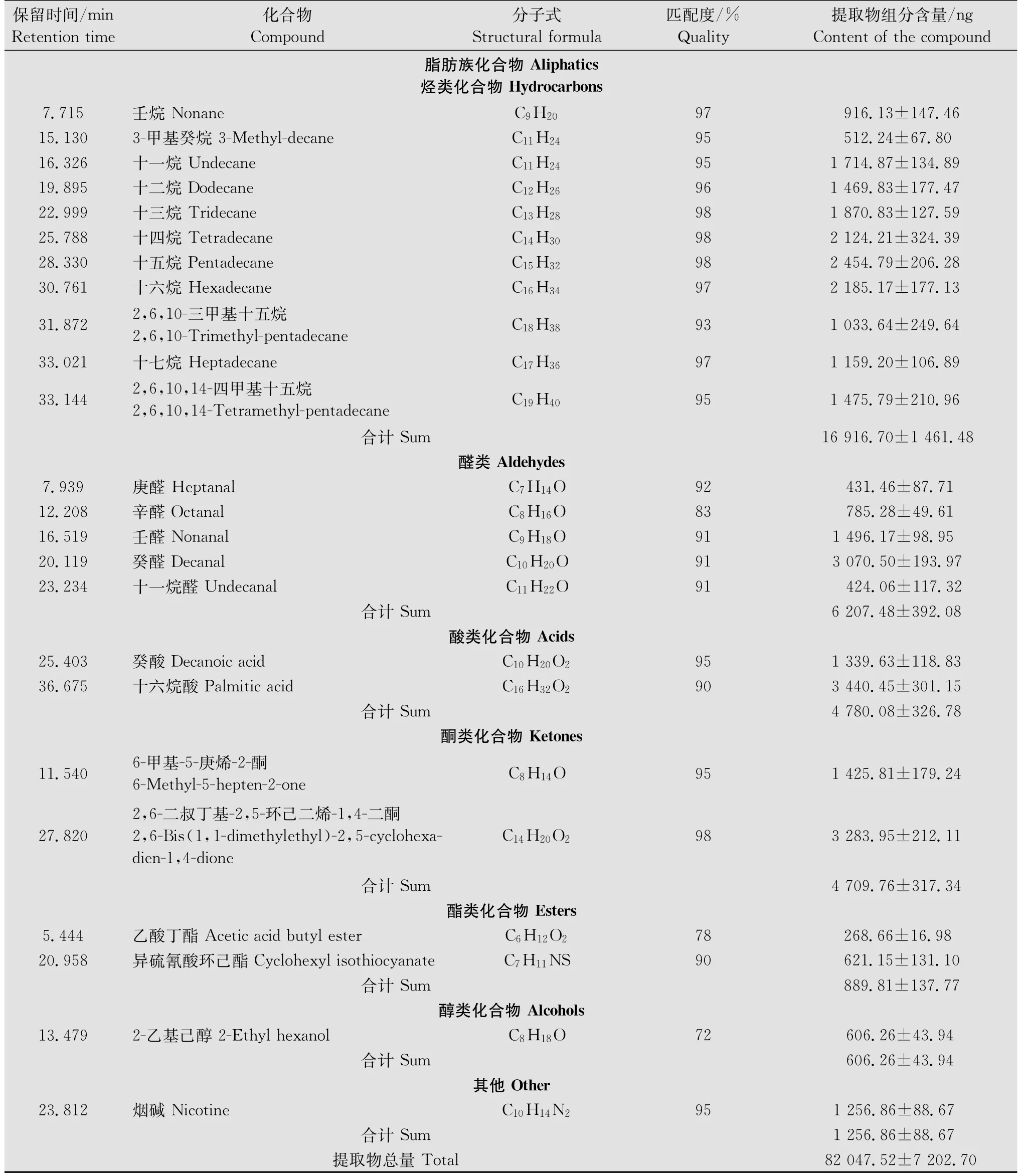
续表2 Table 2(Continued)
2.2.2 烟草旺长期植株中绿叶气味、萜类和芳香族化合物的组成及含量
烟草旺长期植株挥发物中共鉴定出4种绿叶气味物质。其中,顺-3-己烯-1-醇的含量占绿叶气味物质总量的一半以上,显著高于其他组分(P<0.05)。本研究共计鉴定出13种萜类化合物,其总量约占挥发物总量的26.03%。其中,新植二烯约占萜类化合物总量的42.79%,显著高于其他组分(P<0.05)。茄酮、香叶基丙酮、降茄二酮、α-柏木醇为含氧萜类化合物,约占萜类化合物总量的26.58%。烟草植株挥发物中芳香族化合物种类丰富,包括醛类、酮类、酚类、酯类和杂环类化合物等,其总量约为(21 895.67±281 8.66)ng。其中,2,6-二叔丁基-4-甲基苯酚是挥发物中含量最高的化合物。苯并噻唑是仅有的含硫芳香族化合物,其含量不足挥发物总量的1%(表2)。
2.2.3 旺长期烟草植株中脂肪族化合物的组成及含量
从烟草旺长期植株挥发物中共鉴定出11种烃类化合物,均为饱和烷烃,约占脂肪族化合物总量的49.59%。其中,十五烷是含量最高的烃类化合物。醛类化合物的含量约占挥发物总量的7.57%,均为碳原子数相邻的饱和直链烷醛,以癸醛含量最高,约占醛类化合物总量的49.46%。本研究仅鉴定出癸酸和十六烷酸2种酸类化合物,其含量分别为(1 339.63±118.83)ng和(3 440.45±301.15)ng;以及6-甲基-5-庚烯-2-酮和2,6-二叔丁基-2,5-环己二烯-1,4-二酮2种酮类化合物,其含量分别占挥发物总量的1.73%和3.99%。酯类和醇类化合物的含量极低,乙酸丁酯、异硫氰酸环己酯、2-乙基己醇的含量均不足挥发物总量的1%(表2)。
2.3 烟草旺长期叶片分泌物与植株挥发物的组成及含量分析
从烟草旺长期叶片分泌物和植株挥发物中分别鉴定出33种和48种化合物,均包含萜类、芳香族和脂肪族化合物。每单位质量的样品中,这几类化合物在叶片分泌物中的含量均显著高于植株挥发物(P<0.05)。绿叶气味物质仅存在于植株挥发物中,未在叶片分泌物中检测到(表1,表2)。
烟草旺长期叶片分泌物和植株挥发物共包含14种共有化合物。两种不同提取方法所获得的烟碱含量差异极显著(P<0.01),每单位质量的样品中,顶空吸附法所获得的烟碱含量仅为溶剂漂洗法的1.37%。萜类化合物中的茄酮和降茄二酮在叶片分泌物中的含量显著高于植株挥发物,但新植二烯在植株挥发物中的含量约为叶片分泌物中1.52倍。苯并噻唑和邻苯二甲酸二丁酯为共有的芳香族化合物,溶剂漂洗法所获得的这2种物质的含量显著高于顶空吸附法(P<0.05)。两种不同提取方法所获得的提取物中,均包含壬烷、十三烷、十四烷等7种烃类化合物,分别占叶片分泌物中和植株挥发物中脂肪族化合物总量的22.68%和69.42%,占提取物总量的9.59%和14.31%。但是,每单位质量的样品中,溶剂漂洗法所获得的这7种物质的含量均显著高于顶空吸附法(P<0.05)。癸醛是唯一共有的醛类化合物,该物质在植株挥发物中的含量约为叶片分泌物中的1.18倍(表1,表2)。
2.4 烟草旺长期植株日周期挥发物释放规律
烟草旺长期植株挥发物所鉴定出的48种挥发物组分中,36种组分的日周期释放规律表现为随光照加强和温度升高,释放量呈现上升趋势;11:00-15:00时段的释放量显著高于其他各个时段(P<0.05)。5个不同时段的烟草植株挥发物释放总量的变化趋势与上述规律一致,其释放量依次为(4 744.10±300.66)ng、(9 185.28±792.22)ng、(5 200.32±1 084.21)ng、(4 831.62±970.83)ng、(4 309.31±635.21)ng(图1)。
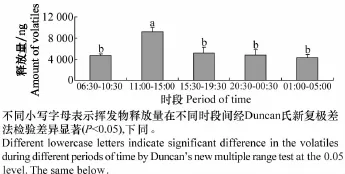
图1 烟草旺长期植株挥发物全日不同时段释放总量Fig.1 Total amount of volatiles released from tobacco plants at vigorous growing stage during different periods in a day
烟草挥发物中,绿叶气味物质中的3-己醇、己醛、反-2-己烯醛、顺-3-己烯-1-醇,脂肪族化合物中的壬烷、3-甲基癸烷、壬醛,萜类化合物中的α-蒎烯、β-蒎烯、3-蒈烯、对-聚伞花素、反-罗勒烯这12种化合物释放规律较为特殊,不遵循上述规律。其中,己醛在一天内各时段的释放量较为相似,以后半夜的释放量较高,但在各个时段间不存在显著差异(P>0.05)。反-罗勒烯从日出时开始大量释放,在日出至正午时段释放量较高,显著高于其他时段(P<0.05)。由正午后开始,释放量逐渐降低,在日出前降到最低。3-甲基癸烷在日出至正午时段的释放量显著高于其他时段(P<0.05),但一天内其他时段的释放量之间不存在显著差异(P>0.05)。3-己醇、3-蒈烯、对-聚伞花素在进入暗期后不久大量释放,其释放量显著高于其他时段(P<0.05)。α-蒎烯和β-蒎烯表现为进入暗期后释放量持续升高,且后半夜的释放量显著高于前半夜(P<0.05)。顺-3-己烯-1-醇、反-2-己烯醛、壬烷、壬醛也表现为进入暗期后大量释放,但在夜间2个时段间的释放量不存在显著差异(P>0.05)(图2)。
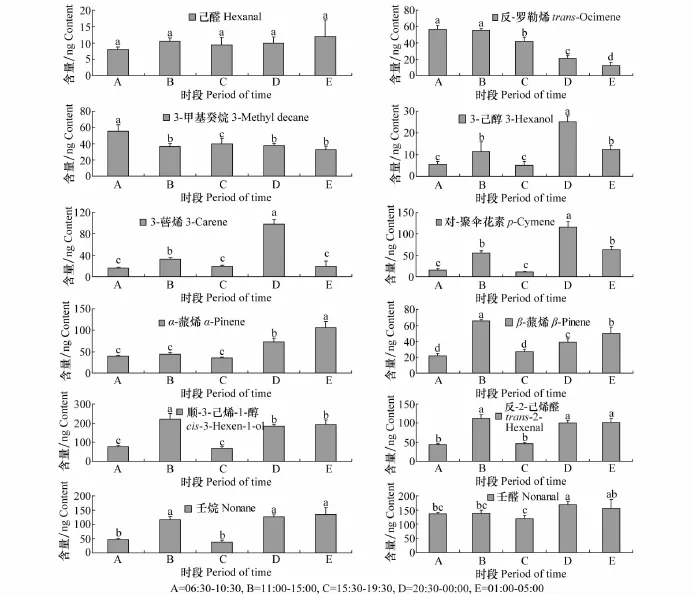
图2 烟草旺长期植株挥发物组分全日不同时段释放量Fig.2 The volatile compounds released from tobacco plants at vigorous growing stage during different periods in a day
3 讨论
国内外大量学者利用顶空吸附法[11,18,21-22]、水蒸馏法[9,17]、固相微萃取技术[19]对不同的烟草样品及其制品进行了研究,其中共有47种化合物与本研究的结果相一致。萜类化合物中α-胡椒烯、异长叶烯、α-柏木醇、黑松醇、1,5,9-三甲基-12-异丙基-4,8,13-环十四碳三烯-1,3-二醇这5种物质,芳香族化合物中苯并噻唑、4-乙基苯乙酮、2,6-二叔丁基-4-甲基苯酚、邻苯二甲酸二(2-乙基己基)酯这4种物质,脂肪族化合物中壬烷、3-甲基癸烷、2,6,10-三甲基十五烷、2,6,10,14-四甲基十五烷、癸酸、十七烷酸、亚油酸、乙酸丁酯、异硫氰酸环己酯、顺-9-十八碳烯酰胺、芥酸酰胺、2-乙基己醇、十一烷醛、2,6-二叔丁基-2,5-环己二烯-1,4-二酮这14种物质未见报道。推测这可能是由于收集的时间、方法及烟草的品种、部位等差异所导致。本研究中,叶片分泌物收集时采用的是离体烟草叶片,剪取时会对烟草造成一定的机械损伤,这可能会导致一些次生物质的含量发生变化,甚至刺激植物体产生新的化合物。这也可能是导致本研究中植株挥发物和叶片分泌物的鉴定结果差异较大的原因之一。
本研究利用溶剂漂洗法和顶空吸附法从不同生育期烟草叶片和植株中共计提取到70种化合物。其中,烟碱挥发性较弱,由于收集方法的差异,导致其在烟草植株挥发物中检测到的含量较低,但在烟草叶片分泌物中含量最高。绿叶气味物质通常在植物与昆虫间的通讯中发挥重要的作用[23]。这类物质主要通过植物体内的茉莉酸由脂氧合酶途径进行合成和转化[24]。绿叶气味物质沸点较低、易挥发,附着在叶片上的含量较少,由于收集方法的差异,导致其大量存在于顶空吸附法收集到的提取物中,而未能在溶剂漂洗法的提取物中检测出。萜类化合物主要靠类异戊二烯途径进行合成与转化[25]。本研究中,溶剂漂洗法收集到的萜类化合物的种类远低于顶空吸附法,这可能是由这些物质的理化性质差异所致。萜类化合物对于植物体的防御系统具有重要意义,多数萜类化合物不仅对植食性昆虫具有驱避甚至是毒杀作用,还具有引诱天敌的通讯作用[26-27]。关于芳香族化合物的生物合成途径报道较少,通常由L-苯丙氨酸作为起始分子,由莽草酸途径进行一系列的羟基化、甲基化等反应形成各种芳香族化合物。这类物质在植物体中主要作为香气成分和结构物质[28]。付晓伟等的研究发现,寡食性的烟夜蛾对芳香族化合物能产生强烈的电生理反应,但是广食性的棉铃虫对这类物质的响应值则偏低[29]。因此可以认为,烟草中的某些芳香族化合物对其主要害虫可能具有一定的行为调控作用[8]。脂肪族化合物作为结构性物质,广泛存在于各类植物体中。因而烟草植株挥发物和叶片分泌物中,脂肪族化合物均占了很大的比例。叶片表面蜡质层上的弱挥发性烷烃类化合物通常被认为是昆虫近距离寄主定向、产卵行为等的信号物质[20,30-31]。烟草旺长期时受虫害较为严重,而叶片分泌物在旺长期和成熟期之间含量变化显著的一些组分,很可能与一些害虫的取食、产卵等为害行为相关。
许多植物挥发物的释放存在昼高夜低的现象,表现为上午时释放量迅速增加,中午时达到最大,然后在下午、晚上逐渐减少。这与温度、光照以及植物体本身的生态生理特性相关[32-33]。此外,植物在由明转暗时,某些挥发物的释放会表现出一个短暂的暴发[34]。本研究中,烟草多数挥发物的释放规律与之吻合。植物挥发物的释放节律与植食性昆虫日活动规律具有明显的关联性,植物体可通过调整自身某些挥发物的昼夜释放规律来改变自身与昆虫间的相互作用关系[35]。研究发现,经美国棉铃虫(Helicoverpa zeaBoddie)等夜蛾科昆虫取食后的烟草能持续释放特异性挥发物组分,并且昼夜释放量差异显著。其中,反-2-己烯醛、顺-3-己烯-1-醇、3-己醇、己醛等绿叶气味物质,其夜间释放量大的规律与夜蛾科昆虫的活动规律相符合,进而发现夜间独有的挥发物释放组合是调控夜蛾科成虫寄主选择等行为的重要因素之一[16]。萜类化合物中,反-罗勒烯已被证明是烟夜蛾等多种蛾类定向与产卵的关键性物质,并且可以协同其他化合物进一步增强引诱效果[22,36]。研究发现,反-罗勒烯夜间释放量的增加很可能是烟草防御机制的表现之一[37]。马艳粉等的Y形嗅觉仪选择试验表明,α-蒎烯、β-蒎烯、p-聚伞花素、柠檬烯、壬醛等对烟草麦蛾等有显著的引诱作用[38]。由此可以推测,本研究中反-2-己烯醛、壬醛、反-罗勒烯等具有特殊释放规律的化合物很可能是调控昆虫为害习性的关键性物质。
鉴于植物与昆虫间信息交流的复杂性,在明确烟草叶片分泌物和植株挥发物成分、含量及释放规律的基础上,今后可利用这些化合物进行昆虫电生理试验,以及室内生物测定和田间试验等,以明确对某些特定昆虫具有生理活性的组分,在此基础上可开发出植物信息素引诱剂或者驱避剂等新型农药,进而实现对部分害虫的生态防控。
[1] 钦俊德.昆虫与植物的关系:论昆虫与植物的相互作用及其演化[M].北京:科学出版社,1987.
[2] 钦俊德,王琛柱.论昆虫与植物的相互作用和进化的关系[J].昆虫学报,2001,44(3):360 365.
[3] Dethier V G.Mechanism of host-plant recognition[J].Entomologia Experimentalis et Applicata,1982,31(1):49 56.
[4] Pickett J A,Wadhams L J,Woodcock C M.Insect supersense:mate and host location by insectsasmodel systems for exploiting olfactory interactions[J].The Biochemist,1998,20(4):8 13.
[5] 孔垂华,娄永根.化学生态学前沿[M].北京:高等教育出版社,2010:110 173.
[6] 付晓伟,郭线茹,罗梅浩,等.烟夜蛾和棉铃虫对高浓度烟草挥发物的电生理和行为反应[J].昆虫学报,2008,51(9):902 909.
[7] 林克剑,吴孔明,张永军,等.B型烟粉虱触角感受器的超微结构及对寄主植物气味的嗅觉行为反应[J].植物保护学报,2007,34(4):379 384.
[8] 刘婷,李为争,游秀峰,等.常见植物挥发物对烟蚜的驱避和抑制定殖活性[J].中国烟草学报,2013,19(2):77 84.
[9] 薛伟伟,付晓伟,罗梅浩,等.烟草挥发物对2近缘种夜蛾产卵行为的影响及其成分分析[J].生态学报,2009,29(11):5783 5790.
[10]Dong W X,Zhang Z N,Fang Y L,et al.Response of parasit-oidMicroplitis mediatorto plant volatiles in an olfactometer[J].Insect Science,2000,7(4):344 350.
[11]Yan Z G,Yan Y H,Wang CZ.Attractiveness of tobacco volatiles induced byHelicoverpa armigeraandHelicoverpa assultatoCampoletis chlorideae[J].Chinese Science Bulletin,2005,50(13):1334 1341.
[12]董文霞,张峰,方宇凌,等.烟蚜茧蜂对蚜虫信息素及烟草挥发物的触角电位反应[J].生态学杂志,2008,27(4):591 595.
[13]白崇禄,丁玉梅,付亚丽,等.田间废次鲜烟叶提取液的杀虫效果研究[J].云南农业科技,2013(3):4 7.
[14]丁吉林,丁伟,岑小惜,等.烟草粗提物对朱砂叶螨活性的初步研究[J].烟草科技,2008(3):63 64.
[15]王秀芳,任广伟,王新伟,等.植物精油对烟草甲触杀,熏蒸和驱避作用研究[J].中国烟草学报,2011,17(2):67 70.
[16]De Moraes C M,Mescher M C,Tumlinson J H.Caterpillarinduced nocturnal plant volatiles repel conspecific females[J]. Nature,2001,410:577 580.
[17]Andersen R A,Hamilton-Kemp T R,Fleming P D,et al. Volatile compounds from vegetative tobacco and wheat obtained by steam distillation and headspace trapping[M]∥Parliment T H,Croteau R.Biogeneration of Aromas,1986:99 111.
[18]Andersen R A,Hamilton-Kemp T R,Loughrin J H,et al. Green leaf headspace volatiles fromNicotiana tabacumlines of different trichome morphology[J].Journal of Agricultural and Food Chemistry,1988,36(2):295 299.
[19]Clark T J,Bunch J E.Qualitative and quantitative analysis of flavor additives on tobacco products using SPME-GC-mass spectroscopy[J].Journal of Agricultural and Food Chemistry,1997,45(3):844 849.
[20]Udayagiri S,Mason C E.Epicuticular wax chemicals inZea maysinfluence oviposition inOstrinia nubilalis[J].Journal of Chemical Ecology,1997,23(7):1675 1687.
[21]Leffingwell J C,Alford E D.Volatile constituents of perique tobacco[J].Electronic Journal of Environmental,Agricultural and Food Chemistry,2005,4(2):899 915.
[22]Sun J G,Huang L Q,Wang C Z.Electrophysiological and behavioral responses ofHelicoverpa assulta(Lepidoptera:Noctuidae)to tobacco volatiles[J].Arthropod-Plant Interactions,2012,6(3):375 384.
[23]Choudhary D K,Johri B N,Prakash A.Volatiles as priming agents that initiate plant growth and defence responses[J]. Current Science,2008,94:595 604.
[24]Matsui K.Green leaf volatiles:Hydroperoxide lyase pathway of oxylipin metabolism[J].Current Opinion in Plant Biology,2006,9(3):274 280.
[25]Tholl D.Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J].Current Opinion in Plant Biology,2006,9(3):297 304.
[26]Mumm R,Schrank K,Wegener R,et al.Chemical analysis of volatiles emitted byPinussylvestrisafter induction by insect oviposition[J].Journal of Chemical Ecology,2003,29(5):1235 1252.
[27]Mumm R,Tiemann T,Varama M,et al.Choosy egg parasitoids:Specificity of oviposition-induced pine volatiles exploited by an egg parasitoid of pine sawflies[J].Entomologia Experimentalis et Applicata,2005,115(1):217 225.
[28]Pichersky E,Noel JP,Dudareva N.Biosynthesis of plant volatiles:Nature’s diversity and ingenuity[J].Science,2006,311(5762):808 811.
[29]付晓伟,郭线茹,罗梅浩,等.两近缘种夜蛾对低浓度烟草挥发物的触角电位反应[J].生态学报,2009,29(6):2962 2970.
[30]Li G Q,Ishikawa Y.Oviposition deterrents in larval frass of fourOstriniaspecies fed on an artificial diet[J].Journal of Chemical Ecology,2004,30(7):1445 1456.
[31]Li G Q,Ishikawa Y.Oviposition deterrents from the egg masses of adzuki bean borer,Ostrinia scapulalisand Asian corn borer,O.furnacalis[J].Entomologia Experimentalis et Applicata,2005,115(3):401 407.
[32]Holzke C,Hoffmann T,Jaeger L,et al.Diurnal and seasonal variation of monoterpene and sesquiterpene emissions from Scots pine(Pinus sylvestrisL.)[J].Atmospheric Environment,2006,40(17):3174 3185.
[33]Pio C A,Silva P A,Cerqueira M A,et al.Diurnal and seasonal emissions of volatile organic compounds from cork oak(Quercussuber)trees[J].Atmospheric Environment,2005,39(10):1817 1827.
[34]Chamberlain K,Khan Z R,Pickett J A,et al.Diel periodicity in the production of green leaf volatiles by wild and cultivated host plants of stemborer moths,Chilo partellusandBusseola fusca[J].Journal of Chemical Ecology,2006,32(3):565 577.
[35]戴建青,韩诗畴,杜家纬.植物挥发性信息化学物质在昆虫寄主选择行为中的作用[J].环境昆虫学报,2010,32(3):407 414.
[36]Hartlieb E,Rembold H.Behavioral response of femaleHelicoverpa(Heliothis)armigeraHB.(Lepidoptera:Noctuidae)moths to synthetic pigeonpea(Cajanus cajanL.)kairomone[J].Journal of Chemical Ecology,1996,22(4):821 837.
[37]Sánchez-Hernández C,López M G,Délano-Frier JP.Reduced levels of volatile emissions in jasmonate-deficientspr2 tomato mutants favour oviposition by insect herbivores[J].Plant,Cell&Environment,2006,29(4):546 557.
[38]马艳粉,胥勇,肖春.10种寄主植物挥发物对马铃薯块茎蛾产卵的引诱作用[J].中国生物防治学报,2012,28(3):448 452.
The release of leaf exudates and plant volatiles of tobacco
Li Xiang1, Yang Zhen1, Hu Baowen2, Dai Xun2, Dong Wenxia1
(1.College of Plant Protection,Yunnan Agricultural University;Key Laboratory of Agro-Biodiversity and Pest
Management of Education Ministry of China;Yunnan Key Laboratory of Agro-Biodiversity and
Conservation,Kunming650201,China;2.Hongta Group Co.,Ltd.,Yuxi653100,China)
Secondary metabolites released from tobacco manipulated the orientation and oviposition behaviors of pest insects and attracted natural insects to some pests.The major cuticular components of tobacco leaves were extracted by rinsing the leaves with dichloromethane and collecting tobacco plant volatiles by headspace absorption,and the components were analyzed by GC/MS.The results indicated that 36 compounds were identified from the tobacco leaves,33 compounds at vigorous growing stage,31 compounds at mature stage.Forty-eight volatile compounds were identified from tobacco plants at vigorous growing stage.The amounts of 36 compounds increased with the increase of temperature and sunlight,and the tobacco emitted high level of these volatile compounds at 11:00 15:00.However,the amounts of 9 compounds increased at night.
tobacco; leaf rinse with dichloromethane; headspace absorption; secondary metabolite
Q 946.8
A
10.3969/j.issn.0529 1542.2015.01.003
2014 01 28
2014 03 07
致 谢:感谢中国科学院昆明植物研究所余珍老师在植物挥发物鉴定上给予的帮助。
*通信作者 E-mail:dongwenxia@163.com
#同等贡献,并列为第一作者
