自体脂肪干细胞移植治疗2型糖尿病的安全性及有效性
2015-02-13张新周玉红白云
张新,周玉红,白云
(辽河油田总医院内分泌科,辽宁 盘锦 124010)
自体脂肪干细胞移植治疗2型糖尿病的安全性及有效性
张新,周玉红,白云
(辽河油田总医院内分泌科,辽宁 盘锦 124010)
目的探讨自体脂肪干细胞(ADSCs)移植治疗2型糖尿病的安全性和有效性。方法培养自体ADSCs,并进行鉴定。将2型糖尿病患者48例分为2组:A组(n=24)行ADSCs移植联合常规治疗,B组(n=24)行常规治疗。随访观察15个月,分析2组患者治疗时和治疗后3、6、12、15个月的空腹血糖(FPG)、餐后2 h血糖(2h-PGh)、糖化血红蛋白(HbA1c)、空腹C肽(FC-P)、C肽曲线下面积(AUCC)、胰岛素剂量、不良反应的情况。结果培养的ADSCs符合自体临床应用标准。与治疗前相比,2组患者FPG、2h-PGh和HbA1c都有明显降低,且A组降低更显著;A组在FC-P、AUCC和胰岛素用量方面的改善明显优于B组。在干细胞治疗过程中无明显不良反应。结论采用自体ADSCs移植可以安全有效地治疗2型糖尿病。
2型糖尿病;自体脂肪干细胞;移植;安全性和有效性
糖尿病已成为继心脑血管疾病和肿瘤之后的第三大非传染性疾病,且其中90%以上为2型糖尿病[1]。目前,临床上治疗2型糖尿病主要是通过饮食、运动、药物和注射胰岛素治疗,但常常无法取得满意的效果。近年来,随着干细胞研究的不断深入,成体干细胞尤其是间充质干细胞(mesenchymal stem cells,MSC),因具有取材方便、多向分化和自我更新等特点,被部分研究者用于2型糖尿病的临床治疗,并取得了较好的短期疗效,为治愈2型糖尿病带来了希望[2,3]。本研究将人体储量大、干细胞获得率较高的自体脂肪干细胞(autologous adipose-derived stem cells,ADSCs)用于2型糖尿病患者的自体移植,并通过随访观察对其疗效和安全性做出初步评价。
1 材料与方法
1.1 一般资料
选择2011年9月至2013年6月于我院就诊的2型糖尿病患者48例,采用单盲实验设计,按照随机数字表法分为A组和B组,每组24例。A组行干细胞移植联合常规治疗,B组单纯行常规治疗,2组常规治疗方案一致。本研究经本院伦理委员会讨论通过,患者知情同意。本研究符合赫尔辛基宣言和国家卫生计生委关于干细胞临床研究的管理办法。
纳入标准:符合1999年WHO关于糖尿病的诊断标准和分型标准;年龄16~65岁,性别不限;服用药物或注射胰岛素控制血糖。排除标准:严重心、肝、肾功能不全;消耗性疾病;其他内分泌系统疾病;有血液系统疾病或出血倾向;发生严重不良事件或不能耐受者。
1.2 ADSCs移植
ADSCs培养:从患者腹部取脂肪组织,用Ⅳ型胶原酶(Sigma公司,美国)消化后,离心。将收集到的有核细胞用无血清培养液(Gibco公司,美国)接种到6孔板中,置于37℃、5%CO2培养箱培养;48 h后,观察细胞贴壁,此后每隔3 d换液1次,待细胞生长至80%~90%融合时,进行1∶3传代。
ADSCs鉴定:(1)用倒置显微镜观察记录ADSCs形态;(2)用MTT方法检测ADSCs接种后第1、2、3、5、6、7天细胞存活率,并绘制生长曲线;(3)用流式细胞仪检测ADSCs表面标记CD105、CD90、CD73和CD34、CD45、HLA-DR的表达量;(4)用成骨、成脂诱导液诱导ADSCs向骨和脂肪2个方向分化,并分别用茜素红和油红O染液进行染色后在显微镜下拍照,以检测ADSCs多向分化能力;(5)检测移植前ADSCs存活率和内毒素。
ADSCs移植:培养的ADSCs收获后用生理盐水重悬,按1×107/kg体质量进行静脉回输,移植后患者留院观察4 h。
1.3 疗效观察判定方法及安全性评价
记录患者性别、年龄、病程、烟酒史、身高和治疗前后的体质量等一般资料,并计算体重指数(body mass index,BMI)=体质量(kg)/身高2(m2)。实验室检查治疗前后2组患者的空腹血糖(fasting plasma glucose,FPG),餐后2 h血糖(2 h postprandial blood glucose,2h-PGh),糖化血红蛋白(glycosylated hemoglobin,HbA1c),空腹C肽(fasting C-peptide,FCP),C肽曲线下面积(area under curve for C-peptide,AUCC)。AUCC=0.5×FC-P0 h+FC-P0.5 h+FC-P1 h+FC-P2 h+0.5×FC-P3 h;胰岛素剂量。观察移植后及随访过程中患者的不良反应。
1.4 应急处理
培养过程中,若发现污染则立即废弃细胞,重新取患者脂肪组织进行培养。若质检时发现细胞质量不过关,重新复苏扩增培养,或重新取患者脂肪组织进行培养。ADSCs治疗基本无不良反应,细胞回输后患者出现寒战、低热(体温37.5~38.5℃)的概率很低,可临床观察24 h,基本会自行消退。不退热的情况下,采用酒精擦拭等方法进行降温即可。
1.5 随访
移植治疗后每2周由专人对患者进行电话随访,询问每位患者血糖控制和胰岛素使用情况,并根据患者血糖控制情况适当调整胰岛素剂量。患者在移植后3、6、12、15个月时来院复诊,并进行相应的实验室检查。
1.6 统计学分析
2 结果
2.1 一般临床资料
比较2组患者的性别、年龄、烟酒史、BMI、病程,差异均无统计学意义(P>0.05),2组具有可比性。见表1。

表1 一般临床资料比较Tab.1 Comparison of the basic clinical data of the two groups
2.2 ADSCs鉴定
2.2.1 ADSCs形态:原代培养的细胞接种后24 h即可见部分细胞贴壁,并逐渐伸展成为纺锤状。经换液后,贴壁细胞主要为ADSCs,呈长梭形成纤维细胞样。7~10 d时细胞基本贴满孔板底部,细胞扁平,呈鱼群状、旋涡状整齐排列。传代培养的ADSCs生长旺盛,形态与原代相似。见图1。

图1 ADSCs细胞形态Fig.1 The morphology of ADSCs
2.2.2 ADSCs生长曲线:将第3代ADSCs种于96孔板,检测细胞活性,读取吸光度值(OD值),绘制生长曲线。结果显示:细胞在接种后最初2 d处于生长潜伏期,第3~6天处于对数生长期,第6天达峰值,之后细胞生长速度减慢,进入生长平台期,平均5~6 d传代1次。见图2。

图2 ADSCs生长曲线Fig.2 The growth curve of ADSCs
2.2.3 ADSCs多向分化能力:用成骨和成脂诱导培养基分别诱导ADSCs,行茜素红或油红O染色,光镜下观察并拍照。成骨诱导后,可见部分细胞由长梭形逐渐变为多角形,细胞聚集,表面有一层分泌物,茜素红染色呈阳性。成脂诱导后,细胞由长梭形逐渐收缩变短,细胞内有脂滴出现,经油红O染色,可见细胞内有大量的脂质沉积,被染成红色。观察发现P3代ADSCs可向中胚层来源的2个以上方向分化。见图3。

图3 ADSCs诱导分化Fig.3 The differentiation of ADSCs
2.2.4 ADSCs表面标记检测:结果显示,P3代ADSCs呈CD105、CD90和CD73阳性,阳性率>98%;CD45、CD34和HLA-DR阴性,阳性率<2%。见图4。
2.2.5 移植前ADSCs存活率和内毒素检测:台盼蓝染色结果显示,用于移植的ADSCs细胞存活率均>95%。鲎试剂凝胶法内毒素检测结果显示内毒素≤5 EU/mL,符合临床使用标准。
2.3 移植前后各项观察指标的变化
如表2所示:与治疗前相比,B组患者治疗后3个月FPG水平明显改善(P<0.01),A组患者虽有改善但不明显,2组患者治疗后3个月2h-PGh和HbA1c含量均有明显改善(P<0.05);治疗后6、12、15个月,2组患者FPG、2h-PGh和HbA1c含量较治疗前均有明显改善(P<0.01);A组治疗后3个月2h-PGh改善效果明显优于B组(P<0.01),治疗后6个月HbA1c改善效果明显优于B组(P<0.05),治疗后12和15个月FPG、2h-PGh、HbA1c改善效果均明显优于B组(P<0.05)。治疗后12个月,B组患者FC-P含量较治疗前明显降低(P<0.05);而A组患者在治疗后随访的各个时间点FC-P含量均较治疗前有明显提高(P<0.05),且与相应时间点B组患者有统计学差异(P<0.01)。B组患者AUCC在随访的各时间点均无明显变化,而A组患者AUCC在治疗后3、12、15个月均有明显增加(P<0.05),且与相应时间点B组患者AUCC相比有统计学差异(P<0.05)。随着治疗时间的延长,B组患者胰岛素用量有增加的趋势,但差异不明显,而A组患者胰岛素用量逐渐减少,且A组各时间点与治疗前及与B组相比均有统计学差异(P<0.01)。

图4 ADSCs流式检测Fig.4 The flow cytometric analysis of ADSCs
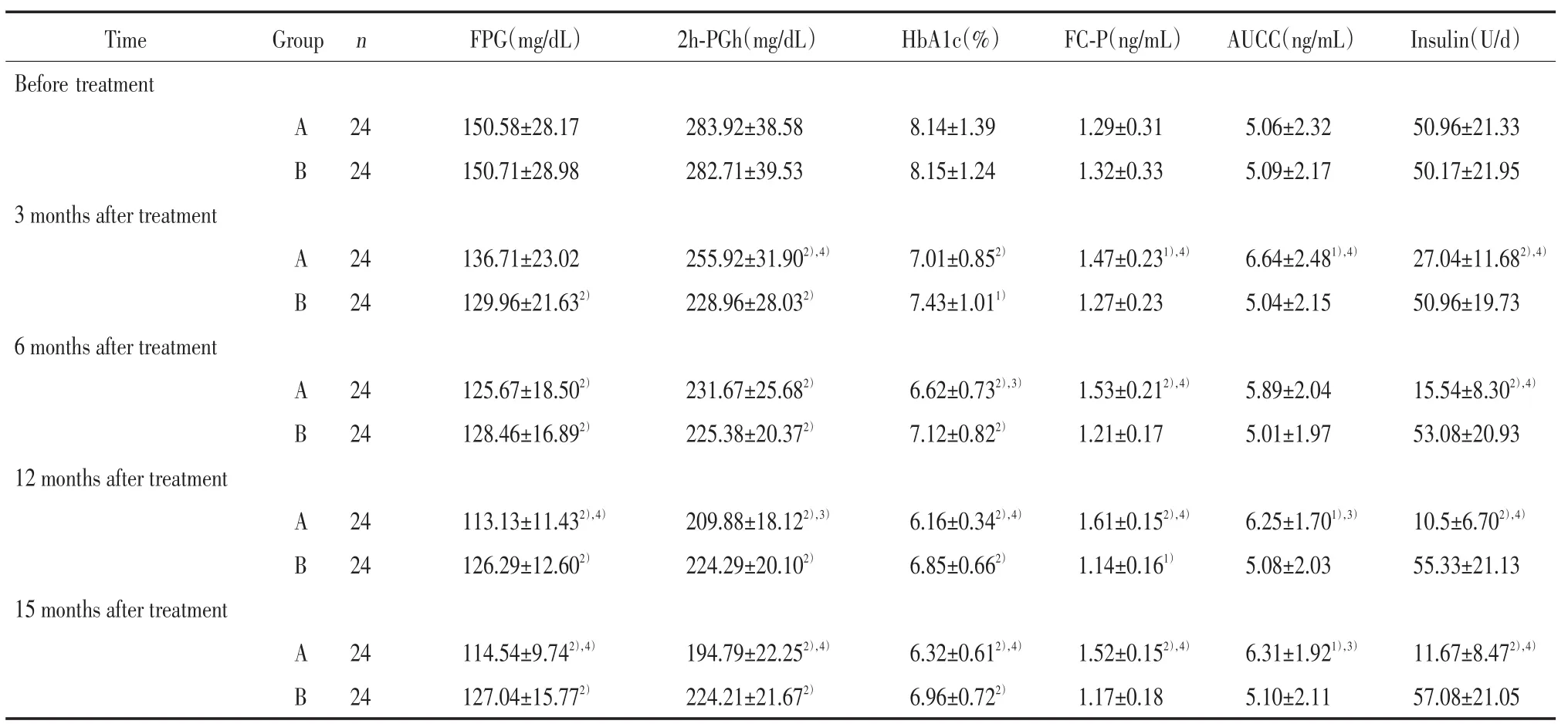
表2 2组各项指标的变化Tab.2 Changes in the clinical data of the two groups
2.4 不良反应
在治疗和随访过程中,A组患者未出现发热、皮疹等过敏反应和其他不良反应。
3 讨论
近年来,全球2型糖尿病患病率逐年增加,由于其并发症具有高致残致死率,严重影响人类健康。目前,临床上治疗2型糖尿病仍处于胰岛素治疗、运动加饮食治疗等临床控制阶段,迫切需要有突破临床控制的治疗方式的出现。干细胞移植作为一种新兴的治疗方式,日益受到人们的关注。国内外学者用脐血干细胞[4,5]、外周血干细胞[6]、骨髓来源的MSC[7~12]、脐带来源的MSC[13]等治疗2型糖尿病,均在控制血糖、修复胰岛分泌功能方面取得了更佳效果。到2015年10月10日为止,在互联网上(http:// www.clinical.gov)能查到91项关于干细胞治疗2型糖尿病的临床研究。本研究采用具有人体储量大、易于采集培养、分化增殖能力强等优点的ADSCs进行移植,观察其治疗2型糖尿病的安全性和有效性。结果显示,在ADSCs移植后及随访过程中,患者未出现发热、皮疹等不良反应及其他并发症,说明ADSCs是治疗2型糖尿病的安全的新方法,具有一定的临床可行性。
本研究结果显示:培养的ADSCs形态正常、一致性好,具有可向中胚层来源的2个方向分化和增殖能力强等MSCs的特性,且细胞存活率高、无菌、无支原体,符合成体干细胞的临床应用标准[15]。本研究采用静脉回输的方法,利用干细胞的“归巢”特性,期望能够获得如Gitelman等[16]实验中骨髓干细胞促进胰岛β细胞再生和修复胰岛分泌功能的结果。结果显示,在2型糖尿病患者平均血糖控制方面,ADSCs移植联合常规治疗比仅用常规治疗有明显优势,联合治疗能使胰腺β细胞的分泌功能增强,而仅用常规治疗则不能,甚至有可能使胰腺β细胞的分泌功能降低;联合治疗能在很好地控制血糖的基础上,降低患者胰岛素用量,并有7例患者脱离了胰岛素,而仅用常规治疗则需增加胰岛素用量才能维持患者的血糖水平。以上结果提示,ADSCs移植联合常规治疗效果明显优于单纯常规治疗,因此,该方法是一种可行性高、安全有效的治疗2型糖尿病的方式。
干细胞治疗技术是生物治疗领域的一种新兴项目,目前许多治疗作用的确切机制尚不完全清楚,且缺少多中心、大样本的研究数据和干细胞移植的规范化操作,因此,对于干细胞移植治疗2型糖尿病还需进一步深入研究和探讨。
[1]Nitzan O,Elias M,Chazan B,et al.Urinary tract infections in patients with type 2 diabetes mellitus:review of prevalence,diagnosis,and management[J].Diabetes Metab Syndr Obes,2015,8:129-136.
[2]Kong D,Zhuang X,Wang D,et al.Umbilical cord mesenchymal stem cell transfusion ameliorated hyperglycemia in patients with type 2 diabetes mellitus[J].Clin Lab,2014,60(12):1969-1976.
[3]Lei L,Zhang X,Mao Y,et al.Statin therapy and bone marrow CD34+cell frequency in type 2 diabetes mellitus:a cross-sectional study[J].Int J Cardiol,2014,175(1):214-216.
[4]Tong Q,Duan L,Xu Z,et al.Improved insulin secretion following intrapancreatic UCB transplantation in patients with T2DM[J].J Clin Endocrinol Metab,2013,98(9):E1501-1504.
[5]徐谷根,杨茵,尹卓娜,等.脐带血干细胞移植治疗2型糖尿病临床分析[J].中国医药科学,2011,1(22):22-25.
[6]丁明超,王意忠,王斌,等.经导管自体外周血干细胞灌注治疗2型糖尿病的临床价值[J].中华临床医师杂志(电子版),2012,6(17):5126-5130.
[7]Bhansali A,Upreti V,Walia R,et al.Efficacy and safety of autologous bone marrow derived hematopoietic stem cell transplantation in patients with type 2 DM:a 15 months follow-up study[J].Indian J Endocrinol Metab,2014,18(6):838-845.
[8]Bhansali A,Asokumar P,Walia R,et al.Efficacy and safety of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus:a randomized placebo-controlled study[J].Cell Transplant,2014,23(9):1075-1085.
[9]Bhansali A,Upreti V,Khandelwal N,et al.Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus[J].Stem Cells Dev,2009,18(10):1407-1416.
[10]王攀,吴正蓉,田景伦,等.经皮脾动脉自体骨髓细胞移植治疗2型糖尿病5例[J].中国组织工程研究与临床康复,2010,14(23):4355-4358.
[11]姚金萍,段炼,童强,等.自体骨髓干细胞移植治疗2型糖尿病的安全性及有效性[J].第三军医大学学报,2012,34(1):74-77.
[12]周旋,余卫,陈玲珍,等.自体骨髓间充质干细胞移植治疗2型糖尿病的临床研究[J].当代医学,2013,19(17):20-21.
[13]Liu X,Zheng P,Wang X,et al.A preliminary evaluation of efficacy and safety of Wharton′s jelly mesenchymal stem cell transplantation in patients with type 2 diabetes mellitus[J].Stem Cell Res Ther,2014,5(2):57.
[14]Jiang R,Han Z,Zhuo G,et al.Transplantation of placenta-derived mesenchymal stem cells in type 2 diabetes:a pilot study[J].Front Med,2011,5(1):94-100.
[15]Tzouvelekis A,Paspaliaris V,Koliakos G,et al.A prospective,nonrandomized,no placebo-controlled,phase Ib clinical trial to study the safety of the adipose derived stromal cells-stromal vascular fraction in idiopathic pulmonary fibrosis[J].J Transl Med,2013,11:171.
[16]Gitelman SE,Gottlieb PA,Rigby MR,et al.Antithymocyte globulin treatment for patients with recent-onset type 1 diabetes:12-month results of a randomised,placebo-controlled,phase 2 trial[J].Lancet Diabetes Endocrinol,2013,1(4):306-316.
(编辑 王又冬)
Efficacy and Safety of Autologous Adipose-derived Stem Cells Transplantation in Patients with Type 2 Diabetes Mellitus
ZHANGXin,ZHOUYu-hong,BAIYun
(Department of Endocrinology,Liaohe Oilfield General Hospital,Panjin 124010,China)
ObjectiveTo evaluate the clinical efficacy and safety of ADSCs infusion in patients with type 2 diabetes mellitus(T2DM).MethodsAutologous ADSCs were cultured and identified.Totally 48 cases of type 2 diabetes patients were divided into two groups:24 cases in A group received ADSCs and conventional treatment,while the other24 cases in B group received conventional treatment.With 15 months′follow-up,FPG,2h-PGh,HbA1c,FC-P,AUCC,insulin medication changes and security on post-treatment3,6,12 and 15 months were calculated.ResultsThe ADSCs which cultured met the clinical application of standards.FPG,2h-PGh and HbA1c in both groups were significantly decreased,and the values in A group were more impressive than B.There were significant improvement in FC-P,AUCC and insulin of A group compared with B group.There was not treatment related adverse events.ConclusionThe clinical data demonstrate that the treatment with ADSCs can improve metabolic control and beta cell function in patients with T2DM.Moreover,the safety oft he treatment method was considerable.
type 2 diabetes mellitus;autologous adipose-derived stem cells;transplantation;efficacy and safety
R5
A
0258-4646(2015)12-1137-05
张新(1979-),女,主治医师,硕士.
E-mail:xixi_1979@163.com
2015-04-08
网络出版时间:
