颅内血管外皮细胞瘤的CT和MRI诊断
2015-01-20潘小平金盛辉许龙胜王小健
潘小平 金盛辉 许龙胜 王小健
血管外皮细胞瘤(hemangiopericytoma,HPC)是一种少见的起源于毛细血管Zimmerman细胞的软组织肿瘤,发生于颅内的HPC约占颅内肿瘤的1%[1]。其临床和影像学表现与脑膜瘤相似,但颅内HPC侵袭性强、复发率高,血供极其丰富,术中出血多,与脑膜瘤的治疗和预后差异很大,故术前准确诊断非常重要。本文回顾性分析15例经手术病理证实的颅内HPC的CT、MRI资料,提高其影像诊断水平。
方 法
1.临床材料
收集我院2006年9月~2013年11月病理证实为HPC的15例颅内HPC患者CT、MRI资料,6例行CT平扫及增强,15均行常规MRI平扫、DWI成像及增强检查。男性9例,女性6例,年龄18~67岁,中位年龄37.5岁。临床症状反复头痛、头晕11例,其中6例伴恶心、呕吐;视物模糊3例,癫痫1例。
2.检查方法
(1)CT检查:采用GE LightSpeed 64层螺旋CT扫描机。头颅轴位常规平扫后行增强扫描,层厚、层间距均为5mm。增强扫描使用高压注射器经肘前静脉注入非离子型对比剂优维显(370mg/ml)75ml,维持量生理盐水25ml,注射速度3.5ml/s.
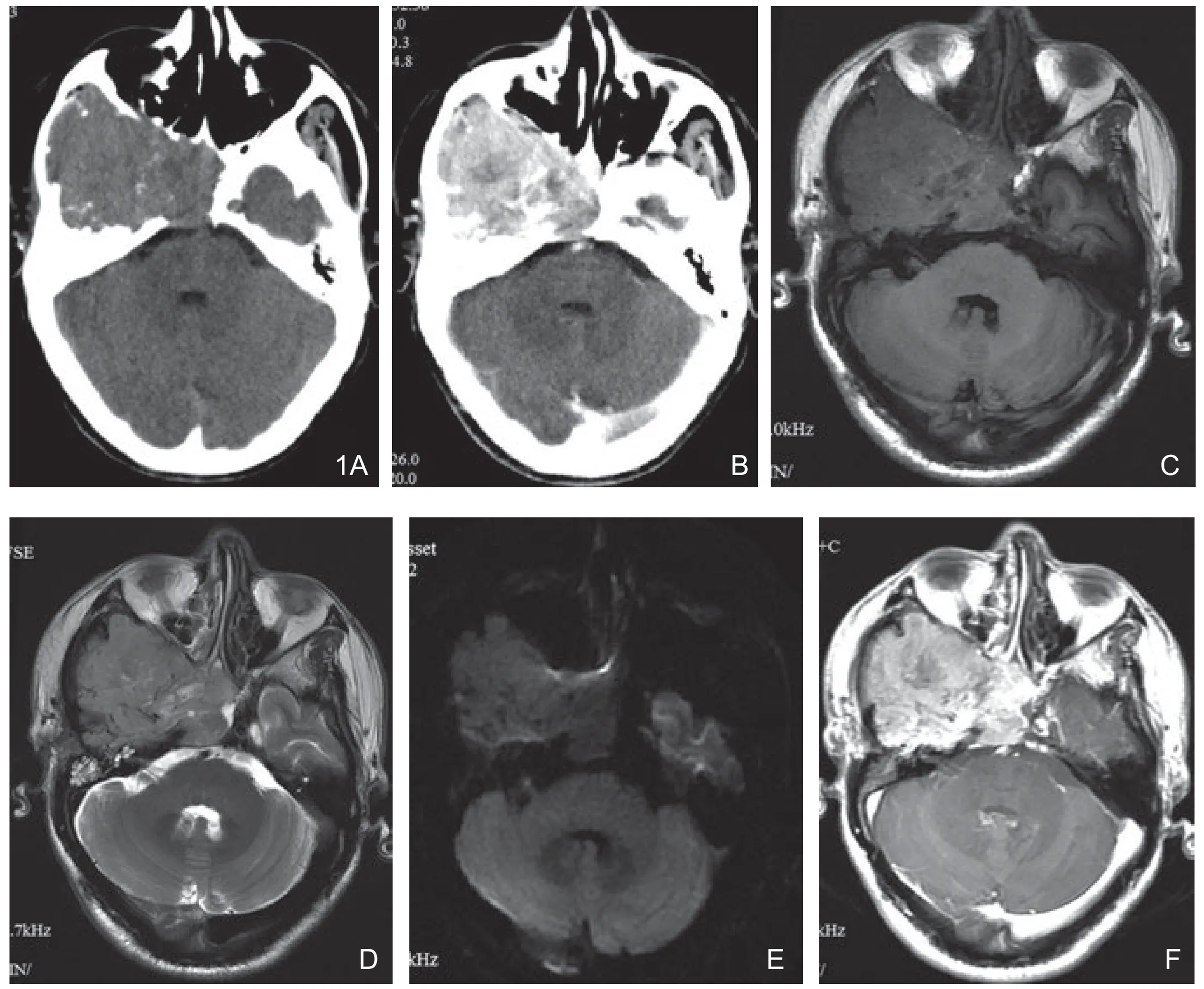
图1 右侧颞部 HPC。A.CT平扫肿瘤呈稍高密度伴邻近骨质破坏;B.CT增强肿瘤呈不均匀明显强化;C.MR T1WI呈不均匀等及稍低信号;D.T2WI肿瘤以等信号为主,伴不均匀高低混杂信号及血管流空影,无水肿;E.DWI肿瘤呈稍低信号。F.增强T1WI 肿瘤分叶状,不均匀显著强化,见强化血管影。
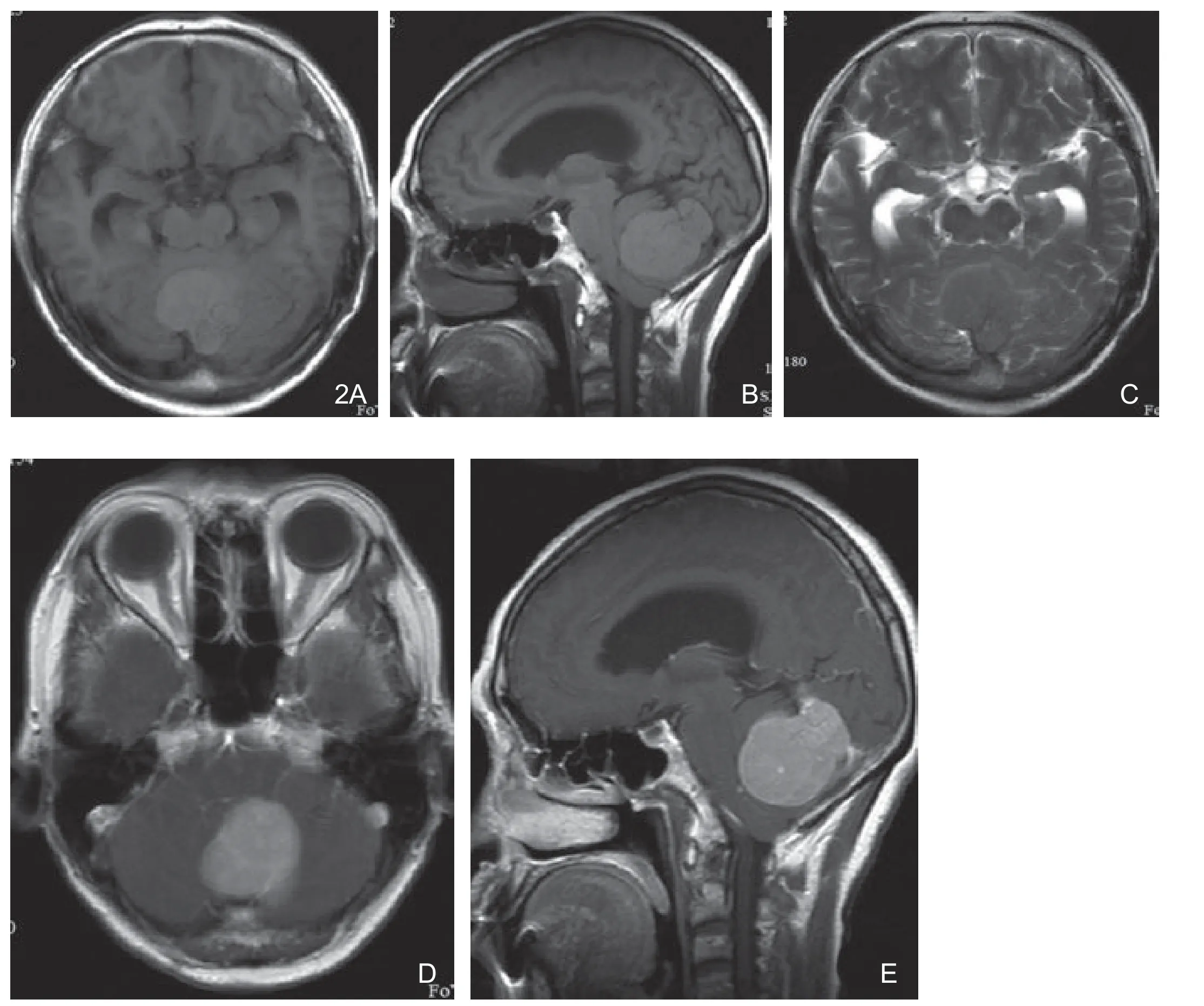
图2 幕下静脉窦旁HP。A.T1WI呈均匀稍高信号;B.矢状位T1WI显示肿瘤与小脑幕相连,向下压迫小脑蚓;C.T2WI呈均匀等信号,无瘤周水肿;D.增强T1WI轴位肿瘤均匀明显强化;E.增强矢状位肿瘤与脑膜窄基底相连,脑膜局限性轻度增厚、强化呈“脑膜尾征”。
(2)均采用GE Signa Horize 1.5T MRI仪,正交头线圈,所有患者扫描参数均相同。MR常规扫描:双回波质子密度(proton density,PD)PD/T2W成像,TR/TE1/TE2(2 900 ms/25 ms/93 ms),横断面和矢状面采用液体衰减反转恢复序列(fluid-attenuated inversion recovery sequence,Flair),TR/TE(8 000 ms/120 ms),层厚均为5 mm,无间隔扫描;DWI采用自旋回波-回波平面(SE-EPI)序列成像,(TR 6000ms,TE 70~80ms)(扩散敏感系数,b=0,1000 s/mm2)。增强扫描参数与平扫T1WI一致,对比剂采用钆喷酸葡胺(Gd-DTPA),剂量0.2ml/kg体重,分别行横轴位、矢状位及冠状位扫描。
结 果
1.肿瘤的部位、大小、形态
15例肿瘤均位于颅内脑外,幕上12例,大脑镰旁4例,颞顶部4例,颞枕部3例,侧脑室三角区1例;幕下静脉窦旁3例。瘤体最大径为2.3~7.8cm,平均4.3cm。10例呈不规则分叶状,5例呈类圆形或椭圆形。
2.CT表现
6例行CT平扫及增强,平扫均为稍高密度(图1A,3A),3例伴囊变、坏死;增强后均明显强化(图1B),2例伴脑膜尾征。
3.MRI表现
15例均行MRI常规平扫、DWI及增强,T1WI 与灰质比4例呈稍高信号(图2A,2B),7例呈等信号(图3B),4例呈稍低信号(图1C);T2WI 5例呈等信号(图1D,2C),10例呈稍高信号(图3C)。DWI 10例呈稍低信号(图1E),3例呈等信号,2例呈高低混杂信号。12例无或仅轻度水肿,3例中度水肿;11例瘤内伴囊变、坏死(图3),7例流空血管信号,3例颅骨破坏(图1)。MRI增强均明显强化,10例强化不均匀(图1F,3D),5例强化均匀(图2D,2E),6例伴“脑膜尾征”(图2E,3D)。
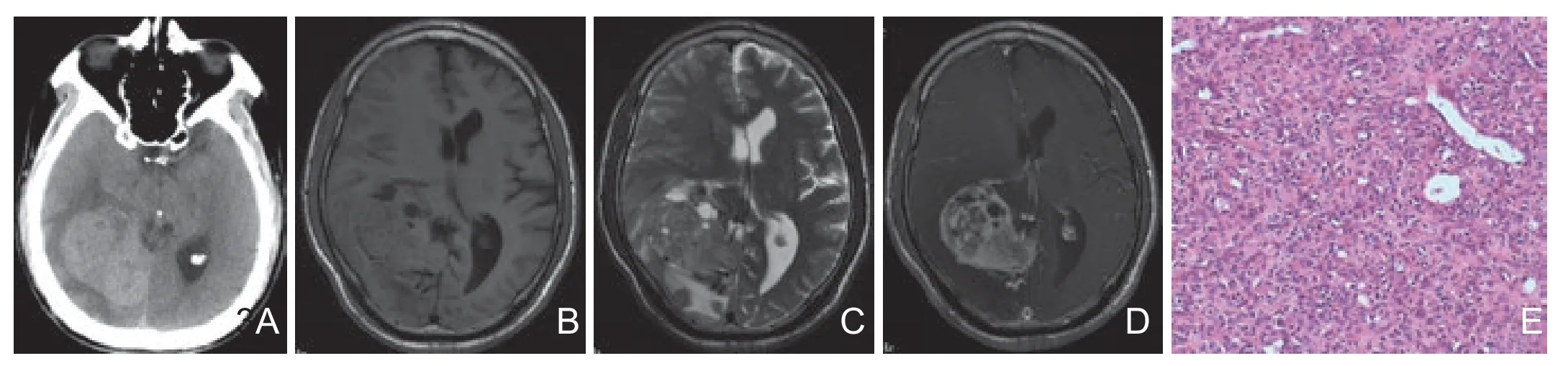
图3 右侧颞枕部HPC。A.CT平扫,肿瘤呈稍高密度伴囊变及轻度水肿;B.MR T1WI,肿瘤以等信号为主伴囊变;T2WI呈稍高信号,囊变区呈高信号;C.增强轴位T1WI,肿瘤不均匀明显强化,见强化血管影及“脑膜尾征”;D.镜下示:瘤内鹿角状的血管网,瘤细胞丰富,围绕血管(HE,×100)。
讨 论
1.HPC组织病理学及临床特点
HPC首先被Stout和Murray报道,可发生于身体的任何部位。颅内HPC与起源于蛛网膜帽细胞的脑膜瘤完全不同源,它是来源于脑膜间质血管外皮细胞的一种恶性肿瘤,具有明显的侵袭性[2],2007年WHO神经系统肿瘤分类中将其归类为脑(脊)膜间质肿瘤,定为Ⅱ~Ⅲ级,发病年龄多在38~45岁,男女比例接近2:1,与脑膜关系密切,多发生于颅底、矢状窦或大脑镰旁、小脑幕等硬脑膜或静脉窦附近[3-4]。本组发病年龄及部位与文献报道基本一致。
2.CT、MRI表现
颅内HPC呈类圆形、多分叶形,部分跨叶生长,边界清晰,周边脑实质可伴水肿,CT平扫呈均匀略高密度或密度不均匀伴坏死囊变,多不伴钙化,累及邻近颅骨时可伴骨质破坏。肿瘤较大时呈多分叶状对本病的诊断有一定提示意义,文献[5-6]认为其反映了肿瘤生长较快,在各个方向生长速度不同,所受的阻力不同,具有侵袭性生长的恶性特点,肿瘤分级多为Ⅲ级,有别于脑膜瘤的类圆形形态,具有一定的特性,本组10例肿瘤较大呈分叶状,与文献报道一致。本组12例无或仅轻度水肿,3例中度水肿,与文献[5-6]报道颅内HPC水肿较明显有一定差别,形成瘤周水肿的原因比较复杂,与肿瘤侵袭及增殖活动、肿瘤P73蛋白表达、发生部位、大小、静脉回流、血脑屏障破坏等诸多因素相关[7-8]。本组病例无瘤内钙化,与文献报道一致。HPC由于生长迅速致所需营养相对匮乏、肿瘤组织侵蚀破坏自身血管形成血栓,故坏死囊变、出血常见,信号多不均匀[8-9]。本组11例出现瘤内坏死囊变,与文献报道吻合。
文献报道[8-11]MRI平扫颅内HPC与脑膜瘤信号相似,表现为T1WI等或稍低信号,T2WI等或稍高信号。本组T1WI 4例呈稍高信号,7例呈等信号;T2WI 5例呈等信号,总体以等信号为主,但T1WI信号较脑膜瘤稍高,T2WI较脑膜瘤稍低,尤其是4例T1WI呈稍高信号,T2WI呈等信号,具有一定特异性及鉴别诊断价值,因为颅内肿瘤T1WI很少为高信号,此征象有利于缩小诊断和鉴别诊断的范围,T2WI为等信号又排除很多肿瘤。其病理学基础可能为HPC由梭形细胞构成,肿瘤细胞内缺少细胞器,胞质少,细胞内终丝和微细束显著,瘤细胞排列密集,水分比例较低,间质有丰富的网织纤维[12-13]。
本组10例DWI成像呈稍低信号,3例呈等信号,总体以稍低信号为主,在颅内肿瘤中很少出现,具有一定特异性,可作为HPC诊断的又一重要依据。总体来说,本病的弥散受限不明显,明显不同于脑膜瘤。推测其病理基础可能一方面与肿瘤细胞的成分及排列密集程度有关,另一方面也可能与肿瘤内含有丰富血管、坏死囊变较多,水分子扩散自由度高有关,有待于大样本量的影像与病理资料对比证实。
本组CT及MRI增强扫描,肿瘤均显著强化,与文献报道[12-16]一致。其中7例MRI平扫见血管流空影,增强扫描见明显强化血管。这是由于HPC有颈外动脉及颈内动脉双重供血,血供极为丰富,病理染色证实肿瘤间质有大量裂隙状血管。报道[14-15]认为肿瘤内流空的血管影,具有一定的特征性,是HPC的一个典型征象。本组增强后6例见“脑膜尾征”,较在脑膜瘤中出现概率低,其病理基础为肿瘤起源于间质血管外皮细胞,而非珠网膜帽细胞,反映肿瘤与脑膜的关系不够密切[16],也有研究认为“脑膜尾征”是由于肿瘤对脑膜的慢性、长期刺激所引起,HPC呈浸润生长,速度快,对硬膜刺激时间短[17]。本组3例肿瘤侵犯颅骨,表现为骨质破坏而无骨质增生,这在一定程度上也反映了肿瘤的侵袭性。
3.鉴别诊断
3.1 脑膜瘤:多呈类圆形,坏死囊变少,钙化多见,引起骨质增生多骨质破坏少,与脑膜关系密切呈宽基底,脑膜尾征多见并且较粗短,DWI以稍高信号为主,T1WI多为稍低信号,T2WI多为稍高信号,血管流空少见。HPC呈多分叶状,坏死囊变多,钙化少,引起骨质破坏而无增生,多与脑膜呈窄基底,脑膜尾征不明显,DWI以稍低信号为主,T1WI多为等及稍高信号,T2WI多为等信号,多见流空血管,强化较前者更明显并可见明显强化迂曲血管影。
3.2 淋巴瘤:颅骨和硬膜恶性淋巴瘤突出特征是颅骨两侧大的软组织肿块,多不伴坏死、囊变、钙化,与灰质呈等T1、等T2信号、DWI呈高信号,显著均匀强化,颅骨本身变化轻微,形态完整,明显有别于HPC的DWI稍低或等信号。
3.3 胶质瘤、转移瘤等恶性肿瘤:一般TlWI呈低信号,T2WI呈不均匀高信号,DWI呈稍高或高信号,与HPC较易鉴别。
综上所述,颅内HPC好发于大脑镰旁及静脉窦周围,有较为特征性的影像学表现:呈多分叶状,易坏死囊变,钙化少见,水肿较轻,窄基底与脑膜相连,邻近颅骨可出现破坏;CT平扫呈稍高密度,MRI平扫T1WI多呈等及稍高信号、T2WI以等信号为主、DWI以稍低信号为主;肿瘤血供极丰富,多见血管流空信号,增强扫描肿瘤明显强化并见化血管影。综合分析其CT及MRI特征,能够在术前做出正确诊断。
[1]Hayashi Y,Uehiyama N,Hyashi Y,et a1.A reevaluation of the primary diagnosis of hemangiopericytomas and the clinical importance of differential diagnosis from solitary fibrous tumor of the central nervous system.Clin Neuro Neumsurg,2009,11l:34-38.
[2]Mekni A,Kourda J,Chelly I,et a1.Hemangiopericytomas in the central nervous system.A study of eight eases .Neurochirurgie,2008,54:15-20.
[3]Jalali R,Sfinivas C,Nadkarni TD,et a1.Suprasellar haemangiopericytoma-challenges in diagnosis and treatment.Acta Neumehir,2008,150:67-71.
[4]张颉杜,杜固宏.颅内血管外皮细胞瘤106例临床分析.中华神经外科杂志,2010,26:935-937.
[5]董 驰,周俊林.颅内血管外皮细胞瘤瘤周水肿与P73表达的相关性.中国医学影像技术,2009,25:1980-1983.
[6]张 婧,周俊林,董 驰.不同分级颅内血管外皮细胞瘤的影像学表现与病理对照.中国医学影像技术,2012,28:861-864.
[7]董 驰,周俊林,段国兰.颅内血管外皮细胞瘤瘤周水肿与肿瘤侵袭性的关系.临床神经外科杂志,2010,7:17-19.
[8]魏晓辉,周俊林,黎卫平,等.颅内血管外皮细胞瘤囊变坏死与 P73表达相关性的研究.中国临床医学影像杂志,2010,21:9-11.
[9]潘 锋,祝跃明,周林江,等.颅内血管外皮细胞瘤的CT和MRI诊断.放射学实践,2012,27:1180-1182.
[10]Kano H,Niranjan A,Kondziolka D,et a1.Adjurant stereotactic radiosurgery after resection of intracranial hemangiopericytomas.Int J Radiat Oncol BiolPhys,2008,72:1333-1339.
[11]钱林清,王中领,郭 亮,等.颅内血管外皮细胞瘤的MRI特征.临床放射学杂志,2011,30:473-476.
[12]Hayashi Y,Uchiyama N,Hayashi Y,et a1.A reevaluation of the primary diagnosis of hemangiopericytomas and the clinical importance of differential diagnosis from solitary fibrous tumor of the central nervous system.Clin Neurol Neurosurg,2009,111:34-38.
[13]郑红伟,祁佩红,陈燕萍,等.颅内血管外皮细胞瘤的 CT、MRI 表现与病理分析.临床放射学杂志,2012,31:1224-1228.
[14]程劲松,李 镝.颅内血管外皮细胞瘤的MRI诊断.临床放射学杂志,2012,31:1088-1090.
[15]周建军,周康荣,曾蒙苏,等.颅内和体部血管外皮细胞瘤:MR平扫和动态增强的诊断价值.临床放射学杂志,2008,27:124-126.
[16]张泳华,王 旭,谭晓天,等.颅内血管外皮细胞瘤的MR影像诊断(附3例报告).临床放射学杂志,2011,30:903-905.
[17]崔 华,王晓雷,殷玉华,等.颅内血管外皮细胞瘤鉴别诊断分析.中华神经外科杂志,2011,27:261-263.
