非典型脑膜瘤MRI表现
2015-01-20许道洲
许 蕾 王 椋 许道洲
良性脑膜瘤(benign meningioma,BM)大多具有典型的MRI征象,一般不难诊断,而非典型性脑膜瘤(atypical meningioma,AM)的MRI表现多样,术前容易误诊。2000年和2007年的WHO病理分类[1-2],将其划分为Ⅱ级,具有潜在恶性。该肿瘤具有侵袭性,手术不易切除,术后极易复发,因此术前正确诊断对手术方案的制定和治疗起着非常重要的作用。本文回顾分析9例经病理证实为AM的MRI影像表现,旨在提高对该肿瘤的认识及术前诊断水平。
方 法
1.临床资料
回顾性分析2009年1月-2014年3月术前误诊术后经病理证实的9例AM患者资料。男性3例,女性6例。年龄30~65岁,平均54.2岁。临床主要表现有头痛、呕吐、头晕、运动感觉障碍、视物模糊、视力下降等。
2.MRI检查方法
使用3.0T SIEMENS TRIO TIM磁共振扫描仪,正交头颅线圈。平扫使用横轴位T1WI、T2WI、DWI序列检查、矢状面T2液体衰减反转恢复序列(FLAIR);增强扫描对比剂采用钆喷替酸葡甲胺,剂量为0.1mmol/kg体重,增强后使用T1WI序列行横轴位、矢状位、冠状位扫描,其中2例于增强扫描前行多体素氢质子磁共振波谱(1H-MRS)检查。
3.MRI图像分析
包括肿瘤部位、大小、形态,及其在MRI平扫、增强、DWI及MRS上的影像特点。
4.以手术病理为标准,按照2007年WHO分类诊断标准[2]
有下列3条指标的任何1条:
(1)核分裂象≥4/10HPF。
(2)具有下列5项组织学特征中的3项:①失去脑膜瘤的结构;②富于细胞;③核仁显著;④具有高核质比的小细胞;⑤局灶自发性坏死。
(3)肿瘤侵犯脑组织。
结 果
1.肿瘤的部位、大小及形态
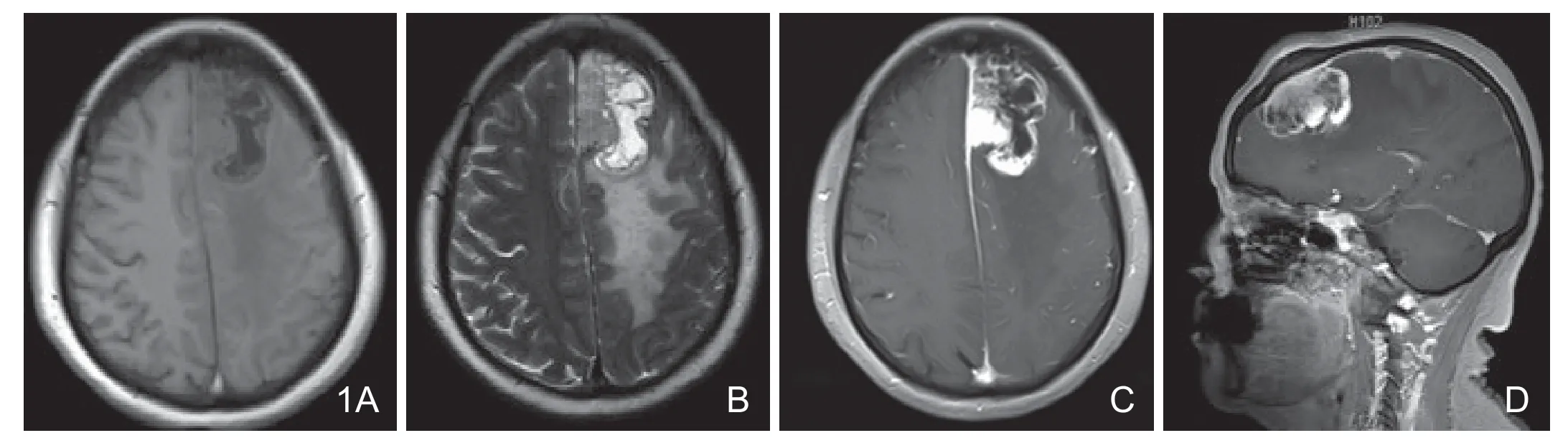
图1 术前误诊为胶质瘤。A.T1WI示左额镰旁囊实性占位,实性部分呈等低信号,瘤脑界面不清伴瘤周水肿;B.T2WI示肿瘤实性部分呈等高信号;C.增强轴位示肿瘤明显不均匀性强化,囊变坏死区无明显强化,大脑镰增厚伴强化;D.增强矢状位示肿瘤相邻硬脑膜增厚伴强化,邻近颅骨骨质增生性改变。
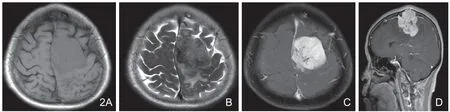
图2 术前误诊为胶质瘤。A.T1WI示左额镰旁分叶状实性占位,呈等信号为主,肿瘤内后方瘤脑界面不清伴瘤周水肿;B.T2WI示肿瘤信号不均匀,内部可见散在低信号,中线结构右偏;C.增强轴位示肿瘤明显不均匀性强化,可见散在颗粒状低信号;D.增强T1WI矢状位示肿瘤顶部侵透颅骨达邻近头皮下软组织,软组织肿胀伴外凸改变。
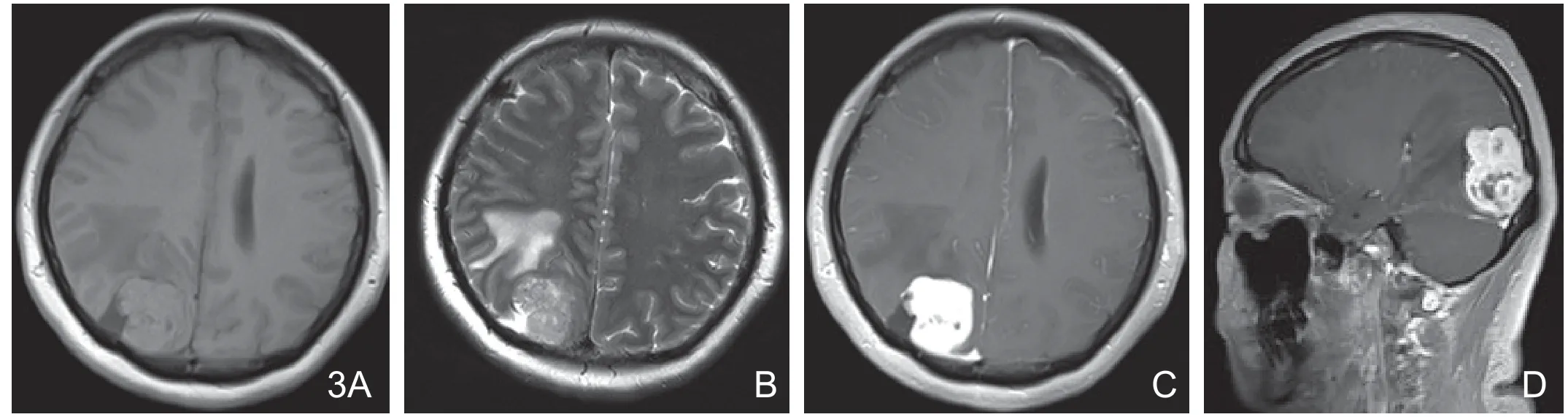
图3 术前误诊为胶质瘤。A.T1WI示左枕镰旁分叶状实性占位,呈等信号为主,肿瘤右侧缘可见形态不规则“脑脊液湖”征;B.T2WI示肿瘤边缘高信号的“脑脊液湖”征;C.增强轴位肿瘤明显不均匀性强化,“脑脊液湖”无明显强化;D.增强矢状位示肿瘤不均匀性强化伴相邻枕骨骨质变薄,内板骨质毛糙。
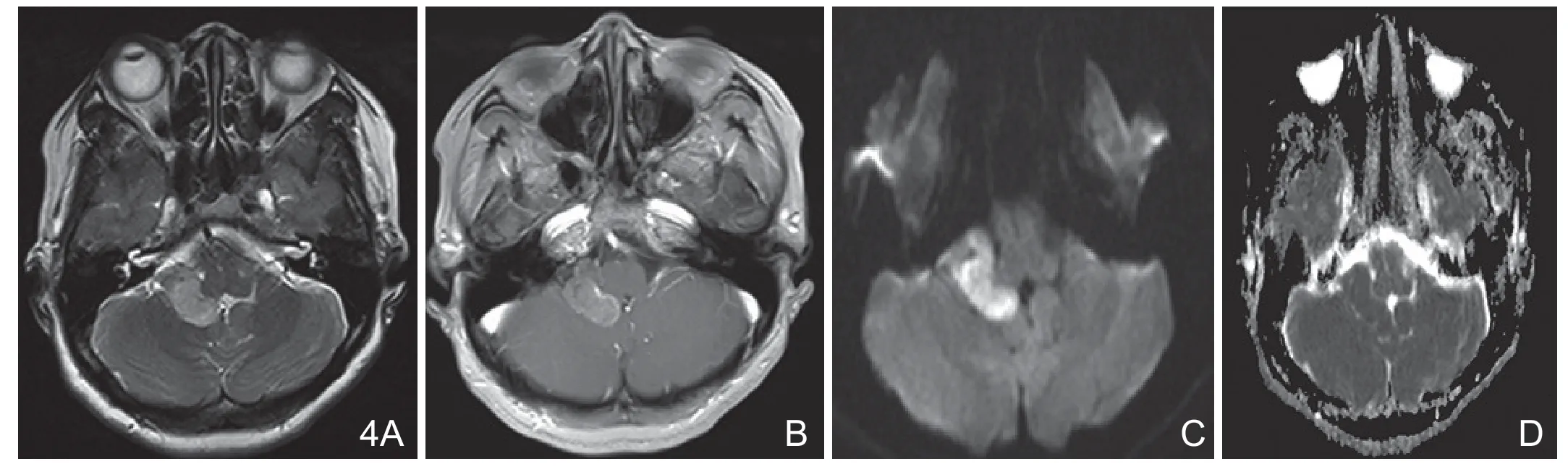
图4 术前误诊为听神经鞘瘤。A.T2WI示右侧桥小脑角区“蚕豆状”占位性病变,以略长T2信号为主;B.T1WI增强扫描示肿瘤中度不均匀性强化;C.DWI示肿瘤明显扩散受限;D.示ADC值下降。
肿瘤位于额区4例、枕区2例、岩锥区、桥小脑角区及桥延交界区各1例。肿瘤直径大小约1.8~5.9cm,平均为4.6cm。形态不规则6例,分叶状2例,蚕豆状1例。
2.肿瘤MRI表现
T1WI上等信号2例、等略低信号3例、低信号2例及混杂信号2例;T2WI上高信号4例、等信号2例、低信号1例及混杂信号2例;FLAIR序列上呈高信号4例、等信号2例、低信号1例及混杂信号2例;脑外占位征象不明显,瘤脑界面不清6例(图1);周围脑组织水肿7例;邻近骨质破坏4例(图2);病变内合并钙化4例;有形态不规则粗短脑膜尾症2例;增强后均匀强化3例、不均匀强化4例、囊壁强化1例、爆米花样强化1例;5例肿瘤周围见“脑脊液湖征”(图3);DWI检查3例呈明显高信号(图4)、4例呈高低混杂信号、2例呈低信号;2例MRS检查示NAA峰下降低平、Cho明显升高、Cr下降。
3.肿瘤术前误诊情况
本组9例术前误诊为胶质瘤4例、转移瘤2例、听神经鞘瘤、舌咽神经鞘瘤、海绵状血管瘤各1例。
讨 论
1.AM的组织病理学分类变化
AM是介于良性脑膜瘤和恶性脑膜瘤之间的中间型肿瘤,WHO中枢神经系统肿瘤分级为Ⅱ级,属于低度恶性肿瘤,文献报道[3]非典型脑膜瘤占所有脑膜瘤的4.7%~7.2%。1993年WHO神经系统分类中首次提出AM的概念,2000年WHO的脑膜瘤分类中将AM与脊索瘤样型、透明细胞型一起定义为WHOⅡ级脑膜瘤[4]。与2000年版WHO关于AM的诊断标准相比,2007版WHO在维持2000版诊断标准的基础上新增了脑实质侵犯作为单独一条诊断AM的指标[5]。新增加的诊断条件给影像学中的MRI检查带来“机遇”,由于MRI成像具有更高软组织分辨率,且能多方位成像,可更好了解肿瘤特性及与周边结构的解剖关系,能够很好地显示肿瘤对脑实质侵犯程度。随着磁共振扩散加权成像(diffusion weighted imaging,DWI)与氢质子磁共振波谱(proton magnetic resonance spectroscopy,MRS)检查技术不断完善及临床应用,使脑肿瘤的诊断从形态学研究上升到功能、代谢并重的研究,因此笔者认为MRI检查对AM术前诊断及了解与相邻组织的关系具有重要临床意义。
2.MRI表现
本组AM的MRI特点如下。
2.1 脑外占位征象不明显:典型脑膜瘤来源于蛛网膜内皮细胞或硬膜内的脑膜上皮细胞,属于脑外肿瘤。好发于大脑凸面、矢状窦旁及大脑镰旁、岩椎旁等。典型脑膜瘤肿块均匀,边缘光滑,常呈圆形或类圆形,与脑膜或颅板广基底相连,对周围脑组织推压形成脑外肿瘤的典型征象脑白质塌陷征。放射科及临床医生根据该征象可以鉴别脑内肿瘤,然而本组中有6例脑外占位征象不明显,术前影像诊断中有4例误诊为胶质瘤、2例误诊为转移瘤。如本组图1病例所示,平扫见左侧大脑“额叶内”约5.32cm×3.68cm×5.37cm大小的不规则占位性病变,T2WI高信号,T1WI低信号,周围见大范围水肿区,左侧脑室受压变形,脑中线结构轻度右移。增强扫描病灶明显不均匀强化,边缘呈花边状,有宽基底与左侧大脑凸面及大脑镰相连,病灶部分通过大脑镰累及右侧,病灶邻近脑膜明显强化,有短小“脑膜尾征”,邻近颅骨受累增厚,并略向外凸术前误诊为胶质瘤,手术病理为非典型性脑膜瘤合并囊变坏死。笔者认为:造成误诊的主要原因是AM对脑实质的侵犯破坏,肿瘤定位错误。常规诊断思维首先是肿瘤定位,然后才是定性,当一个肿瘤定位于脑内时,会忽略了对脑膜瘤的考虑,虽然也时有脑内脑膜瘤的个例报道[6],但也大都是回顾性分析,术前误诊率还是很高的。
2.2 相邻颅板有不同程度的骨质破坏或板障增厚及软组织肿胀:本组出现4例。与典型脑膜瘤对颅骨产生压迫骨质吸收变薄不同,AM对颅骨的侵犯说明了AM的侵袭性,有报道称颅骨或颅外侵犯增加AM的复发风险[7]。本组图2病例所示,肿瘤突破颅骨内板、板障达头皮下,在皮下形成一包块,相邻上矢状窦也受侵犯,给手术完整切除带来了困难。因此术前检查时放射科医生在诊断报告中应该详细描述肿瘤侵犯的深度、范围、邻近血管神经及有功能脑组织,以便神经外科医生做好充分的术前准备,同时也为术前向患者及家属知情告知提供影像依据。
2.3 瘤体钙化:由于MRI观察钙化不如CT,临床医生往往忽略了钙化在MRI上的表现,然而笔者认为MRI检查观察肿瘤钙化也有其独特的优势,因为钙化在CT上往往密度很高,由于窗宽窗位的关系,使的钙化周围以及其内的软组织显示不佳,给CT检查上颅内钙化的病因诊断带来了困难,而MRI钙化和周围组织的对比不高,更容易观察内部以及周围的软组织细节,从而得到更加丰富的信息,给临床医生诊断及鉴别诊断带来了便利。有文献报道AM内钙化少见[8],本组内有5例出现钙化,与文献报道不同,MRI显示肿瘤内钙化表现为:TIW、T2WI、FLAIR像呈等略低为主的不均匀性混杂信号,DWI呈低信号,ADC图上成不均匀性高信号,强化后成不规则样、裂隙样、条样低信号。
2.4 肿瘤周围“脑脊液湖”征:虽然AM在影像学上为表现不典型,但其病理分类属于Ⅱ级脑膜瘤的一个亚型,固属于脑外肿瘤,因此仍然具有脑外肿瘤的一些特征。“脑脊液湖”征是由于肿瘤推压软脑膜,在肿瘤与蛛网膜下腔之间形成脑脊液潴留,如本组图3病例所示MRI表现为在肿瘤与脑组织之间形态不规则的信号,其信号特点同脑脊液信号。本组病例中有5例显示有“脑脊液湖征”,因此笔者认为AM的“脑脊液湖”征是诊断AM的一个特征性征象,是脑内、外肿瘤的一个重要鉴别征象。
2.5 肿瘤DWI表现:AM的DWI表现多种多样,本组DWI高低混杂信号占多数的原因,笔者认为与本组AM内部多数合并坏死、囊变、钙化导致信号不均匀有关。DWI通过ADC值进行量化,多数研究表明[9-10]ADC值与肿瘤组织的细胞密度及肿瘤分级有良好相关性,ADC值可以鉴别脑膜瘤病理亚型及良恶性,但之间数据有交叉重叠。AM属于低度恶性肿瘤,肿瘤细胞数多,核质比大,细胞排列紧密,细胞外间隙减小,DWI上可表现为高信号,ADC值下降。如图4所示病例,平扫右桥小脑角区“蚕豆状”占位性病变,与邻近听神经关系密切,增强扫描病变明显强化,术前考虑为听神经鞘瘤。本例术前定位脑外占位正确,过于注重肿瘤的发病部位及与听神经的关系,忽视了DWI的图像特点导致定性错误。AM与听神经鞘瘤肿瘤内部均可发生坏死囊变,但肿瘤实质部分前者DWI通常表现为高信号,ADC值下降,后者DWI常表现为等低信号,ADC值升高。因此,当肿瘤具有脑外占位征象,DWI表现为明显扩散受限时,要考虑到AM的可能。
2.6 肿瘤MRS表现:脑膜瘤是脑外肿瘤,理论上1H-MRS中检测不到代表神经元代谢的N-乙酰天冬门氨酸(N-acety aspartate,NAA),但AM对周围脑组织具有侵袭性,因此在MRS检查中常因肿瘤边缘混入邻近脑组织神经元的成分而出现NAA峰。本组2例术前行MRS检查,表现为NAA峰下降低平、胆碱(choline,Cho)明显升高、肌酸(creatine,Cr)下降,与脑内肿瘤MRS表现类似,结合平扫图像误诊为星形细胞肿瘤。术前缺乏判读经验,仅重视1H-MRS波谱中这3个主峰的表现,未进一步对丙氨酸(alanine,Ala)、谷氨酰胺及谷氨酸复合物(glutamine/glutamate,Glx)、脂质(1ipid,Lip)峰进行详细判读是导致误诊的原因。有研究认为[11-12]Ala峰与Glx峰两者增高是脑膜瘤的特征性表现,脑内星形细胞肿瘤无此峰显示;而Lip峰是坏死前恶变的早期标志,它的出现可以高度提示恶性脑膜瘤的可能[13]。因此,当AM与星形细胞肿瘤在形态学方面鉴别困难时,MRS检查有重要的鉴别意义。
3.鉴别诊断
AM应与其他肿瘤加以鉴别:①当AM脑内脑外定位困难时,需与胶质瘤、颅内单发转移瘤及淋巴瘤相鉴别。胶质瘤是好发于幕上的脑内肿瘤,男性多见。常合并坏死、出血,增强扫描肿瘤呈不规则花环状强化,肿瘤无粗短不规则的“脑膜尾征”,对周围骨质破坏者少见。颅内单发转移瘤患者年龄较大并有原发病史,瘤周水肿较AM明显,增强扫描多呈环形强化。淋巴瘤好发于脑内中线区,浸润性生长,坏死囊变少见,DWI常表现为扩散受限呈明显高信号。在MRS中两者具有不同的特征,淋巴瘤常可见宽大的Lip峰,而脑膜瘤则可见特征性的Ala与Glx峰[14]。②当AM具有脑外占位征象时,需与血管外皮细胞瘤相鉴别。血管外皮细胞瘤过去被认为是脑膜瘤的一种亚型,后被确认来源于毛细血管周围的外皮细胞,MRI通常表现为窄基底与硬脑膜相连,坏死囊变多见,钙化少见,常引起邻近溶骨性骨质破坏。结合MRS检查,Majos等[12]认为血管外皮细胞瘤可表现为Cho峰的升高和极小的Lip峰,但肌醇(MI)峰的明显升高对两者的鉴别诊断有更重要的意义。③AM与各型脑膜瘤的鉴别。WHO I级良性脑膜瘤通常形态规则呈圆形或类圆形,大部分具有典型脑外占位的征象,较少出现坏死囊变,增强扫描多呈均匀性强化;WHOⅡ级中脊索瘤样型脑膜瘤以散在多发钙化为特点;透明细胞型好发在桥小脑角区,在T2WI上常表现为较高信号;WHO III级中间变型脑膜瘤与AM影像表现存在部分交叉,但肿瘤内部坏死囊变更常见,周围水肿更明显,位于镰旁的病变可以侵袭大脑镰生长至对侧,在DWI上扩散受限较AM更明显,ADC值下降也更低。④以囊性为主的脑膜瘤需与其他颅内囊性病变鉴别:如囊性星形细胞瘤、血管母细胞瘤等,鉴别诊断的关键是确定前者位于脑外。⑤桥小脑角区AM需与听神经鞘瘤的鉴别:成人桥小脑角区最常见的肿瘤是听神经鞘瘤,临床以耳聋、耳鸣、头痛、眩晕、面部麻木为主要症状。CT或MRI扫描可见肿瘤以内听道为中心向周围生长,内听道扩大部分呈“喇叭口样”,无脑膜尾征,常无钙化。
总之AM的影像表现不典型,但仍具有脑外肿瘤的影像学特征。注重观察肿瘤的形态学特征,如肿瘤生长部位靠近脑膜、有“脑脊液湖”征,常有邻近颅骨及脑组织等周围结构的侵犯;联合DWI上肿瘤实质部分扩散受限,ADC值下降及MRS上出现特征性的Ala与Glx峰等影像学特点,将更有利于术前对AM的正确诊断,从而对肿瘤定性及判定肿瘤与周围组织结构的关系具有重要的临床价值。
[1]Gonzales M.The 2000 World Health Organization classification of tumors of the nervous system.Clin Neurosci,2001,8:1-3.
[2]Louis DN,Ohgaki H,Wiestler OD,et al.The 2007 WHO classification of tumours of the central nervous system.Acta neuropathol,2007,114:97-109.
[3]魏大年,牟永告,张湘衡,等.30例非典型性脑膜瘤患者临床病理特征与预后分析.中国神经精神疾病杂志,2009,35:513-516.
[4]Zhang J,Chi LY,Meng B,et al.Meningioma without dural attachment:case report,classification,and review of the literature.Surg Neuro,2007,67:535-539.
[5]陈星荣,沈天真,汪 寅,等.学习“2007版中枢神经系统肿瘤的病理分类”.中国医学计算机成像杂志,2009,15:201-206.
[6]Gabeau-Lacet D,Aghi M,Betensky R,et al.Bone involvement predicts poor outcome in atypical meningioma.J Neurosurg,2009,111:464-471.
[7]李向荣,龙莉玲,等.27例非典型性脑膜瘤的CT、MRI表现与病理对照分析.重庆医学,2011,40:2659-2661.
[8]叶 红,黄朝南.CT及MRI对非典型脑膜瘤的诊断价值.中国CT和MRI杂志,2012,10:24-25.
[9]雍 防,张发林,滔爱珍,等.常规MRI结合DWI在良恶性脑膜瘤鉴别诊断中的应用.放射学实践,2010,25:851-854.
[10]尹 丹,邓利猛,王小宜,等.ADC值术前评价脑膜瘤病理级别的研究.临床放射学杂志,2006,25:497-501.
[11]Opstad KS,Provencher SW,Bell BA,et a1.Detection of elevated glutathione in meningiomas by quantitative in vivo1H-MRS MRS.Magn Reson Med,2003,49:632-637.
[12]Majos C,Alonso J.Utility of proton MR spectroscopy in the diagnosis of radiologically atypical intracranial meningiomas.Neuroradiology,2003,45:129-136.
[13]Howe FA,Barton SJ,Cudlip SA.Metabolic profiles of human brain tumors using quantitative in vivo1H magnetic resonance spectroscopy.Magn Reson Med,2003,49:223-232.
[14]王春红,宋光义,高兴军,等.磁共振波谱在非典型淋巴瘤与脑膜瘤鉴别诊断中的应用.实用放射学杂志,2011,27:1136-1138.
