重组人肠三叶因子对结肠癌HT-29 细胞移行能力的影响及其机制研究
2015-01-16李腾彭曦
李 腾 彭 曦
严重创伤、烧伤、感染等应激状态下,由于胃肠道血液灌流障碍发生早,血供恢复慢,从而导致肠黏膜屏障功能受损,这也是引发肠源性感染、肠源性高代谢、全身炎症反应综合征(SIRS)和多器官功能不全(MODS)的重要诱因[1]。因此,如何减轻肠道损伤,促进肠黏膜修复已经成为目前烧伤治疗学关注的核心问题。肠三叶因子(intestinal trefoil factor,ITF)是近年来研究发现具有独特结构的低分子多肽类物质,它能够维持肠黏膜的完整性,促进肠黏膜修复,但其作用机制尚未完全清楚[2]。为此,本实验将采用Transwell 和免疫印迹方法,观察给予重组ITF(rhITF)后,HT -29 细胞移行能力和细胞间黏附分子β -catenin 与E-cadherin 的变化,并探讨其促进细胞迁移的可能机制,为ITF 的临床应用奠定理论基础。
材料与方法
1.细胞系:人结肠癌细胞系HT-29 购置于中科院细胞所。
2.主要的药物与试剂:重组表达的人肠三叶因子(rhITF)由第三军医大学附属西南医院烧伤研究所提供,1640 培养基购自美国Gibco 公司,小牛血清购自奥地利PAA 公司,8μm Transwell 小室购自美国Corning 公司,β -catenin 抗兔抗体、E-cadherin 抗鼠抗体和磷酸化β -catenin 鼠抗人单抗(Y654)购自美国Abcam 公司,HRP 标记的羊抗兔二抗和HRP 标记的羊抗小鼠二抗购自北京碧云天公司。
3.细胞培养:结肠癌HT -29 细胞培养于含10%的小牛血清、100U/ml 青霉素和100U/ml 链霉素的1640 培养液中。培养条件为37℃,5%CO2,饱和湿度,每隔2 ~3 天传代1 次,用0.25%的胰蛋白酶消化,取对数生长期细胞进行实验,实验前用倒置显微镜观察,细胞形态良好,折光性强。
4.观察指标及检测方法:(1)Transwell 法观察rhITF 对HT-29 细胞移行能力的影响:将细胞分为阴性对照组(1640培养液),撤掉血清后的不同浓度组:10μg/ml rhITF 组、25μg/ml rhITF 组和50μg/ml rhITF 组。收集对数期无血清培养基稀释的HT-29 细胞,调整细胞悬液浓度5 ×106个/毫升,取100μl 接种于Transwell 小室的上室。下室中添加600μl 各浓度组别的培养液,37℃、5%CO2条件下培养12h 后分别用甲醇固定20min,1g/L 结晶紫染色15min,清水清洗数遍后镜下计数,每组取10 个视野,算均值。(2)Western blot 法观察rhITF 对β-catenin、E -cadherin 和磷酸化β -catenin 的蛋白表达影响:50μg/ml 浓度的rhITF 分别在4、8、12 和24h 处理HT-29 细胞,用凯基蛋白提取试剂盒进行蛋白提取和蛋白浓度检测。8% SDS-PAGE 凝胶电泳分离后转移至PVDF 膜,用100ml 含5%脱脂奶粉或者5% BSA 进行封闭,β -catenin抗兔抗体(1∶300)、E-cadherin 抗鼠抗体(1∶300)和磷酸化β-catenin 鼠抗人单抗(1∶200),4℃下孵育过夜,TBST 洗膜,HRP 标记的二抗,室温孵育1h,ECL 化学发光显影。
5.统计学方法:Western blot 法实验结果使用Image -Pro Plus 分析蛋白灰度,目的蛋白的灰度=目的蛋白IOD 值/相应内参IOD 值。计量资料应用SPSS 17.0 统计软件包分析处理,采用单因素方差分析,结果以均数±标准差(±s)表示,以P <0.05 为差异有统计学意义。
结 果
1.rhITF 对HT -29 细胞移行能力的影响:通过穿膜细胞数的改变检测rhITF 对HT-29 细胞移行能力的影响。50μg/ml rhITF 组的细胞数显著多于阴性对照组、10μg/ml rhITF 组和25μg/ml rhITF 组,差异有统计学意义(P <0.01),25μg/ml rhITF 组与阴性对照组比较,差异有统计学意义(P <0. 05)。而10μg/ml rhITF 组与阴性对照组比较,差异无统计学意义(P >0.05,图1、表1)。

图1 穿过微孔膜的HT-29 细胞结晶紫染色结果(×200)
表1 Transwell 迁移实验穿膜细胞数(±s,n=10)

表1 Transwell 迁移实验穿膜细胞数(±s,n=10)
组别 穿过Transwell 小室的细胞数阴性对照组113.43 ±4.62 10μg/ml rhITF 组 128.52 ±8.71#25μg/ml rhITF 组 143.10 ±18.54* #50μg/ml rhITF 组 210.64 ±25.73**
2.Western blot 法检测β-catenin 和E-cadherin的蛋白含量表达:(1)rhITF 对β -catenin 蛋白表达影响:Western blot 法检测显示正常对照组、4h 组、8h组、12h 组和24h 组,电泳条带对应的相对分子质量约为95kDa。应用Image -Pro Plus 图像分析软件进行灰度分析:加入rhITF 后,β-catenin 的蛋白表达呈下降趋势,与正常对照组、4h 组、8h 组和24h 组比较,12h 组β-catenin 的蛋白表达明显降低(P <0.05)(图2)。(2)rhITF 对E -cadherin 的蛋白表达影响:Western blot 法检测显示正常对照组、4h 组、8h 组、12h 组和24h 组,电泳条带对应的相对分子质量约为120kDa。应用Image-Pro Plus 图像分析软件进行灰度分析:加入rhITF 后,E -cadherin 的蛋白表达呈下降趋势,与正常对照组、4h 组、8h 组和24h 组比较,12h 组E-cadherin 的蛋白表达明显降低(P <0.05)(图3)。(3)rhITF 对磷酸化β -catenin(Tyr654)的蛋白表达影响:Western blot 法检测显示各组电泳条带对应的相对分子质量约为86kDa。应用Image -Pro Plus 图像分析软件进行灰度分析:加入rhITF 后,与正常对照组、4h 组、8h 组和24h 组比较,12h 组磷酸化β-catenin(Tyr654)的蛋白表达明显增强(P <0.05,图4)。
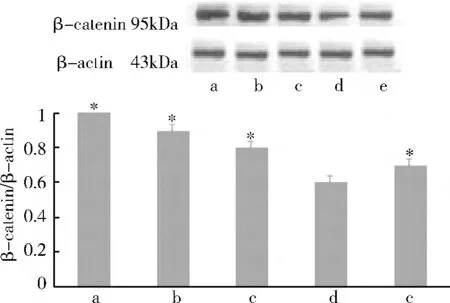
图2 rhITF 对β-Catenin 蛋白表达影响
讨 论
烧伤后肠黏膜组织修复和重建是一个非常复杂并受多因素影响的过程,主要由细胞增殖、细胞分化和细胞移行共同协调完成,其中细胞移行属于快速修复机制,在肠黏膜早期修复中起着关键作用[3]。前期研究发现,与众多生长因子相比,ITF 对肠黏膜修复具有特异性功能。ITF 是由杯状细胞分泌的低分子多肽类物质,含有59 个氨基酸多肽,6 个半胱氨酸残基,以3 个链内二硫键形成独特的“三叶草”结构,其结构的高度保守使之具备抗蛋白酶、抗酸和抗热分解的生物学活性[4]。此外,ITF 可以与黏蛋白相互作用形成黏液凝胶层,支持固定肠黏膜,并增强肠黏膜防御损伤的能力[5]。

图3 rhITF 对E-cadherin 蛋白表达影响
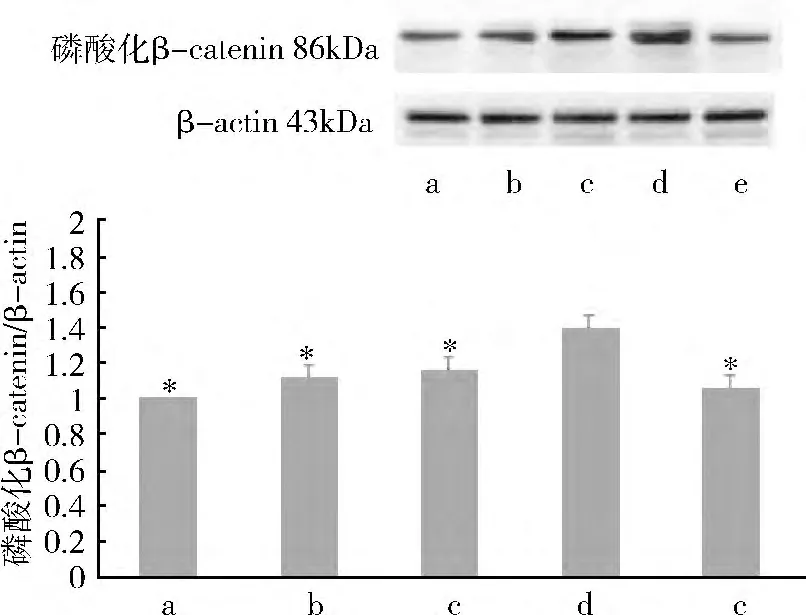
图4 rhITF 对磷酸化β-catenin(Tyr654)蛋白表达影响
实验结果显示,ITF 对肠黏膜的修复作用与其促进HT-29 细胞移行有关。rhITF 能显著增加细胞移行能力,通过改变细胞形态,增加穿越微孔的细胞数量,并呈现典型的浓度依赖效应,从而促进细胞移行。前期的研究结果也证实,在黏蛋白的协同作用下,ITF促进细胞移行的效率大幅度增加[6]。但是ITF 又是如何促进细胞移行,具体的作用机制是什么,这也是本实验研究的核心问题。细胞尾部与相邻细胞或基质的分离是细胞移行的限速步骤,主要受控于细胞之间的黏附连接。钙黏蛋白(E -cadherin)作为一种跨膜糖蛋白,与细胞内的β -连环蛋白(β -catenin)构成E-cadherin/β-catenin 复合物,并交联于胞内骨架微丝系统,从而构成细胞之间的主要黏附连接[7]。因此,β -catenin 和E -cadherin 被视为是细胞移行的主要限制因素,研究ITF 对二者之间的调控作用,对于了解ITF 促细胞移行的作用机制具有重要意义。本实验Western blot 法检测结果显示,与其他时相点组比较,12h 时β -catenin 和E -cadherin 的蛋白表达均明显下降,经灰度值分析,差异具有统计学意义。结果提示,rhITF 作用12h 时通过抑制β -catenin 和E-cadherin 的蛋白表达,从而减少E -cadherin/β -catenin 复合物,降低细胞之间的黏附,促进细胞迁移。
β -catenin 和E - cadherin 除了参与细胞间的黏附之外,还调控多条信号转导通路,由此推测ITF可能是通过某些信号转导通路促进细胞移行。酪氨酸激酶受体通路被认为是最重要的转导通路之一,基本上所有的生长因子刺激细胞而产生的信号都与此通路有关[8]。生长因子受体本身具有酪氨酸激酶活性,生长因子与其受体结合后,不光使受体自身发生磷酸化,同时也使相应底物发生酪氨酸磷酸化,信号就通过受体进入到细胞内而发挥作用[9]。相关研究表明,EGF 和TGF - β1 能够诱导β -catenin的酪氨酸磷酸化水平上调[10]。前期研究结果证实,在肠上皮细胞膜上存在与ITF 特异性结合的受体(ITFR),ITF 很可能是通过ITFR 参与众多的细胞转导通路[11]。Western blot 法检测结果显示,在rhITF 的刺激下,磷酸化β -catenin 的表达随着时间递增而加强,12h 时磷酸化β -catenin 蛋白表达明显增强。
由此可见,ITF 促进细胞迁移的机制可能是当外源性的ITF 刺激细胞后,通过与其受体ITFR 结合作用后,β-catenin 发生酪氨酸磷酸化,使E-cadherin/β-catenin 复合体从肌动蛋白丝上解离,导致E -cadherin 介导细胞间黏附功能丧失,细胞之间连接松散,从而促进细胞迁移[12]。ITF 促进细胞移行的分子机制研究尚处于起始阶段,具体的信号通路及调控机制还需进一步探索。
1 Neal MD,Richardson WM,Sodhi CP,et al. Intestinal stemcells and their roles during mucosal injury and repair[J]. J Surg Res,2010,33(1):1 -8
2 Barrera GJ,Sanchez G,Gonzalez,et al. Trefoil factor 3 isolated from human breast milk downregulates cytokines (IL8 and IL6)and promotes human beta defensin (hBD2 and hBD4)expression in intestinal epithelial cells HT-29[J]. Bosn J Basic Med Sci,2012,12(4):256 -264
3 Samson MH,Poulsen SS,et al. Trefoil factor family peptides in the human foetus and at birth[J]. Eur J Clin Invest,2011,41 (7):785 -792
4 Xu CC,Yue L,Wei HJ,et al. Significance of TFF3 protein and Her-2/neu status in patients with gastric adenocarcinoma. [J]. Pathology Research and Practice,2013,209(8):479 -485
5 Krishnan K,Arnone B,Buchman A. Intestinal growth factors:potential use in the treatment of inflammatory bowel disease and their role in mucosal healing[J]. Inflamm Bowel Dis,2011,17 (1):410 -422
6 王焕,吴修文,万千雪,等. 肠三叶因子和黏蛋白对烧伤血清所致肠上皮细胞增殖移行能力变化的影响[J]. 中华烧伤杂志,2011,27(5):347 -352
7 Kadri SR,Lao - Sirieix P,O'Donovan M,et al. Acceptability and accuracy of a non-endoscopic screening test for Barrett's oesophagus in primary care:cohort study[J]. BMJ,2010,341(1):4372 -4376
8 Zheng QQ,Gao J,Li HL,et al.Trefoil factor 3 peptide regulates migration via a Twist-dependent pathway in gastric cell[J]. Biochemical and Biophysical Research Communications,2013,438(1):6 -12
9 Xu Q,Chen MY,He CY,et al. Promoter polymorphisms in trefoil factor 2 and trefoil factor 3 genes and susceptibility to gastric cancer and atrophic gastritis among Chinese population [J]. Gene,2013,529(1):104 -112
10 Susumu A,Yasukazu O,Toshiaki G,et al. Tests for serum levels of Trefoil factor family proteins can improve gastric cancer screening[J]. Gastroenterology,2011,141 (3):837 -845
11 Kim CH,Kim D,Ha Y,et al. Expression of mucins and trefoil factor family protein-1 in the colon of pigs naturally infected with salmonella typhimurium[J]. Journal of Comparative Pathology,2009,140(1):38 -42
12 Nikola B,Tatjana B,Mirela BL. Trefoil factor family protein 3(TFF3)is present in cartilage during endochondral ossification in the developing mouse fetus[J]. Acta Histochemica,2013,115(3):204 -208
