热休克蛋白HSP90α 和miRNA-144 在小鼠肾缺血再灌注损伤后的表达变化
2015-01-16孔晓君韩俊岭李建远
孔晓君 韩俊岭 高 鑫 李建远
肾缺血再灌注损伤是一个常见的临床问题,也是造成急性肾衰竭和移植肾功能延迟恢复的主要原因之一。其损伤机制还未完全明确,主要涉及活性氧的释放、炎性因子的释放,细胞凋亡等[1,2]。热休克蛋白是保护性蛋白家族,构成内源性细胞防御机制来抵抗敌对的环境压力,在缺氧、缺血、炎症等压力刺激下可以诱导表达,按相对分子质量大小主要分为HSP100、HSP90、HSP70、HSP60。HSP90 在多种生物均有表达,在正常情况下占胞质蛋白的1% ~2%,是最丰富的细胞质蛋白之一[3]。真核生物中HSP90 主要有HSP90α、HSP90β 两种亚型。HSP90α 能够通过调控各种细胞因子和客户蛋白的折叠而起到保护细胞的作用。微小RNA(miRNA)为长度18 ~25nt 的非编码单链低分子RNA,能够在转录前水平调控基因的表达,介导靶mRNA 降解或抑制蛋白翻译[4]。笔者利用生物信息学预测出miRNA - 144 为调控HSP90α 功能的潜在miRNA,然后通过定量RT-PCR和Western blot 法检测HSP90α 和miRNA -144 在肾缺血再灌注不同时间点的表达情况,初步探讨miRNA-144 和HSP90α 在肾缺血再灌注损伤中的调控作用及机制。
材料与方法
1.动物及模型制备:成年雄性昆明白小鼠,体重30 ~40g,由滨州医学院动物实验中心提供。随机分成:①缺血再灌注(IR)组(n=40,每组8 只);②假手术组(n =40,每组8 只)。小鼠用氯胺酮/甲苯噻嗪(80/10mg/kg)腹腔麻醉,充分暴露手术视野固定,乙醇消毒手术部位,腹部正中切口后分离左右肾蒂,用无损伤血管夹夹闭左右肾蒂,肉眼观察肾脏变黑说明夹闭成功,45min 后松开血管夹,几分钟后肾脏变粉红,说明再灌注成功。假手术组只分离左右肾蒂,不夹闭。IR 组和假手术组分别在术后4、8、12、24、48h 下腔静脉取血分离血清,取少量肾组织Bouin 氏液固定,用于病理检查,剩余肾组织于-80℃保存。
2.主要试剂:HE 试剂盒购自碧云天生物技术研究所;RNAiso Plus 购自TaKaRa 公司;ReverTra Ace 反转录酶购自Toyobo 公司;Platinum®SYBR®Green qPCR SuperMix - UDG反应试剂盒购自Invitrogen 公司;RIPA 裂解液和BCA 蛋白浓度测定试剂盒购自烟台赛尔斯生物技术有限公司;ECL 购自Thermo 公司;HSP90α 抗体和β-actin 抗体购自Santa Cruz 公司;辣根酶标记的山羊抗兔IgG 购自中杉金桥公司;所用引物由上海生工生物工程有限公司合成(表1)。

表1 引物序列
3.生化指标检测:应用美国德灵Dimension RXL Max 全自动生化分析仪测定血清中肌酐(Scr)、尿素氮(BUN)水平。
4.组织学评价:小鼠肾组织于Bouin 氏液固定24h,常规石蜡包埋,切片4μm,脱蜡水化后用HE 试剂盒染色,光镜下观察肾脏的组织形态变化。
5.miRNA 预测:笔者联合使用TargetScan(http://www.targetscan. org/)和miRanda (http://www. microrna. org/microrna/home.do)两个预测软件同时预测调控HSP90α 功能的潜在的miRNA 分子。取TargetScan 和miRanda 共同预测到的miRNA 即miRNA-144 进行下一步研究。
6.荧光定量RT-PCR:IR 组和假手术组各个时间点的肾组织分别混合后用RNAiso Plus 提取RNA。1μg RNA 用ReverTra Ace 反转录酶逆转。荧光定量PCR 按照Platinum®SYBR®Green qPCR SuperMix -UDG 反应试剂盒的产品说明进行反应,反应体系为:cDNA 1μl,上游引物(10μmol/L)0.6μl,下游引物(10μmol/L)0.6μl,SYBR mix 10μl,dd H2O 8μl。使用Rotor-Gene Q 进行荧光定量PCR 检测,反应条件为:50℃2min,95℃5min,95℃10s,60℃45s,40 个循环。运用2-△△Ct方法来计算样本中mRNA 表达水平的差异。所有的实验重复3 次。△△CT=[Ct(实验组目标基因)- Ct(实验组内参基因)]-[Ct(对照组目标基因)- Ct(对照组内参基因)]。mRNA 选用GAPDH 作为内参基因,miRNA 选用U6 作为内参基因。
7.Western blot 法分析:用RIPA 裂解液提取蛋白样品,BCA 蛋白浓度测定试剂盒测定蛋白浓度。电泳转硝酸纤维素膜上,用HSP90α 抗体(1∶1000)和β-actin 抗体(1∶1500)4℃摇床孵育过夜,清洗。辣根酶标记的山羊抗兔IgG(1∶5000)37℃孵育1h,清洗。ECL 显色,扫描后,利用Gene Tools image analysis 软件(Gene Tools,version 4.02;Syngene,Cambridge,UK)测定条带灰度值,目标条带与β -actin 的比值作为表达强度。
8.统计学方法:采用SPSS 13.0 统计软件处理数据,所有数据用均数±标准差(±s)表示,两组间样本均数比较采用t检验。以P <0.05 为差异有统计学意义。
结 果
1.肾组织形态学变化:HE 染色可见假手术组肾小管排列整齐紧密,而IR 组肾小管排列紊乱,管腔扩张;肾小管上皮细胞扁平,部分肿胀、坏死、脱落,刷状缘消失;管腔内可见管型;肾间质减少、充血,以再灌注24h 组组织损伤最严重(图1)。
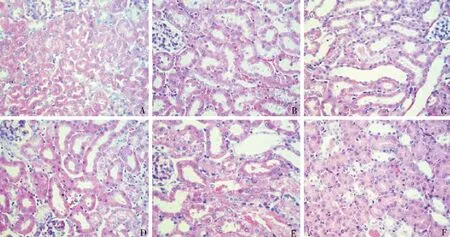
图1 各组肾组织形态学变化(HE,×400)
2.肾功能指标变化:假手术组和IR 组在再灌注4、8、12、24、48h 后血清中Scr 和BUN 的变化,结果见表2 和表3。与假手术组相比,IR 组的Scr 和BUN 在4h 时开始增高,24h 时达高峰,48h 有所下降,P 均<0.01 为差异有统计学意义。
表2 小鼠肾缺血再灌注后各组各时相肌酐水平的变化(μmol/L,±s,n=8)
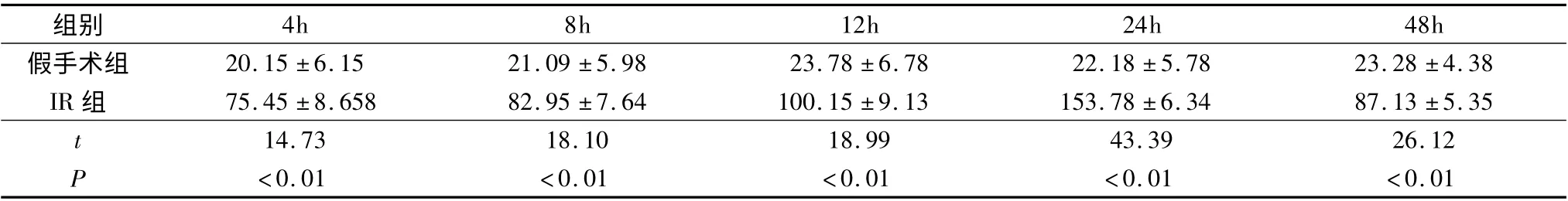
表2 小鼠肾缺血再灌注后各组各时相肌酐水平的变化(μmol/L,±s,n=8)
组别4h 8h 12h 24h 48h假手术组 20.15 ±6.15 21.09 ±5.98 23.78 ±6.78 22.18 ±5.78 23.28 ±4.38 IR 组 75.45 ±8.658 82.95 ±7.64 100.15 ±9.13 153.78 ±6.34 87.13 ±5.35 t 14.73 18.10 18.99 43.39 26.12 P <0.01 <0.01 <0.01 <0.01 <0.01
表3 小鼠肾缺血再灌注后各组各时相尿素氮水平的变化(mmol/L,±s,n=8)
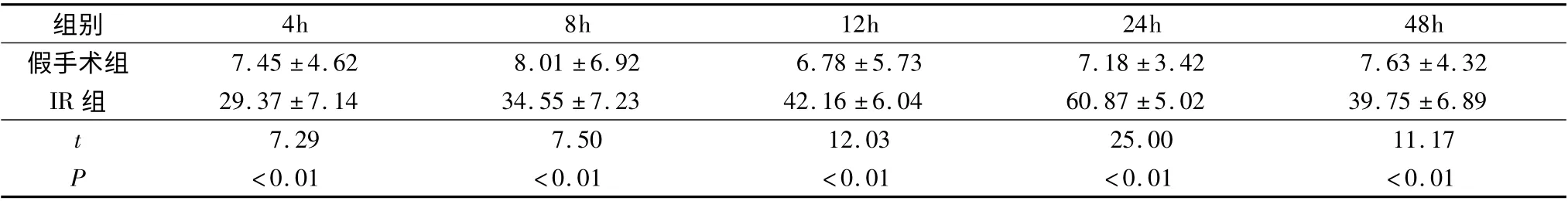
表3 小鼠肾缺血再灌注后各组各时相尿素氮水平的变化(mmol/L,±s,n=8)
组别4h 8h 12h 24h 48h假手术组 7.45 ±4.62 8.01 ±6.92 6.78 ±5.73 7.18 ±3.42 7.6 3 ±4.32 IR 组 29.37 ±7.14 34.55 ±7.23 42.16 ±6.04 60.87 ±5.02 39.75 ±6.89 t 7.29 7.50 12.03 25.00 11.17 P <0.01 <0.01 <0.01 <0.01 <0.01
3. 肾缺血再灌注后肾组织中HSP90α mRNA 和miRNA-144 的表达变化:缺血再灌注4、8、12、24、48h 时间点的HSP90α mRNA 相对于各自的假手术组表达量分别为1.20 ±0.16、1.81 ±0.16、2.64 ±0.17、2.51 ±0.11、1.66 ±0.17,缺血再灌注组相对假手术组表达明显升高,且在12h 组表达增加2.64 倍(P <0.01),增加倍数最多,48h 有所降低但仍高于假手术组,差异有统计学意义(P <0.01,图2)。缺血再灌注4、8、12、24、48h 时间点的miRNA -144 相对于各自的假手术组表达量分别为0.45 ±0.08、0.41 ±0.08、0.35 ±0.09、0.29 ±0.07、0.38 ±0.06,与假手术组相比较,IR 组均表达降低,差异有统计学意义(P <0.01,图3)。
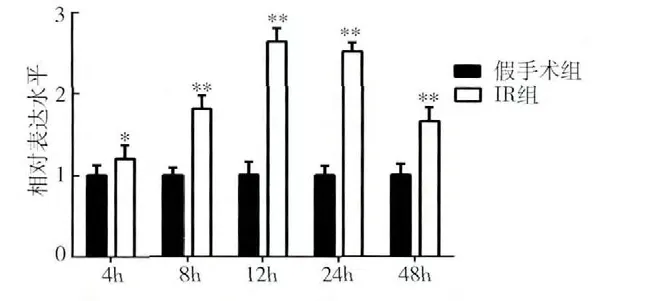
图2 肾缺血再灌注后HSP90α 的mRNA在不同时间点的表达变化
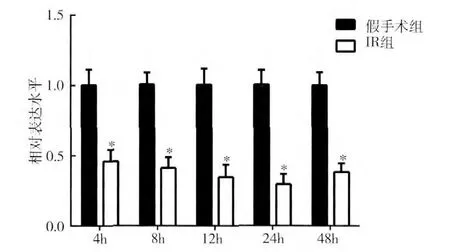
图3 肾缺血再灌注后miRNA-144在不同时间点的表达变化
4.肾缺血再灌注后肾组织中HSP90α 蛋白的表达变化:HSP90α 蛋白在假手术组及再灌注4、8、12、24、48h 组的相对表达量分别为0.16 ±0.02、0.34 ±0.03、0.45 ±0.03、0.60 ±0.03、0.81 ±0.05、0.46 ±0.05,与假手术组相比,IR 组HSP90α 蛋白水平在缺血再灌注后4h 开始升高,随着再灌注时间的延长表达逐渐增加,24h 达高峰,48h 有所降低但仍高于假手术组,差异有统计学意义(P 均<0.01,图4)。
讨 论

图4 肾缺血再灌注后HSP90α 蛋白在各组表达的Western blot 法检测结果(A)和平均灰度值(B)
HSP90α,是一组高度保守的细胞内分子伴侣蛋白质,能在环境、生理、化学等各种应激反应下诱导表达,并通过激活各种细胞通路和酶参与重要的细胞功能,如维持细胞结构,参与细胞分化和细胞保护等。研究表明,预先诱导HSP90α 表达增高能保护心肌细胞对抗缺血和化学缺氧损伤,其机制可能与HSP90α的抗氧化和保护线粒体的功能有关[5]。另外,最近几年miRNA 在组织缺血再灌注损伤方面的研究成为热点,其中在心肌、肝脏缺血再灌注损伤中的研究较多,而miRNA-144 在肾缺血再灌注损伤中的研究尚未见报道[6,7]。
本实验采用双侧肾蒂夹闭法建立小鼠肾缺血再灌注损伤模型,研究肾脏中内源性HSP90α 和miRNA-144 的表达变化。实验发现再灌注4h HSP90α 蛋白和mRNA 表达已开始逐渐增强,mRNA 在12h 达高峰,蛋白水平在24h 达高峰。结合肾组织的病理变化可知HSP90α 的表达是伴随肾组织损伤程度的加重而逐渐增加的,同时增加的HSP90α 又不断改善细胞损伤,使肾组织恢复正常。许多体内研究表明HSP90α 表达增高,能对抗一系列应激反应[8,9]。Biermann 等[8]发现H2S 能介导HSP90α 表达增高而在大鼠视网膜缺血再灌注模型中起到保护神经和抗凋亡的作用。Jha 等[9]在小鼠肝缺血再灌注模型中也做了类似的研究,HSP90 表达增高对肝缺血再灌注损伤起到了保护作用。另外,Barrera -Chimal 等[10]在大鼠肾脏中转染HSP90α,发现HSP90α 过表达能通过刺激内皮一氧化氮途径,而对大鼠肾缺血再灌注损伤发挥保护作用。从这些研究中,可以看出HSP90在缺血再灌注模型中扮演着重要的角色,能够减少组织损伤,但潜在的分子机制还有待探讨。
miRNA 发挥作用的机制是抑制靶mRNA 分子或蛋白分子的表达。在本实验中,缺血再灌注组HSP90α 的表达均高于假手术组,因此推测HSP90α对应的潜在miRNA 表达量在缺血再灌注组应该降低,笔者的miRNA -144 实时定量PCR 结果正好与这一推测吻合。所以HSP90α 可能是miRNA -144调控的靶蛋白之一。这也与最近一项研究结果一致,miRNA-144 在心脏缺血再灌注后表达降低[11]。Pan等[6]研究观察到,miRNA-1 转基因鼠心脏缺血再灌注模型中,miRNA - 1 表达增高抑制了PKCε 和HSP60 等保护蛋白的表达,使心肌梗死面积增大,加重了心肌损伤。同样的研究还有miRNA -320 能通过抑制HSP20 的表达而加重心脏缺血再灌注损伤[7]。由此可以推断,miRNA -144 表达下调是肾组织应对缺血再灌注损伤使HSP90α 表达上调的内源性保护机制,故敲除miRNA-144 可能成为治疗肾缺血再灌注损伤的新策略。
综上所述,HSP90α 表达上调和miRNA -144 表达下调在缺血再灌注中都扮演着重要的角色,对于miRNA-144 是否真正调控HSP90α,笔者将做进一步的研究验证,从而为临床上治疗肾缺血再灌注损伤提供新的思路和理论基础。
1 Chen YT,Tsai TH,Yang CC,et al. Exendin-4 and sitagliptin protect kidney from ischemia-reperfusion injury through suppressing oxidative stress and inflammatory reaction[J]. J Transl Med,2013,11(11):270
2 Fujino T,Muhib S,Sato N,et al. Silencing of p53 RNA through transarterial delivery ameliorates renal tubular injury and downregulates GSK-3beta expression after ischemia -reperfusion injury[J].Am J Physiol Renal Physiol,2013,305(11):F1617 -F1627
3 Mcclellan AJ,Xia Y,Deutschbauer AM,et al. Diverse cellular functions of the Hsp90 molecular chaperone uncovered using systems approaches[J]. Cell,2007,131(1):121 -135
4 Bartel DP. MicroRNAs:genomics,biogenesis,mechanism,and function[J]. Cell,2004,116(2):281 -297
5 Wu K,Xu W,You Q,et al. Increased expression of heat shock protein 90 under chemical hypoxic conditions protects cardiomyocytes against injury induced by serum and glucose deprivation[J]. Int J Mol Med,2012,30(5):1138 -1144
6 Pan Z,Sun X,Ren J,et al. miR-1 exacerbates cardiac ischemiareperfusion injury in mouse models[J]. PLoS One,2012,7(11):e50515
7 Ren XP,Wu J,Wang X,et al. MicroRNA -320 is involved in the regulation of cardiac ischemia/reperfusion injury by targeting heat -shock protein 20[J]. Circulation,2009,119(17):2357 -2366
8 Biermann J,Lagreze WA,Schallner N,et al. Inhalative preconditioning with hydrogen sulfide attenuated apoptosis after retinal ischemia/reperfusion injury[J]. Mol Vis,2011,17(1):1275 -1286
9 Jha S,Calvert JW,Duranski MR,et al. Hydrogen sulfide attenuates hepatic ischemia - reperfusion injury:role of antioxidant and antiapoptotic signaling[J]. Am J Physiol Heart Circ Physiol,2008,295(2):H801 -H806
10 Barrera-Chimal J,Perez-Villalva R,Ortega J A,et al. Intra-renal transfection of heat shock protein 90 alpha or beta (Hsp90alpha or Hsp90beta)protects against ischemia/reperfusion injury[J]. Nephrol Dial Transplant,2014,29(2):301 -312
11 Li J,Rohailla S,Gelber N,et al. MicroRNA -144 is a circulating effector of remote ischemic preconditioning[J]. Basic Res Cardiol,2014,109(5):423
