基于 《中国药典》和 《欧洲药典》的当归药材质量标准对比研究
2015-01-13袁宇鹏杨玉华王莲萍
袁宇鹏, 杨玉华, 王莲萍, 孙 裕
(兰州佛慈制药股份有限公司,甘肃兰州730000)
基于 《中国药典》和 《欧洲药典》的当归药材质量标准对比研究
袁宇鹏, 杨玉华, 王莲萍, 孙 裕
(兰州佛慈制药股份有限公司,甘肃兰州730000)
目的优选当归欧盟注册的标准方法。方法对比 《中国药典》2010年版一部和 《欧洲药典》7.5增补版中当归质控的实验方法,对不相同的质控指标进行对比实验。结果两部药典方法均能有效控制当归质量,但部分方法有所差异。通过实验,我们认为欧洲药典针对当归的薄层色谱和阿魏酸定量测定方法更优,而 《中国药典》针对当归的水分测定方法更优。结论根据两部药典方法的对比,结合两部药典的长处,制定我们自己的注册标准。
当归;《中国药典》;《欧洲药典》;标准研究
中药是中华民族优秀的文化瑰宝,但由于中药产品存在着处方药味多,成分复杂、质量控制较为困难、缺少系统的药效、安全性和临床试验数据等问题,一直未能按“药品” 身份进入欧洲市场[1-2]。
为了进一步规范欧洲的草药产品,2004年 《欧盟传统药品法》颁布,要求中成药在欧盟成员国进行传统药品注册[3-5]。这一举措有利于开辟中成药的新市场,扩大出口,增进世界、尤其是欧洲对中成药的了解,促进中药的国际化。中成药原药材的质量控制是欧盟传统草药注册所要求的重要内容[6-7]。而 《欧洲药典》和 《中国药典》对中药材质量控制存在一定的差异,所以建立具有中药特色、欧盟认可的质量控制模式,是推动中药欧盟注册实质性步骤。本实验以当归药材为范例,对 《中国药典》和 《欧洲药典》的药材质量标准对比研究,为浓缩当归丸的欧盟传统草药注册提供依据[8-10]。
1 材料与试剂
1.1 仪器 XS205型十万分之一电子天平,AL204型万分之一电子天平 (梅特勒-托利多精密仪器有限公司);SK250HP超声波清洗器 (上海科导超声仪器有限公司);ZF-I型三用紫外分析仪 (上海顾村电光仪器厂);DGG-9123A型电热恒温鼓风干燥箱 (上海森信实验仪器有限公司);SHIMADZU Prominence高效液相色谱仪(包括低压二元梯度泵LC-20AB,柱温箱CTO-20A,二极管阵列检测器SPD-M20A,LC Solution工作站);UPH-I-10T纯化水系统(成都超纯科技有限公司),HH·S21-Ni型电热恒温水浴锅 (北京华恒万亿仪器有限公司)。
1.2 材料 GF254硅胶板 (青岛海洋化工厂);乙醚,乙醇,正己烷,乙酸乙酯,庚烷,冰醋酸,甲苯,甲醇 (分析纯,天津市光复精细化工研究所);乙腈 (色谱纯,天津市光复精细化工研究所);磷酸 (色谱纯,天津市科密欧化学试剂有限公司);实验用水均为超纯水(UPH-I-10T纯化水系统制取)。当归对照药材 (120927-201014),藁苯内酯对照品 (111737-201204),欧前胡素对照品 (110826-201214),蛇床子素对照品 (110822-200407),阿魏酸对照品 (110773-201012)均购自中国食品药品检定研究院。当归药材选自兰州佛慈制药股份有限公司药源基地2012年所产当归,经甘肃省中医学院中草药专家及本公司质量检验部技术人员鉴定为正品当归(Angelica sinensis)。
2 方法与结果
2.1 薄层色谱鉴别 《欧洲药典》和 《中国药典》在当归药材中薄层色谱鉴别存在一定的区别,薄层板、展开剂以及操作步骤存在很大差异,详细对比见表1,图1,图2。

表1 《中国药典》和《欧洲药典》中当归药材薄层色谱鉴别对比分析

图1 365 nm下标准图谱

图2 254 nm下标准图谱
2.1.1 按照 《中国药典》的薄层色谱鉴别 按照 《中国药典》2010年版中当归药材鉴别进行试验。当归供试品在与对照药材色谱相应的位置上,显出明显的荧光斑点。具体结果见图3。

图3 当归药材与对照药材TLC图谱
2.1.2 按照 《欧洲药典》的薄层色谱鉴别 按照 《欧洲药典》7.5增补版进行试验。在365 nm下检测,供试品当归在藁本内酯对照品对应位置呈现明显的蓝灰色荧光斑点,蛇床子素对照品位置荧光斑点颜色较淡。在254 nm下检测,供试品当归在藁本内酯对照品对应位置呈现较深颜色的斑点,蛇床子素对照品位置能看到颜色较浅的斑点。结果见图4和图5。
2.2 水分测定 《欧洲药典》和 《中国药典》在当归药材中水分测定存在一定区别,详细对比见表2。

图4 对照品及当归药材在365 nm下TLC图谱
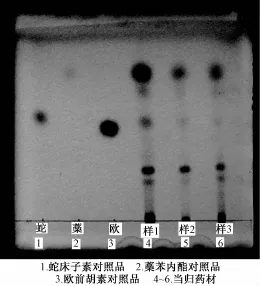
图5 对照品及当归药材在254 nm下TLC图谱

表2 中国药典和欧洲药典中当归药材水分测定对比分析
2.2.1 试验步骤
2.2.1.1 按照 《中国药典》的水分测定 按照 《中国药典》2010版一部附录ⅨH第二法进行测定。
2.2.1.2 按照 《欧洲药典》的水分测定 按照 《欧洲药典》“2.2.32”项干燥失重检查法检测同批当归水分。
2.2.2 试验结果 经计算按 《中国药典》方法测得3批当归水分分别为10.4%、9.6%和9.8%;而用 《欧洲药典》方法测得结果分别为10.6%、9.9%和10.3%。这主要是因为当归中含有挥发油,烘干法在烘干水分的同时也会损失一部分挥发油,造成结果偏高。
2.3 成分测定 《欧洲药典》和 《中国药典》对当归药

表3 当归药材中阿魏酸的测定方法对比分析
2.3.1 对照品溶液配置
2.3.1.1 对照品溶液 (A)的配置 精密称定阿魏酸对照品7.04 mg,至50 mL棕色量瓶中,加70%甲醇制成每1 mL含140.8μg的溶液;在精确移取上述液体25mL至100 mL棕色量瓶中,加70%甲醇至刻度,制成每1 mL含35.2 μg的溶液,即得。
2.3.1.2 对照品溶液 (B)的配置 取配置好对照品溶液(A)约2 mL,放入透明进样瓶中,在波长为254 nm的紫外灯下照射60 min,即得。
2.3.2 供试品溶液的配置 取当归粉末约0.2 g(过3号筛),精密称定,置具塞锥形瓶中,精密加入70%甲醇20 mL,密塞,称定质量,加热回流30 min,放冷,再称定质量。用70%甲醇补足减失的质量,摇匀,静置,取上清液滤过,取续滤液,即得。
2.3.3 按照 《欧洲药典》的方法对当归中阿魏酸进行测定
2.3.3.1 系统适用性 实验室选用Phenomenex Synergi 4u Hydro-RP 80A色谱柱,参数为150 mm×2.00 mm,填料粒径4μm。直接使用欧洲药典方法,对对照品溶液 (B)进行检测,检测系统适用性,结果见图6,相对应峰表见表4。

图6 对照品溶液 (B)色谱图-原比例
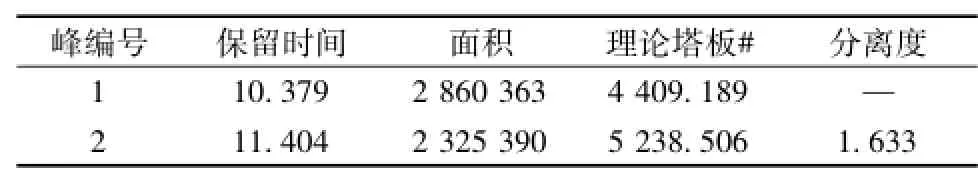
表4 图6中峰信息
由图6可知,本实验室HPLC系统若直接使用 《欧洲药典》方法,阿魏酸保留时间较标准保留时间提前约3 min。故对色谱条件稍作修改,将乙腈-0.085%磷酸溶液的比例由原来的17∶83改为15∶85,结果如图7,相对应峰表见表5。

图7 改动后对照品溶液 (B)色谱图

表5 图7中峰信息
由图7可知改变流动相比例后,本实验室HPLC系统可以满足欧洲药典的系统适用性要求。
2.3.3.2 《欧洲药典》方法实验结果 在 《欧洲药典》色谱条件下分别对3批当归药材进行检测,得3批当归的阿魏酸含有量分别是0.077 5%、0.093 2%和0.095 8%。
2.3.4 《中国药典》方法实验结果 实验室选用Phenomenex Luna 5u C18100A色谱柱,参数为150 mm×4.60 mm,填料粒径5μm。体积流量选择为0.8 mL/min。在此色谱条件下分别对3批当归药材进行检测,理论塔板数均大于5 000,满足系统适用性要求。结果得3批当归的阿魏酸含有量分别是0.077 6%、0.093 4%和0.095 7%。
3 讨论
3.1 薄层色谱鉴别 经实验证明两部药典方法均能有效地鉴别当归。《中国药典》方法是以当归药材为对照;《欧洲药典》是以3个已知的化学标记成分为参照物。通过对比分析认为 《欧洲药典》标准更加严格,使用更多的对照品,并在两个波长下扫描。对当归药材的品质要求更高,而且给出了较直观的标准图谱,方便实验人员对薄层鉴别图谱进行判断。
3.2 水分对比结果 按照 《中国药典》方法测得3批当归水分分别为10.4%、9.6%、9.8%,按照 《欧洲药典》“2.2.32”项干燥失重检查法测得当归水分为10.6%,9.9%,10.3%。主要是因为当归中含有部分挥发油成分,以烘干法测水分时挥发油成分也会减少,从而使测得的水分偏高,而使用甲苯法可避免这个问题,得到比较准确的水分数据。比较实验方法,使用甲苯法测水分的 《中国药典》更为合理、科学,但比较指标评价标准,《欧洲药典》对当归水分的要求较 《中国药典》明显更为严格。
3.3 阿魏酸定量测定方法对比分析研究结果 从两种实验方法检测结果证明,虽然两部药典方法在色谱条件上有些不同,且在色谱峰的保留时间、峰面积及峰型上都有不同,但两种方法得到的阿魏酸含有量一致。由此可得出结论,《中国药典》和 《欧洲药典》的方法均可准确的测定当归中阿魏酸的量。个人认为 《欧洲药典》的方法更优,相比于 《中国药典》,《欧洲药典》对阿魏酸定量测定方法要求更为具体,明确规定了使用的色谱柱的柱长,内径,填料粒径及体积流量,从而减少了色谱柱差异造成的不一致性。在系统适用性方面,《欧洲药典》方法规定了顺式阿魏酸和反式阿魏酸的分离度,并且大致规定了顺式阿魏酸和反式阿魏酸的出峰时间。因为反式阿魏酸暴露在紫外灯下,就会有一部分反式阿魏酸转化成顺式阿魏酸,如果这两个峰分离度不足,就会对实验结果造成影响;而按照 《欧洲药典》规定的出峰时间,恰好能够达到合适的分离度,而又可以尽可能的缩短保留时间。如此规定,可以很大程度上减少不同实验室不同仪器的不一致性。
4 总结
根据以上实验,可以看出虽然两部药典在对当归的一些质控指标及检测方法上有差异,但都能有效地对当归的质量进行监控。在具体的方法和评价指标上,两部药典各有长短。 《中国药典》在水分测定方面使用的甲苯法较《欧洲药典》的烘干法更精确,且多了浸出物和挥发油的质量控制指标;而 《欧洲药典》对当归质量的要求更高,对方法的描述也更为具体。结合两部药典的长处,制定自己的注册标准。在两部药典描述相同的部分,未作修改继续使用;在两部药典描述不同的部分,选择更加合理,更加严格的标准。在薄层色谱方面,两部药典的方法均使用,更大程度地对当归药材进行准确鉴别;水分测定方面,使用了 《中国药典》的甲苯法测水分的方法,但评价指标使用了更为严格的 《欧洲药典》的指标,这需要我们注册的当归药材有更高的质量;阿魏酸定量测定方面,使用《欧洲药典》方法,以更加严谨的要求确保实验良好的重现性。
[1]Uptake of the traditional use registration scheme and implementation of the provisions of Directive 2004/24/EC in EU Member[R].EU:European Medicines Agency,2013.
[2]苏刚强,李伯刚.欧盟草药药品注册指南[M].北京:人民卫生出版社,2005:20-22.
[3]张中朋.传统中药欧盟注册路径探析[J].中国现代中药,2011,13(8):53-54.
[4]倪昊翔,孙源源.2004/24/EC指令下中药出口欧盟面临的注册困境及对策[J].中国中药杂志,2013,38(9):1447-1449.
[5]张建武,邱 琼.突破中药欧盟注册障碍的关键因素分析[J].中国中药杂志,2014,39(15):2972-2977.
[6]Directive 2001/83/EC of the European parliament and of the council of 6 November 2001 on the community code relating to medicinal products for human use[S].EU:European Parliament and Council,2001.
[7]Directive 2004/24/EC of the European parliament and of the council[S].EU:European Parliament and Council,2004.
[8]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:124.
[9]European Pharmacopoeia 7.0(Volume 1)[S].Nördlingen(Germany):Druckerei C.H.Beck,2011:51.
[10]European Pharmacopoeia 7.5(supplement)[S].Nördlingen(Germany):Druckerei C.H.Beck,2012:4549-4550.
R921.2
:B
:1001-1528(2015)05-1139-04
10.3969/j.issn.1001-1528.2015.05.050
2014-01-08
国家科技支撑计划课题(2011BAI05B02)
袁宇鹏 (1988—),男,助理工程师。Tel:13109389193
