蛇床子素对高糖诱导人脐静脉血管内皮细胞损伤的保护作用
2015-01-13祝双华刘晓群姜怀德郑超然詹宇婷梁尚栋李桂林
祝双华, 刘晓群, 姜怀德, 郑超然, 詹宇婷, 梁尚栋, 李桂林*
(1.南昌大学医学院,江西南昌330006;2.南昌大学抚州医学院,江西抚州344000)
[药理]
蛇床子素对高糖诱导人脐静脉血管内皮细胞损伤的保护作用
祝双华1, 刘晓群2, 姜怀德1, 郑超然1, 詹宇婷1, 梁尚栋1, 李桂林1*
(1.南昌大学医学院,江西南昌330006;2.南昌大学抚州医学院,江西抚州344000)
目的研究蛇床子素对高糖诱导原代培养人脐静脉血管内皮细胞 (HUVEC)炎症的保护作用。方法将HUVEC细胞分为对照组、高糖组、对照+蛇床子素组和高糖+蛇床子素组。培养5 d后,采用硝酸还原酶法测定细胞上清液中一氧化氮(NO),荧光酶标仪测定细胞内活性氧(ROS),并通过real-time PCR和Western blot法检测趋化因子CCL5及其受体CCR5mRNA和蛋白的表达。结果高糖明显降低对照组细胞上清液中NO水平同时升高ROS,蛇床子素能增加高糖组细胞上清液中NO水平同时降低高糖组细胞内ROS;real-time PCR和Western blot结果显示蛇床子素可以降低高糖组细胞CCL5及其受体CCR5 mRNA和蛋白的表达量。结论蛇床子素对高糖诱导的人脐静脉血管内皮细胞的损害具有保护作用是与其抗氧化应激及抗炎作用有关。
糖尿病;蛇床子素;CCL5;血管内皮细胞;一氧化氮;活性氧
糖尿病是一种严重的代谢性疾病。它引起的心血管病变累及身体各脏器导致各种并发症,其中最常见的是糖尿病心血管并发症包括肾病、视网膜病、心脑血管病、神经病变、下肢溃烂等,严重危害人们的健康[1-2]。在糖尿病心血管病变发病中,血管内皮起着一个关键的作用,在高血糖症状出现前血管内皮已发生功能异常[3-4]。前期的基因芯片分析发现慢性高糖可导致人脐静脉血管内皮细胞(HUVEC)趋化因子CCL5(CC类趋化因子配体5)明显升高达15倍[5]。趋化因子通过与受体结合促进机体各种炎症性疾病以及各种自身免疫性疾病的发生和发展[6]。然而,趋化因子在高糖条件下引发糖尿病内皮功能损害的发病机理中的作用知之甚少。蛇床子素是从伞形科植物蛇床成熟果实蛇床子中提取的香豆素,具有抗炎、抗氧化、清除自由基、降血脂作用[7-9],提示它对糖尿病的发病可产生影响,可能对糖尿病心血管并发症产生治疗作用。
1 材料与方法
1.1 材料 MCDB-131,肝素,牛血清白蛋白,胰蛋白酶,Ⅰ型胶原酶,兔源性CCL5多克隆抗体,兔源性CCR5多克隆抗体,均购自Sigma公司。碱性成纤维生长因子购自Chemicon公司;胎牛血清购自Hyclone公司;蛇床子素(osthole,纯度≥98%),购自南京泽朗医药科技有限公司 (批号091010);CellTiter 96©AQueous One Solution Cell Proliferation Assay(MTS),购自Progrema公司;ROS检测试剂盒,购自江苏碧云天生物技术研究所;NO试剂盒,购自南京建成生物工程研究所;β-actin抗体(sc-47778)购自Santa Cruz公司;羊抗兔IgG-HRP,购自北京华美生物工程公司;ECL荧光底物(37071)购自Pierce公司;ABI7500荧光定量PCR仪(Appleid Biosystems公司);UVVIS 2501PC紫外-可见分光光度计 (日本岛津公司);荧光分光光度计(Tecan infinite M200,Tecan公司)。
1.2 方法
1.2.1 HUVEC的原代分离培养和分组 健康产妇分娩后12 h内的脐带经PBS反复冲洗,0.2%的胶原酶37℃水浴消化15 min,收集消化液,离心弃上清,用HUVEC培养液(MCDB-131,15%胎牛血清,17.7 U/mL肝素,2.5 g/mL青霉素,100 g/mL链霉素,20μg/mL酸性成纤维生长因子)重悬细胞,接种于经0.1%明胶处理过的培养瓶内,24 h后更换培养液,以后每2~3 d换液1次,细胞融合后传代培养。第4代HUVEC随机分成4组:①正常对照组即5.5 mmol/L葡萄糖、②高糖对照组即44.4 mmol/L的葡萄糖、③正常加蛇床子素组即5.5 mmol/L葡萄糖加100 nmol/L的蛇床子素、④高糖加蛇床子素组即44.4 mmol/L的葡萄糖加100 nmol/L的蛇床子素。
1.2.2 MTS法确定蛇床子素浓度 HUVEC按每孔5 000个细胞接种于 96孔培养板内,5%CO2、37℃条件下培养24 h后每孔加入不同浓度的蛇床子素,培养5 d后换成无血清无酚红培养液每孔100μL并加入MTS溶液20μL,培养2 h后将培养板置于酶标仪内,测定490 nm波长处的吸光度(OD)值。实验重复3次,每次不同浓度均设3个复孔。
1.2.3 细胞培养上清液NO的测定 各组细胞培养5 d后取培养上清液用硝酸还原酶法测定培养液中NO的量,具体操作过程严格按照NO试剂盒检测说明书进行。
1.2.4 细胞内ROS的测定 荧光探针DCFH-DA按照1∶1 000用无血清培养液释稀至终浓度为10 μmol/L。6孔培养板内的各组细胞培养5 d后,培养液换成1 mL已稀释的DCFH-DA培养液培养20 min后,用无血清细胞培养液洗涤细胞以去除未进入细胞内的荧光探针。收集并重悬细胞,荧光分光光度计在激发波长485 nm,发射波长535 nm,测定各组细胞荧光强度。
1.2.5 Real-time PCR检测HUVEC CCL5和CCR5 mRNA的表达 各组细胞培养5 d后,采用TRIZOL法提取各组细胞总RNA,再逆转录为cDNA,采用SYBR Green(TAKRA公司)法通过ABI7500 PCR仪对cDNA进行PCR扩增,结果通过PCR仪自带的7500 Software v 2.0.4软件进行分析,以βactin作为内参。引物序列如下:
β-actin正向5'-TTTTTTGGCTTGACTCAGGAT-3'反向5'-GGGAGACCAAAAGCCTTCAT-3'
CCL5正向5'-TCGCTGTCATCCTCATTGCT-3'反向5'-AGGCTGGTCTCGAACTCCTG-3'
CCR5正向5'-ACATCTACCTGCTCAACCTG-3'反向5'-CATTGTATTTCCAAAGTCCC-3'
1.2.6 Western blot检测HUVEC CCL5和CCR5蛋白的表达 收集各组HUVEC,去污细胞裂解液提取细胞总蛋白,Bradford法测定蛋白浓度,每组各取蛋白质样品(30μg)进行SDS-PAGE电泳,转膜封闭后加入一抗(兔源性CCL5和CCR5多克隆抗体均为1∶750)4℃过夜,羊抗兔IgG-HRP二抗反应液 (稀释比例为1∶5 000)室温孵育1 h,加入ECL化学发光试剂,放入成像系统(BIORAD)中拍照,得到蛋白条带图像。膜再生后用相同方法得到β-actin条带,以β-actin为内参,系统自带软件分析CCL5和CCR5的蛋白表达量。
1.3 统计方法 实验数据采用SPSS 11.5统计软件进行统计分析,实验结果以均数±标准差 (x± s)表示,各组数据间的统计采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 蛇床子素浓度的确定 HUVEC用不同浓度的蛇床子素处理5 d,细胞增殖状况通过MTS方法检测。结果显示蛇床子素浓度在0到100 nmol/L之间时对细胞增殖无明显影响;而蛇床子素浓度从1 000 nmol/L到10 000 nmol/L时可明显减少细胞增殖 (P<0.05)。故本研究后续实验中所用蛇床子素浓度为100 nmol/L(见图1)。
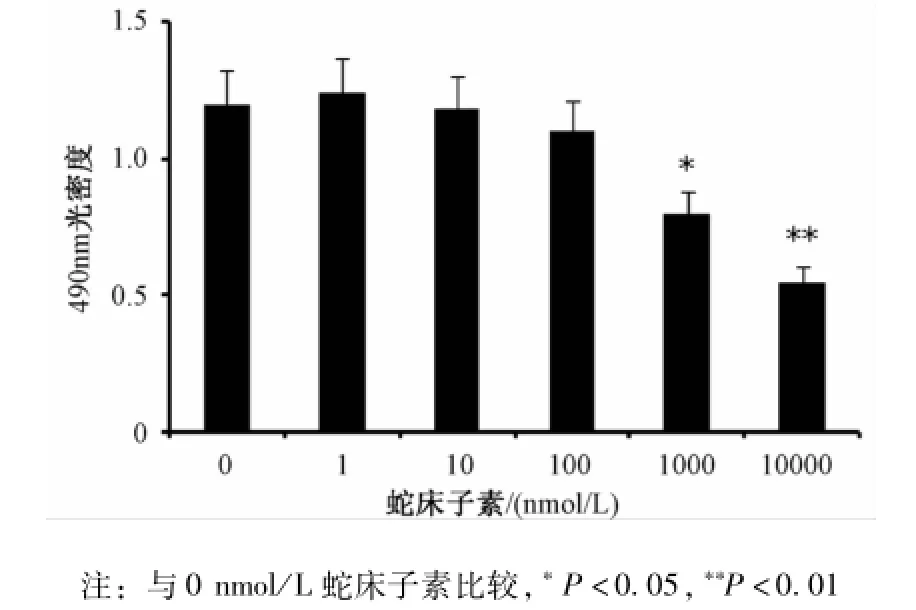
图1 蛇床子素对HUVECs增殖的影响Fig.1 E ffects of osthole on the proliferation of HUVECs
2.2 蛇床子素对细胞培养上清液中NO的影响
结果显示在对照组、高糖组、对照加蛇床子素组和高糖加蛇床子素组细胞培养上清液中NO浓度分别为(59.34±5.92)μmol/L、 (48.65±4.87)μmol/L、(58.11±5.81)μmol/L、(56.28±5.79)μmol/L。与对照组比较,高浓度葡萄糖能使细胞培养上清液中NO量显著减少 (P<0.05);与高糖组比较,高糖加蛇床子素处理组细胞培养上清液的NO量明显增加(P<0.05)。正常对照组、正常加蛇床子素组与高糖加蛇床子素组之间细胞培养上清液的NO量差异无统计学意义 (P>0.05)(见图2)。
2.3 蛇床子素对细胞内ROS的影响 与对照组相比较,高浓度葡萄糖能使HUVEC内ROS的生成显著增加 (P<0.05),对照加蛇床子素组和高糖加蛇床子素组无明显变化 (P>0.05);与高糖组比较,高糖加蛇床子素组HUVEC细胞内ROS的生成显著减少(P<0.05)(见图3)。

图2 蛇床子素对细胞培养上清液中NO的影响Fig.2 Effects of osthole on NO production inHUVECsmedia
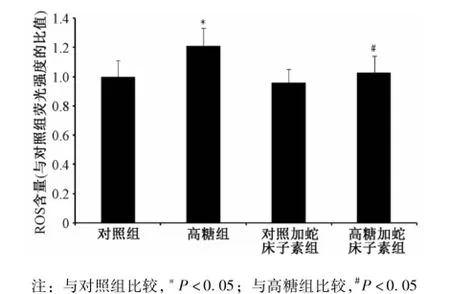
图3 蛇床子素对细胞内ROS的影响Fig.3 E ffects of osthole on ROS production in HUVECs
2.4 蛇床子素对HUVEC CCL5和CCR5 mRNA表达的影响 荧光定量PCR结果显示高糖组CCL5 mRNA表达量较对照组明显增加 (P<0.01),高糖加蛇床子素组较高糖组降低 (P<0.01);高糖组CCR5 mRNA表达量较正常对照组增加(P<0.05),高糖加蛇床子素组较高糖组降低 (P<0.05)。HUVEC中CCL5和CCR5 mRNA的表达量在对照组、对照加蛇床子素组与高糖加蛇床子素组之间差异无统计学意义(P>0.05)(见图4)。
2.5 蛇床子素对HUVEC CCL5和CCR5蛋白表达的影响 CCL5和CCR5蛋白印迹结果经各组相应β-actin标化后显示高糖对照组的CCL5和CCR5蛋白表达量均较对照组显著增加 (P<0.01),高糖加蛇床子素组CCL5和CCR5蛋白表达量较高糖组明显下调(P<0.01)。CCL5和CCR5蛋白的相对表达量在对照组、对照加蛇床子素组与高糖加蛇床子素组之间无显著性差异 (P>0.05)(见图5)。
3 讨论
糖尿病心血管病变是糖尿病最常见的并发症,占2型糖尿病患者死亡的80%。内皮功能障碍在包括炎症,动脉粥样硬化,血管生成等与糖尿病心血管疾病相关的病理过程中起着至关重要的作用。内皮细胞所分泌的一氧化氮 (NO)可引起血管舒张,降低血管通透性,并抑制平滑肌细胞增殖。NO生物活性降低和/或生物合成减少是引起内皮细胞损伤的主要原因[10]。血管内皮细胞的损伤及功能紊乱与氧化应激密切相关[11]。正常情况下机体内活性氧 (ROS) (包括氧自由基、过氧化氢等)的产生和清除保持动态平衡,当机体抗氧化能力下降时,ROS产生过多或清除过少,体内ROS的水平显著性升高将会导致氧化应激性损伤。ROS可损伤血管内皮细胞,导致内皮细胞功能障碍。高糖血症即 “糖毒性”在其中扮演了主要角色。
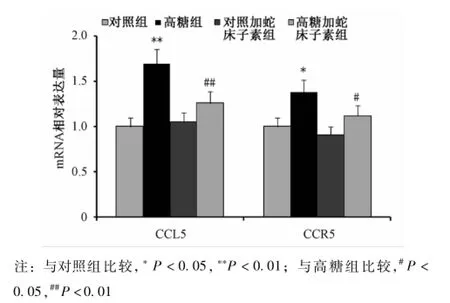
图4 蛇床子素对HUVECs CCL5和CCR5 MRNA表达的影响Fig.4 Effects of osthole on the expressions of CCL5 and CCR5 MRNA in HUVECs
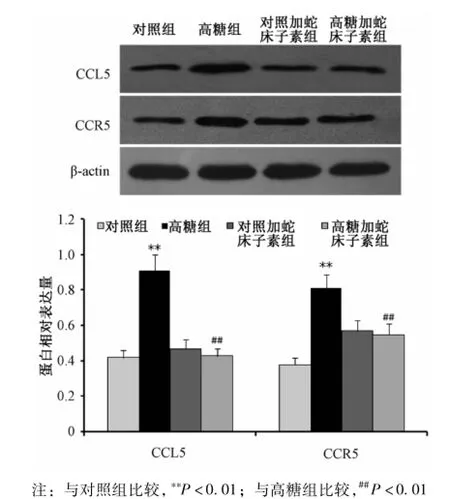
图5 蛇床子素对HUVECs CCL5和CCR5蛋白表达的影响Fig.5 Effects of osthole on the expressions of CCL5 andCCR5 protein in HUVECs
蛇床子素是从伞形科植物蛇床成熟果实蛇床子中提取的香豆素,具有抗高血压、抗炎、抗心律失常、抗衰老、抗肿瘤、抗骨质疏松症、抗变态反应、促进学习记忆和增强免疫功能等作用[7-9]。高血糖导致血管细胞产生的活性氧化基团增加,导致一些关键蛋白质和其他生物分子被氧化而使血管细胞功能受损,引发糖尿病心血管并发症。由于蛇床子素有抗氧化、清除自由基、降血脂作用[7-9],提示它对糖尿病的发病可产生影响,可能对糖尿病心血管并发症产生治疗作用。前期实验结果显示长期高糖状态下的HUVEC与对照组比较趋化因子5(CCL5)mRNA表达量增加高达 15倍[5,12]。CCL5与内皮细胞活性和内皮细胞损伤有关。高糖处理下的HUVEC基因表达模式的变化主要是氧化应激增加诱导内皮细胞损伤并激发内皮细胞产生炎症[12]。
趋化因子(chemokines)是指由白细胞和某些组织细胞分泌的,对中性粒细胞、单核细胞、淋巴细胞具有趋化和激活作用的小分子细胞因子,是一个包括60多个分子质量为8~10 kDa,参与免疫反应的蛋白质家族[13]。趋化因子配体5(CCL5),也称为调节正常T细胞表达和分泌活性的因子(RANTES),其受体为CCR5。CCL5调节多种炎症反应细胞穿过血管内皮[14]。CCL5可以诱导并激活巨噬细胞和单核细胞在胰腺郎格罕小岛的募集,并诱发巨噬细胞和单核细胞释放多种生物活性物质,在胰岛局部形成炎症反应,并进一步损伤胰岛β细胞的分泌功能,最终导致Ⅰ型糖尿病。胰岛β细胞功能与胰腺组织CCL5的表达呈负相关,与正常人相比2型糖尿病患者外周血CCL5浓度明显升高,采用胰岛素治疗后患者外周血CCL5水平显著降低[15-16]。炎症与细胞因子水平增加及ROS的产生有关[17]。CCL5和CCR5的mRNA和蛋白表达增加可能与炎症状态下ROS生成增多有关。实验结果显示长期高浓度葡萄糖可引起血管内皮细胞损伤,同时观察到HUVEC中CCL5和CCR5的mRNA和蛋白表达量较对照组均明显增加,表明CCL5和CCR5可能参与了高糖引起的血管内皮损伤的病理生理过程。
近年来的研究认为2型糖尿病是一个慢性低度炎症状态,其发展是固有免疫反应的急性加剧和/或累积的过程。2型糖尿病常伴有多种炎症因子如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)、纤溶酶原激活抑制物-1(PAI-1)浓度的升高,不但直接降低胰岛素敏感性,参与胰岛素抵抗,而且与糖尿病大血管并发症的危险性联系紧密[18]。临床研究发现抗炎治疗可使2型糖尿病患者血液TNF-α和HbA1c水平显著下降,空腹胰岛素水平降低,胰岛素敏感性增强,提示抗炎治疗可改善2型糖尿病患者糖代谢异常。细胞因子在血管病变、胰岛素抵抗和炎症中起重要作用[19]。胰岛素抵抗可使血糖升高,氧化应激增强可导致炎症加剧,而作为细胞因子的趋化因子及其受体在此进程中具有重要作用。研究表明2型糖尿病动脉粥样硬化患者血清CCL5、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)的浓度和外周血巨噬细胞、单核细胞表面CCR5的密度均较对照组明显升高。给予胰岛素治疗后,血清中CCL5、IL-6、TNF-α、CRP水平显著下降,细胞表面CCR5的表达量显著减少。表明胰岛素治疗可能通过抑制炎症过程而减轻糖尿病动脉粥样硬化病变[16,20]。本实验观察正常和慢性高糖状态下HUVEC中CCL5和CCR5的mRNA和蛋白表达水平及蛇床子素对其表达的影响,real-time PCR和Western blot结果显示蛇床子素可以降低高糖组细胞CCL5及其受体CCR5 mRNA和蛋白的表达量。高糖组细胞上清液中NO浓度明显降低,蛇床子素能明显增加高糖组细胞上清液中NO浓度;高糖组细胞内ROS明显升高,蛇床子素可以降低高糖组细胞内ROS。因此,蛇床子素可能通过影响CCL5和CCR5的表达、ROS的产生和NO的释放抑制糖尿病的慢性炎症过程,对高糖引发的血管内皮损伤产生保护作用。
综上所述,本研究表明蛇床子素对慢性高糖诱导的内皮细胞损伤具有保护作用;蛇床子素保护内皮细胞与其抗氧化应激及抗炎作用有关。
[1]Lorber D.Importance of cardiovascular disease risk management in patients with type 2 diabetes mellitus[J].Diabetes Metab Syndr Obes,2014,23(7):169-183.
[2]Milicevic Z,Raz I,Beattie SD,et al.Naturalhistory of cardiovascular disease in patientswith diabetes:role ofhyperglycemia[J].Diabetes Care,2008,31(Suppl2):S155-S160.
[3]Polovina MM,Potpara T S.Endothelial dysfunction in metabolic and vascular disorders[J].Postgrad Med,2014,126(2):38-53.
[4]Rask-Madsen C,King G L.Mechanisms of disease:endothelial dysfunction in insulin resistance and diabetes[J].Nat Clin Pract Endocrinol Metab,2007,3(1):46-56.
[5]Li G L,Liang S D,Li G D.Chronic high glucose treatment alters expression ofmultiple genes in human umbilical vein endothelial cells[J].Diabetes,2009,58(Suppl):A589.
[6]Surmi B K,Hasty A H.The role of chemokines in recruitment of immune cells to the artery wall and adipose tissue[J].Vascul Pharmacol,2010,52(1/2):27-36.
[7]王书华,安 芳,张丹参.蛇床子素抗氧自由基清除作用的研究[J].中成药,2004,26(12):1062-1063.
[8]闫 俊,宣伟东,卞 俊.蛇床子素的研究进展[J].中国药业,2012,21(11):110-112.
[9]李 扬,韩美玲,郭哲宁,等.蛇床子素不同制剂对高血脂小鼠血脂及肝脂的影响[J].华西药学杂志,2013,28(1):55-57.
[10]Kabat A,Dhein S.L-Arginine supplementation prevents the development of endothelial dysfunction in hyperglycaemia[J]. Pharmacology,2006,76(4):185-191.
[11]Rochette L,Zeller M,Cottin Y,et al.Diabetes,oxidative stress and therapeutic strategies[J].BiochiMBiophys Acta,2014,1840(9):2709-2729.
[12]Li G,Zhu G,Gao Y,et al.Neferine inhibits the upregulation of CCL5 and CCR5 in vascular endothelial cells during chronic high glucose treatment[J].Inflammation,2013,36(2):300-308.
[13]Tayal V,Kalra B S.Cytokines and anti-cytokines as therapeutics an update[J].Eur J Pharmacol,2008,579(1-3):1-12.
[14]Ward SG,Bacon K,Westwick J.Chemokines and T lymphocytes:more than an attraction[J].Immunity,1998,9(1):1-11.
[15]Jeong K H,Moon JY,Chung JH,et al.Significant associations between CCL5 gene polymorphisms and post-transplantational diabetesmellitus in korean renal allograft recipients[J]. AMJNephrol,2010,32(4):356-361.
[16]Bogdanski P,Pupek-Musialik D,Dytfeld J,et al.Influence of insulin therapy on expression of chemokine receptor CCR5 and selected inflammatorymarkers in patients with type 2 diabetesmellitus[J].Int JClin Pharmacol Ther,2007,45(10):563-567.
[17]de Guevara Y L,Hidalgo O B,Santos S S,et al.Effect of natural porcine surfactant in Staphylococcusaureus induced proinflammatory cytokines and reactive oxygen species generation in monocytes and neutrophils froMhuman blood[J].Int Immunopharmacol,2014,21(2):369-374.
[18]Pickup JC.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J].Diabetes Care,2004,27(3):813-823.
[19]Arner P.The adipocyte in insulin resistance:key molecules and the impact of the thiazolidinediones[J].Trends Endocrinol Metab,2003,14(3):137-145.
[20]Cavusoglu E,Eng C,Chopra V,et al.Low plasma RANTES levels are an independent predictor of cardiac mortality in patients referred for coronary angiography[J].Arterioscler Thromb Vasc Biol,2007,27(4):929-935.
Effects of osthole on human uMbilical vein endothelial cells injury induced by high glucose
ZHU Shuang-hua1, LIU Xiao-qun2, JIANG Huai-de1, ZHENG Chao-ran1, ZHAN Yu-ting1,LIANG Shang-dong1, LIGui-lin1*
(1.Medical College of Nanchang University,Nanchang 330006,China;2.Fuzhou Medical College of Nanchang University,Fuzhou 344000,China)
AIMTo study the protective effects of osthole on the inflammation of primary cultured human umbilical vein endothelial cells(HUVEC)induced by high glucose,which provided the theoretical basis for the study of new anti-diabetes agents.METHODSHUVECs were divided into four groups:control,high glucose,control+osthole,and high glucose+osthole group.After being cultured 5 d,the nitric oxide(NO)level in supernatantwas detected by nitrate reductase;intracellular reactive oxygen species(ROS)was analyzed with fluorescence probe;the expressions of CCL5 and CCR5 were measured by the real-time PCR and Western blot.RESULTSHigh glucosemarkedly decreased NO level in the supernatant in the control group but increased its ROS. Osthole elevated NO level in the supernatantwhen used with the high glucose,as well as lessened its ROS level. The results of real-time PCR and Western blot showed that osthole could weaken the expressions of CCL5 and CCR5 mRNA,which were induced by high glucose.CONCLUSIONOsthole has protective effects on the injury of HUVEC induced by high glucose.ItsworkingmechanisMmightbe related to the prevention and control of diabetes angiopathies.
diabetes;osthole;CCL5;vascular endothelial cell;nitric oxide;reactive oxygen species
R285.5
:A
:1001-1528(2015)05-0929-06
10.3969/j.issn.1001-1528.2015.05.001
2014-07-12
国家自然科学基金资助项目 (81360140,30660059,81200853);江西省教育厅资助项目 (GJJ12072)
祝双华 (1993—),男,研究方向为临床医学。E-mail:1099801319@qq.com
*通信作者:李桂林 (1972—),女,博士,教授,研究方向为心血管生理和药理。Tel:(0791)86360556,E-mail:li.guilin@163.com
