葫芦素E诱导刚地弓形虫从宿主细胞逸出的观测
2015-01-12邱家洋
邱家洋
(淮南市第一人民医院检验科,安徽淮南232007)
葫芦素E诱导刚地弓形虫从宿主细胞逸出的观测
邱家洋
(淮南市第一人民医院检验科,安徽淮南232007)
目的检测葫芦素E诱导刚地弓形虫从感染的宿主细胞逸出的效力。方法用不同浓度(20、50和100 μmol/L)的葫芦素E孵育刚地弓形虫感染的HFF细胞1 h,统计纳虫空泡破损比例;用细胞松弛素D、1,2-二(2-氨基苯氧基)乙烷-N,N,N',N'-四乙酸四乙酰氧甲基酯(BAPTA-AM)预处理感染刚地弓形虫的HFF细胞,用50 μmol/L葫芦素E孵育1 h,统计纳虫空泡破损比例;将逸出虫体重新感染细胞或腹腔注射昆明小鼠,检测虫体毒力变化。结果葫芦素E可以诱导刚地弓形虫从HFF细胞释放逸出,葫芦素E浓度越高,逸出率越高。葫芦素E诱导的虫体逸出与虫体的运动能力和虫体内钙离子有关,逸出虫体的毒力没有发生明显变化。结论葫芦素E可以诱导刚地弓形虫的逸出,为探索弓形虫和宿主细胞相互作用提供了新的研究方向。
葫芦素E;刚地弓形虫;逸出
刚地弓形虫是一种专性细胞内寄生原虫,可感染所有有核细胞,引发弓形虫病。全球约有30%的人口发生弓形虫慢性感染。刚地弓形虫完成在宿主细胞内感染过程需经过入侵、胞内复制和逸出3个阶段。弓形虫对宿主造成的损伤主要是逸出阶段。因此阐明弓形虫的逸出机制可更好地解析弓形虫的致病机理。前期研究表明,钙离子载体和二硫苏糖醇均可诱导弓形虫逸出,这个过程依赖于虫体的运动能力[1]。同时,宿主免疫相关因素,如γ-干扰素(interferon-gamma,IFN-γ)[2]、一氧化氮(nitric oxide,NO)[3]、穿孔素、死亡受体偶联也可诱导弓形虫逸出[4]。最近的一些研究表明,弓形虫感染引起的肿瘤部位微环境的改变可促进肿瘤细胞的消除,如弓形虫感染可以使肿瘤周围的巨噬细胞从M2型转化为M1型,机体内部调节性T细胞数量降低,进而产生大量抗肿瘤CD8+T细胞,而且自然杀伤细胞也会向肿瘤部位聚集[5-7]。但是,肿瘤患者会使用一些化学药物通过诱导肿瘤细胞凋亡或抑制肿瘤的生长,进而达到抗肿瘤的目的。先前研究表明,抗肿瘤药物紫杉醇可抑制弓形虫的细胞增殖[8],但抗肿瘤药物能否影响弓形虫的逸出仍不清楚。为此,我们研究了抗肿瘤药物葫芦素E对刚地弓形虫逸出的影响。
材料和方法
一、虫株和实验动物
胞质稳定表达黄色荧光蛋白的虫株由美国宾夕法尼亚大学David Roos实验室惠赠,并在HFF细胞中连续传代培养。细胞培养所用血清和DMEM基础培养基均购自于HyClone公司。6~8周龄昆明鼠购自安徽医科大学实验动物中心。葫芦素E购自上海展舒化学科技有限公司。HFF细胞购自中国医学科学院细胞资源中心,用含有10%胎牛血清的高糖DMEM于37℃细胞培养箱中进行培养。细胞松弛素D和1,2-二(2-氨基苯氧基)乙烷-N,N,N',N'-四乙酸四乙酰氧甲基酯[1,2-bis(2-aminophenoxy)ethane-N,N,N',N'-tetraacetic acid tetrakis acetoxymethyl ester,BAPTAAM]均购自于西格玛奥德里奇公司。
二、葫芦素E诱导逸出的检测
将HFF细胞培养于6孔细胞培养板。当细胞融合率约为80%时按照感染复数(multiplicity of infection,MOI)=1的比率用刚地弓形虫感染细胞,记为感染0 h。36 h后,用不同浓度(20、50和100 μmol/L)的葫芦素E孵育感染细胞1 h,随机选取5个视野,统计纳虫空泡的破损率[1],以未用葫芦素E处理的HFF细胞作为对照组。为研究逸出和虫体运动、钙离子关系,刚地弓形虫感染HFF细胞36 h后分别用50 μmol/L BAPTA-AM、1 μmol/L细胞松弛素D预处理细胞10 min,然后用50 μmol/L葫芦素E孵育1 h,在OLYMPUS IX71荧光显微镜下统计逸出率[4]。
三、逸出虫体毒力检测
将含有逸出虫体的细胞培养液收集,750×g离心10 min,重新悬浮计数后,按MOI=1的感染率感染HFF细胞,24 h后在荧光显微镜下随机选择5个视野,对纳虫空泡进行计数,计算含有2、4、8和16个速殖子纳虫空泡的比率。在小鼠感染试验中,按1 000个速殖子/只小鼠的感染量经腹腔感染10只6~8周龄昆明鼠,观察记录小鼠死亡情况,计算存活率[9]。以自然逸出(约感染后72 h)刚地弓形虫作为对照组。
四、统计学方法
结果
一、葫芦素E诱导刚地弓形虫从HFF细胞中逸出的观察
葫芦素E处理后HFF细胞存在虫体逸出现象,且与葫芦素E浓度有关。20、50和100 μmol/L葫芦素E处理后的逸出率分别为16.20%±4.75%、46.50%±7.53%、76.20%±9.42%,与对照组比较差异均有统计学意义(P<0.05)。见图1。
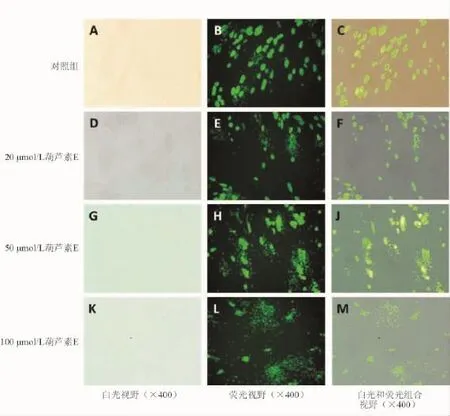
图1 葫芦素E诱导弓形虫逸出的观察
二、葫芦素E诱导刚地弓形虫逸出与虫体运动能力的关系
细胞松弛素D预处理组和BAPTA-AM预处理组的逸出率略高于空白对照组,但差异均无统计学意义(P均>0.05);但与50 μmol/L葫芦素E单独处理组相比,细胞松弛素D预处理组和BAPTA-AM预处理组的逸出率明显降低(P均<0.05)。细胞松弛素D预处理组和BAPTA-AM预处理组之间逸出率差异无统计学意义(P>0.05)。见图2。
三、逸出虫体的毒力变化
逸出虫体在感染HFF细胞24 h后处于8速殖子纳虫空泡状态的比例为35.80%±9.37%,与对照组(40.00%±9.70%)比较差异无统计学意义(P>0.05)。对照组小鼠的平均存活时间为4.5 d,逸出虫体组小鼠平均存活时间为5.0 d,2组之间差异无统计学意义(P>0.05)。见图3。
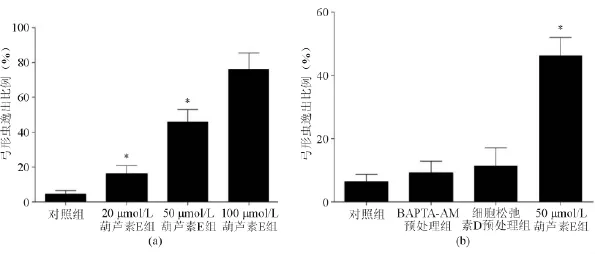
图2 葫芦素E诱导刚地弓形虫逸出与药物浓度、虫体运动、虫体钙离子的关系

图3 自然逸出和葫芦素E诱导逸出的刚地弓形虫在细胞内复制和毒力水平的比较
讨论
弓形虫感染可引起肿瘤部位免疫微环境的变化,提示弓形虫,尤其是弱毒虫株具有抗肿瘤免疫调节物的作用[5-7]。研究表明,抗肿瘤药物紫杉醇可抑制刚地弓形虫在宿主细胞的分裂增殖[8]。本研究发现抗肿瘤药物葫芦素E可诱导刚地弓形虫逸出,并且逸出率依赖于药物剂量、虫体内钙离子和虫体运动能力。逸出虫体的胞内复制和毒力水平均无明显变化。
研究表明穿孔素孵育、死亡受体偶联诱导的虫体逸出以及乙醇诱导的虫体逸出与虫体内的钙离子有关[4]。IFN-γ诱导星形胶质细胞内弓形虫的逸出可能是由于纳虫空泡表面附着的宿主细胞内质网钙离子流动到纳虫空泡后引起虫体运动增强而引发的[2]。本研究结果表明葫芦素E诱导的虫体逸出和虫体内的钙离子有关。用BAPTAAM螯合虫体内的钙离子后葫芦素E诱导虫体逸出比例明显下降[见图2(b)]。钙离子主要通过调控弓形虫钙依赖性蛋白激酶1(Toxoplasma gondii calcium-dependent protein kinase1,TgCDPK1)蛋白活性[10],促进微线蛋白[如弓形虫穿孔素样蛋白1(Toxoplasma gondii porforin-like protein 1,TgPLP1)]的释放,进而引发纳虫空泡膜通透性增加,最终导致虫体主动逸出[11]。葫芦素E诱导的虫体逸出可能也是通过调节TgCDPK1蛋白活性,引发TgPLP1释放实现的。其中的虫体内源性钙离子调节通路可能是由脱落酸介导[12],但这仍需要后续大量实验证实。
研究表明,钙离子载体A23187或IFN-γ诱导逸出的虫体可能在入侵周围细胞的能力上有所下降,说明这种提前逸出是宿主清除胞内病原的一种新模式[13-14]。虽然本研究发现葫芦素E诱导逸出的虫体在毒力上没有发生明显变化,但这些逸出的虫体若被活化免疫细胞捕获就会被杀灭,提示抗肿瘤药物具有抗弓形虫的潜在应用价值。
综上所述,本研究发现抗肿瘤候选药物葫芦素E具有诱导刚地弓形虫逸出的效果,但葫芦素E诱导刚地弓形虫逸出的具体分子机制仍需进一步研究。
[1]STOMMEL EW,CHO E,STEIDE JA,et al.Identification and role of thiols in Toxoplasma gondii egress[J].Exp Biol Med(Maywood),2001,226 (3):229-236.
[2]MELZER T,DUFFY A,WEISS LM,et al.The gamma interferon(IFN-gamma)-inducible GTP-binding protein IGTP is necessary for toxoplasma vacuolar disruption and induces parasite egression in IFN-gamma-stimulated astrocytes[J].Infect Immun,2008,76(11):4883-4894.
[3]JI YS,SUN XM,LIU XY,et al.Toxoplasma gondii: effects of exogenous nitric oxide on egress of tachyzoites from infected macrophages[J].Exp Parasitol,2013,133(1):70-74.
[4]PERSSON EK,AGNARSON AM,LAMBERT H,et al.Death receptor ligation or exposure to perforin trigger rapid egress of the intracellular parasite Toxoplasma gondii[J].J Immunol,2007,179(12): 8357-8365.
[5]FOX BA,SANDERS KL,CHEN S,et al.Targeting tumors with nonreplicating Toxoplasma gondii uracil auxotroph vaccines[J].Trends Parasitol,2013,29 (9):431-437.
[6]程启媛,徐军,杨小迪,等.弓形虫Prugniaud株诱导的对小鼠黑色素瘤抑制作用的体内实验研究[J].热带病与寄生虫学,2009,7(1):13-16.
[7]焦玉萌,章黎,葛以跃,等.弓形虫排泄分泌抗原对B16F10黑素瘤小鼠CD4+CD25+FoxP3+T细胞和NK细胞的影响[J].中国血吸虫病防治杂志,2011,23(3):301-306.
[8]ESTES R,VOGEL N,MACK D,et al.Paclitaxel arrests growth of intracellular Toxoplasma gondii[J].Antimicrob Agents Chemother,1998,42(8):2036-2040.
[9]CHEN J,HUANG SY,ZHOU DH,et al.DNA immunization with eukaryotic initiation factor-2α of Toxoplasma gondii induces protective immunity against acute and chronic toxoplasmosis in mice[J].Vaccine,2013,31(52):6225-6231.
[10]LOURIDO S,SHUMAN J,ZHANG C,et al.Calcium-dependent protein kinase 1 is an essential regulator of exocytosis in Toxoplasma[J].Nature,2010,465(7296):359-362.
[11]KAFSACK BF,PENA JD,COPPENS I,et al.Rapid membrane disruption by a perforin-like protein facilitates parasite exit from host cells[J].Science,2009,323(5913):530-533.
[12]NAGAMUNE K,HICKS LM,FUX B,et al.Abscisic acid controls calcium-dependent egress and development in Toxoplasma gondii[J].Nature,2008,451(7175):207-210.
[13]NIEDELMAN W,SPROKHOLT JK,CLOUGH B,et al.Cell death of gamma interferon-stimulated human fibroblasts upon Toxoplasma gondii infection induces early parasite egress and limits parasite replication[J].Infect Immun,2013,81(12):4341-4349.
[14]CALDAS LA,DE SOUZA W,ATTIAS M.Calcium ionophore-induced egress of Toxoplasma gondii shortly after host cell invasion[J].Vet Parasitol,2007,147(3-4):210-220.
Observation of cucurbitacin E-induced egress of Toxop lasma gondii from host cells
QIU Jiayang.(Department of Clinical Laboratory,the First People's Hospital of Huainan,Anhui Huainan 232007,China)
ObjectiveTo investigate the effect of cucurbitacin E on the egress of Toxoplasma gondii from host cells.MethodsToxoplasma gondii infected HFF cells were treated with cucurbitacin E(20,50 and 100 μmol/L)for 1 h,and the egress rate was evaluated statistically.Toxoplasma gondii infected HFF cells were pretreated with Cyto-D and 1,2-bis(2-aminophenoxy)ethane-N,N,N',N'-tetraacetic acid tetrakis acetoxymethyl ester(BAPTA-AM),followed by 50 μmol/L cucurbitacin E treatment for 1 h and egress determination.The virulence change of egressing Toxoplasma gondii,such parasites were collected and used to re-infect HFF or infect Kunming mice,was analyzed.ResultsCucurbitacin E could induce the egress of Toxoplasma gondii from host cells,and the egress rate increased with the concentration of cucurbitaci E.Cucurbitacin E-induced ergess depended on the gliding ability of Toxoplasma gondii and intra-parasite calcium.There was no difference between cucurbitacin E-induced egressing parasite and naturally egressing parasite in virulence.ConclusionsCucurbitacin E could induce the egress of Toxoplasma gondii from host cells,which provides new direction to study the interactions between Toxoplasma gondii and its host cells.
Cucurbitacin E;Toxoplasma gondii;Egress
1673-8640(2015)09-0944-04
R979.1
A
10.3969/j.issn.1673-8640.2015.09.018
2015-07-09
(本文编辑:龚晓霖)
邱家洋,男,1969年生,学士,副主任技师,主要从事医学检验工作和病原微生物学研究。
