树莓果粉对I 型糖尿病大鼠血糖、免疫反应及氧化应激的影响
2015-01-08杨永晶韩丽娟索有瑞杨永栋
杨永晶,韩丽娟,孟 晶,索有瑞,常 珊,杨永栋
1中国科学院西北高原生物研究所,西宁 810001;2 中国科学院大学研究生院,北京 100049;3 青海大学农林科学院,西宁 810001;4 青海瑶池生物科技有限公司,海东 810599;5 青海省康乐医院,西宁 810000
I 型糖尿病又称胰岛素依赖型糖尿病,是一种由于机体产生异常自身免疫应答破坏胰岛β 细胞,使胰岛素分泌绝对减少所致的自身免疫代谢性疾病[1]。这种复杂的异常自身免疫应答的发生机制尚不清楚,但多种研究证实胰岛β 细胞损伤与多种免疫细胞和炎症因子有关,包括T 淋巴细胞、B 淋巴细胞、巨噬细胞、树突细胞、肿瘤坏死因子-α(TNFα)、干扰素-γ(IFN-γ)、白介素(IL)等[2]。此外,氧化应激在糖尿病的产生和发展中也扮演着重要角色[3]。异常自身免疫应答产生的自由基对胰岛β细胞亦具有极大地破坏作用。
皮下注射胰岛素一直是治疗Ⅰ型糖尿病的最主要手段,这种方法虽然能控制临床症状,却不能缓解胰岛β 细胞的损伤[4]。此外,临床上也尝试应用广谱免疫抑制剂如环孢霉素、咪唑硫嘌呤、强的松以及抗胸腺细胞的免疫球蛋白等来治疗Ⅰ型糖尿病。但随着治疗时间的增长,这种免疫治疗会产生严重的免疫抑制[5],给病人带来极大的痛苦。
树莓(Rubus idaeusL.)为蔷薇科悬钩子属植物,又名覆盆子、山莓、牛奶泡等。树莓主要分布于北半球温带和寒带。近年来,随着广泛的人工培育、引种和种植,目前已有几百个树莓品种。树莓果实为多浆小聚合果,味甜微酸,营养丰富,其中含有大量的维生素、矿质元素、蛋白质、氨基酸等。此外,树莓果实中还含有多糖、有机酸、黄酮、花青素、多酚、挥发油、鞣质等多种生物活性成分。现代药理研究表明,树莓具有抗氧化、抗炎、抗血栓、抗癌、抗疲劳等多种活性[6,7],具有极高医疗保健作用,被誉为“黄金水果”。本研究采用链脲霉素(Streptozotocin,STZ)诱导的大鼠模型来研究树莓果粉在Ⅰ型糖尿病中降血糖、免疫调节及抗氧化的活性。
1 材料与仪器
1.1 实验动物
SD 大鼠60 只,雄性,体重170~190 g,购自甘肃中医学院[动物合格证号为:SYXK(甘)2011-0001]。
1.2 实验材料
树莓冷冻果(品种:Heritage 哈瑞太兹),购自青海瑶池生物科技有限公司。链脲霉素(streptozotocin,STZ)购自北京中生瑞泰科技有限公司。格列本脲片(glibenclamide,山西云鹏制药,批号为:A130801)购自同仁堂大药房。丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)试剂盒;免疫球蛋白IgG、IgA、IgE、IgM,细胞因子白介素-2(IL-2)、干扰素-γ(INF-γ)、肿瘤坏死因子-α(TNFα)以及CD4、CD8 分子酶联免疫测试盒均购自南京建成生物工程研究所。其他试剂购自青海天顺化学试剂公司,均为分析纯。
1.3 实验仪器
血糖测试仪及血糖试纸(三诺,天士力大药房)、涡旋混合仪(TD-RS-1,北京同德创业科技有限公司)、电热恒温鼓风干燥箱(DHG-9203A,上海一恒科技有限公司)、高速连续型超微粉碎机(CLF-30B,浙江省温岭市创力药材器械厂)、恒温水浴锅(DZKW-D-4,河南郑州南北仪器设备有限公司)、酶标仪(RT-6000,北京裕天医疗技术)、组织匀浆仪(FSH-2A,金坛市友联仪器研究所)。
2 实验方法
2.1 树莓果粉及果粉混悬液的制备
将树莓冷冻果置于电热恒温鼓风干燥箱中除去水分(温度55 ℃)。用超微粉碎机粉碎树莓干果(转速22000 rpm,时间1~2 s)后过80 目筛网(孔径0.2 mm),除去完好无损的树莓籽,即得到树莓果粉。灌胃给药前,称取一定量的树莓果粉置于纯水中,于涡旋混合仪上混合数次制成均匀的混悬液,现用现配。
2.2 大鼠糖尿病模型的制备及给药方法
SD 大鼠先进行一周的适应性饲养,饲养条件如下:室温22 ±2 ℃,相对湿度45 ±5%,使其自由饮水和进食。造模前,大鼠尾静脉采血,测血糖,称体重。之后禁食12 h,在大鼠空腹状态下按60 mg/kg的浓度一次性腹腔注射STZ(将STZ 溶于pH4.2 的0.1 mol/L 的柠檬酸盐缓冲液。为防止STZ 降解,必须在避光条件下配置和注射)。96 h 后尾静脉采血测血糖,血糖值≥16.8 mmol/L 的大鼠即被认定为糖尿病大鼠。将糖尿病大鼠随机分为4 组,每组10 只,分别为模型组、阳性对照组、树莓果粉低剂量组和树莓果粉高剂量组。另取10 只同批健康大鼠作为正常组。大鼠分组当天称体重并给药,给药方式及剂量如下:正常组和模型组大鼠:纯水;阳性对照组:格列本脲片20 mg/kg;树莓果粉低剂量组:树莓果粉混悬液750 mg/kg;树莓果粉高剂量组:树莓果粉混悬液1500 mg/kg。给药方式均为灌胃,连续给药20 d,每5 d 测量血糖并称体重。
2.3 生化指标的测定
实验第21 d,大鼠腹腔注射水合氯醛溶液全身麻醉,经颈总动脉插管收集血液,并于3000 rpm 4℃离心10 min 获取血清样本。将血清样本按50 μL分装后于-80 ℃超低温冰箱中冻存备用。将收集过血液的大鼠脱颈椎处死,收集胰腺组织样本。将一部分胰腺组织样本浸泡于10%甲醛溶液中固定,用于组织病理学研究,另一部分样本于-80 ℃超低温冰箱中冻存备用。
将胰腺组织称重,在冰浴条件下用事先预冷的匀浆介质(pH7.4,0.01 mol/L Tris-HCl,0.0001 mol/L EDTA-2Na,0.01 mol/L 蔗糖,0.8%氯化钠溶液)制成10%匀浆液。3000 rpm 4 ℃离心10 min,取上清。依照测试盒说明书测定上清液中MDA、SOD、GSH 的含量。
血清中MDA、SOD、GSH 以及血清中免疫指标IgG、IgA、IgE、IgM、IL-2、INF-γ、TNF-α、CD4、CD8 的测定均依照测试盒说明书进行。
2.4 组织病理学研究
将固定好的组织经乙醇脱水,二甲苯透明,石蜡包埋,切片贴片,二甲苯脱蜡,HE 染色,脱水透明,封固后于光学显微镜下观察并拍照。
3 实验结果
3.1 树莓果粉对STZ 所致糖尿病大鼠基本体征的影响
造模后各组糖尿病大鼠的体重较正常大鼠均明显下降,垫料较正常大鼠的潮湿,符合糖尿病的基本体征,这也从另一方面说明此糖尿病模型是成功的。正常大鼠毛色有光泽,垫料干燥,体重稳步增长。模型组大鼠毛色枯槁,轻度脱毛,垫料潮湿,体重下降明显。各给药组大鼠毛色较模型组好,垫料潮湿情况较模型组有所减轻。体重下降情况较模型组明显缓解,其中阳性对照组大鼠的体重与模型组相比有显著性差异(*P<0.05vs模型组),树莓果粉高低剂量组大鼠的体重与模型组相比有极显著性差异(**P<0.01vs模型组)。此结果说明树莓果粉能明显缓解糖尿病所致的体重下降(如图1)。
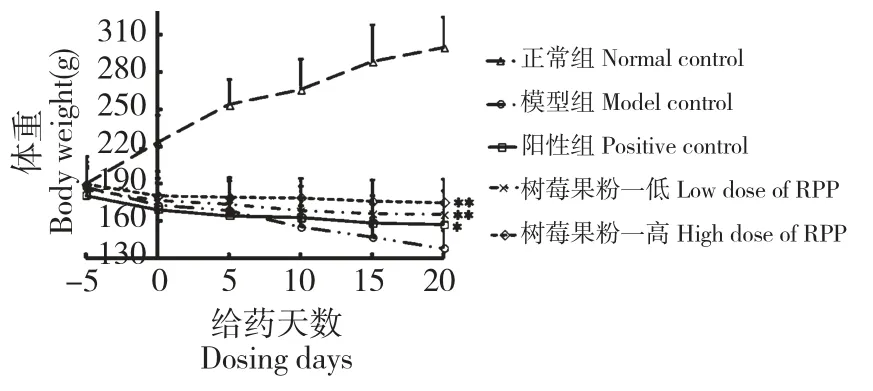
图1 树莓果粉对糖尿病大鼠体重的影响Fig.1 Effect of RPP on the body weight of STZ-induced diabetic rats
3.2 树莓果粉对STZ 所致糖尿病大鼠血糖的影响
造模后,正常大鼠的血糖无明显变化,而各组糖尿病大鼠血糖与正常大鼠相比均明显升高。但随着治疗的进行,情况出现明显扭转。给药最后一天,各给药组大鼠的血糖与模型组相比均有极显著的下降(**P<0.01vs模型组),且树莓果粉的降血糖作用随剂量的增加而增强,其中树莓果粉高剂量组给药最后一天的效果与阳性药格列本脲片相当(见图2)。
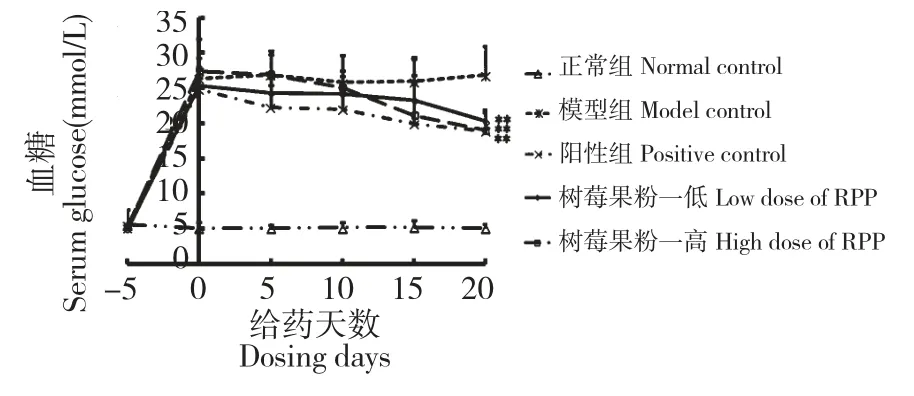
图2 树莓果粉对糖尿病大鼠血糖的影响Fig.2 Effect of RPP on the blood glucose of STZ-induced diabetic rats
3.3 树莓果粉对STZ 致糖尿病大鼠胰腺的影响
通过胰腺的组织病理切片可以看出,正常大鼠胰腺组织中的胰岛形态规则,且均匀分布着大量胰岛β 细胞。相比之下,模型组大鼠胰腺组织中的胰岛由于受到STZ 的破坏而严重损伤,形态扭曲,胰岛β 细胞数量锐减,且出现凋亡或坏死。给药后,阳性对照组以及树莓果粉组大鼠的胰岛与模型组相比均有明显的恢复,主要表现为胰岛细胞形态的规则化和胰岛β 细胞数量的增加。说明树莓果粉能一定程度地修复STZ 对胰岛造成的损伤(如图3)。
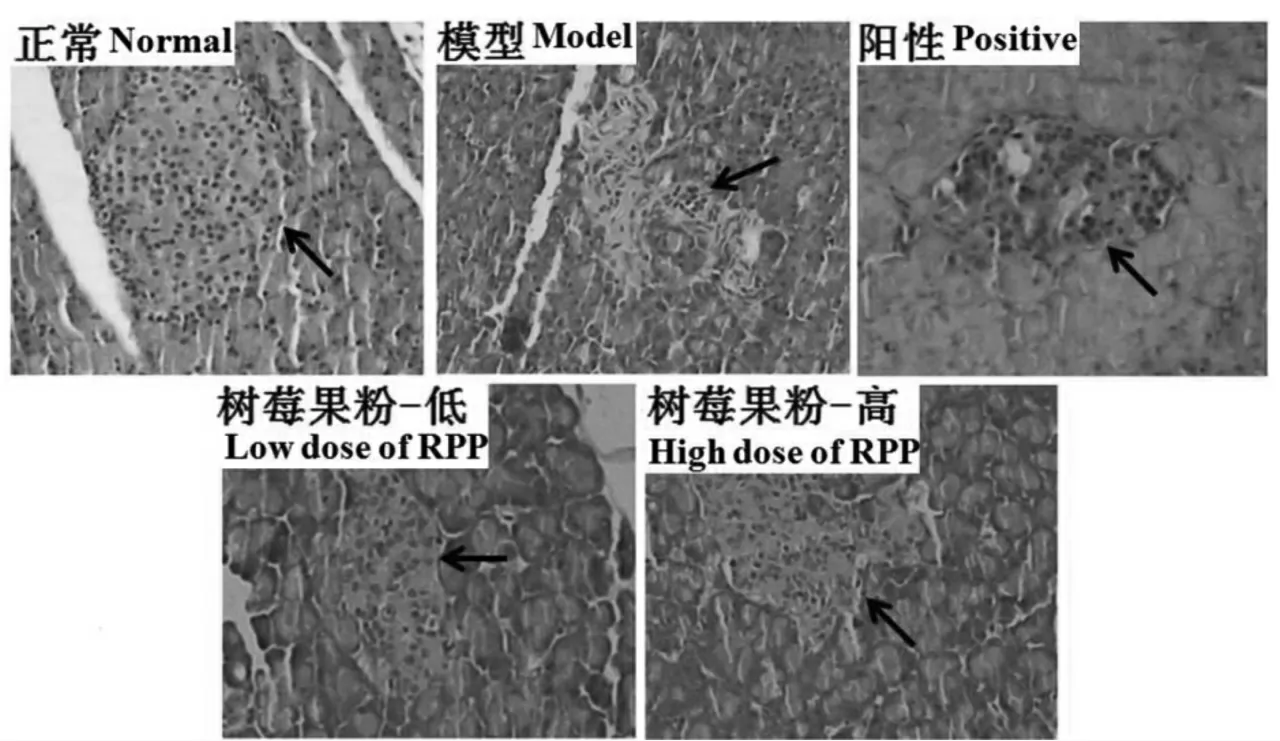
图3 糖尿病大鼠的胰腺组织病理学分析(400 ×)Fig.3 Histopathologic examination of pancreas in STZ-induced diabetic rats (H&E stain,400 ×)
3.4 树莓果粉对糖尿病大鼠的免疫调节
3.4.1 树莓果粉对STZ 所致的糖尿病大鼠血清中CD4、CD8 分子的影响
如图4 所示,与正常组相比,模型组大鼠血清中CD4 和CD8 分子的浓度极显著升高(##P<0.01vs常组)。在树莓果粉的作用下,糖尿病大鼠血清中CD4 分子的浓度较模型组显著性下降(*P<0.05vs模型组),CD8 分子的浓度与模型组相比极显著性地下降(**P<0.01vs模型组)。而阳性对照组大鼠血清中CD4 和CD8 分子的浓度较模型组无明显改变。
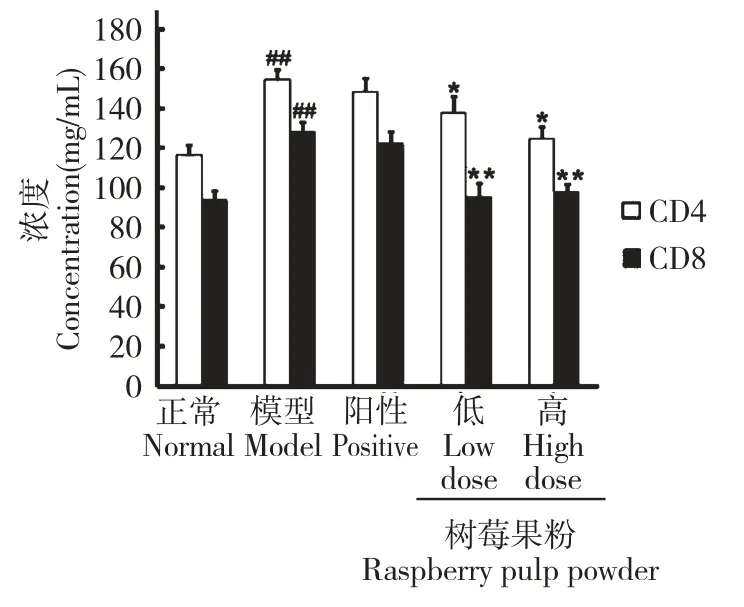
图4 树莓果粉对糖尿病大鼠血清中CD4、CD8 分子的影响Fig.4 Effects of RPP on the levels of CD4 and CD8 in serum of STZ-induced diabetic rats
3.4.2 树莓果粉对STZ 所致的糖尿病大鼠血清中IL-2、TNF-α、IFN-γ 的影响
如图5 所示,模型组大鼠血清中IL-2、TNF-α 和IFN-γ 的含量较正常大鼠急剧增加(##P<0.01vs正常组),而树莓果粉则明显减弱了这一趋势。树莓果粉高、低剂量组大鼠血清中的IL-2、TNF-α 和IFNγ 较模型组均显著下降(*P<0.05,**P<0.01vs模型组),且呈现剂量依赖关系。阳性对照组大鼠血清中IL-2、TNF-α 和IFN-γ 的含量与模型组相比无明显改变。
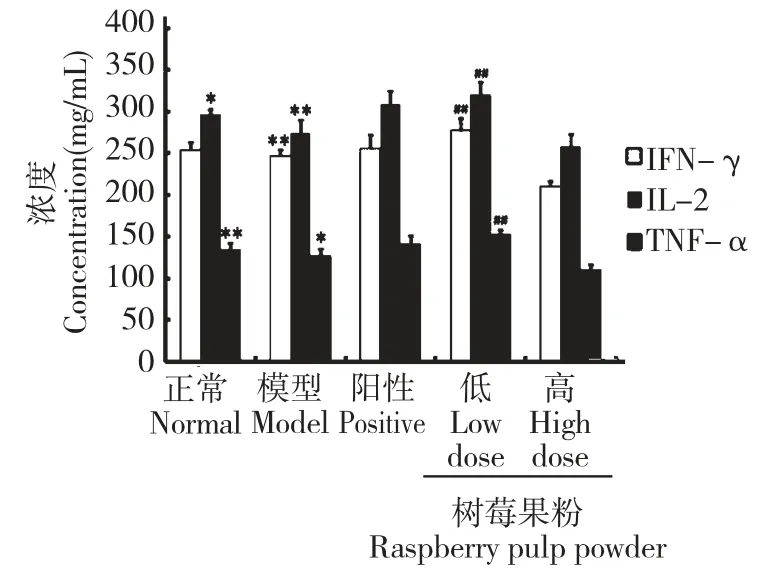
图5 树莓果粉对糖尿病大鼠血清中TNF-α、IFN-γ 和IL-2 的影响Fig.5 Effects of RPP on the concentrations of TNF-α,IFNγ and IL-2 in serum of STZ-induced diabetic rats
3.4.3 树莓果粉对STZ 所致的糖尿病大鼠血清中免疫球蛋白IgG、IgA、IgE、IgM 的影响
图6 为各组大鼠血清中免疫球蛋白IgG、IgA、IgE 和IgM 的含量,可以看出模型组大鼠血清中4种免疫球蛋白与正常大鼠相比具有极显著的增加(##P<0.01vs正常组)。树莓果粉对糖尿病大鼠血清中IgM 无明显影响,与模型组相比无显著性差异。但树莓果粉能显著降低糖尿病大鼠血清中IgG、IgA和IgE 的浓度(*P<0.05,**P<0.01vs模型组),且呈现剂量依赖关系。阳性对照组大鼠血清中IgG、IgA、IgE 和IgM 的含量与模型组相比均无明显改变。
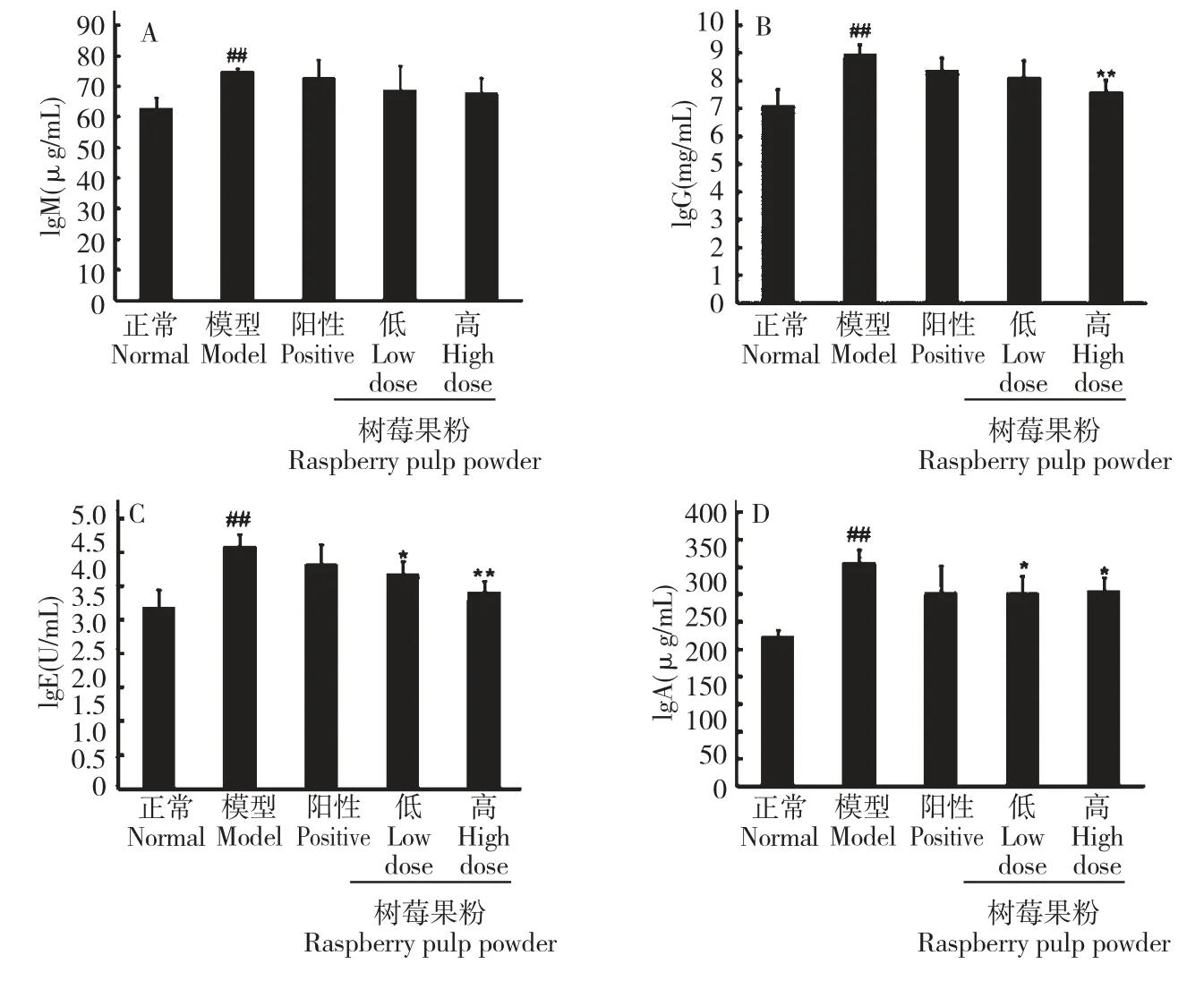
图6 树莓果粉对糖尿病大鼠血清中IgG、IgA、IgE 和IgM 含量的影响Fig.6 Effects of RPP on the concentrations of IgG,IgA,IgE and IgM in serum of STZ-induced diabetic rats
3.5 树莓果粉对STZ 所致糖尿病大鼠血清、胰腺中SOD、GSH 和MDA 的影响
如图7 所示,模型组大鼠胰腺和血清中的SOD活性和GSH 含量与正常组相比明显下降,而MDA的含量较正常组显著上升(##P<0.01vs正常组)。格列本脲与树莓果粉均能明显增加糖尿病大鼠胰腺和血清中的SOD 的活性和GSH 含量,并降低MDA的含量(*P<0.05,**P<0.01vs模型组)。树莓果粉的作用呈现剂量依赖性。
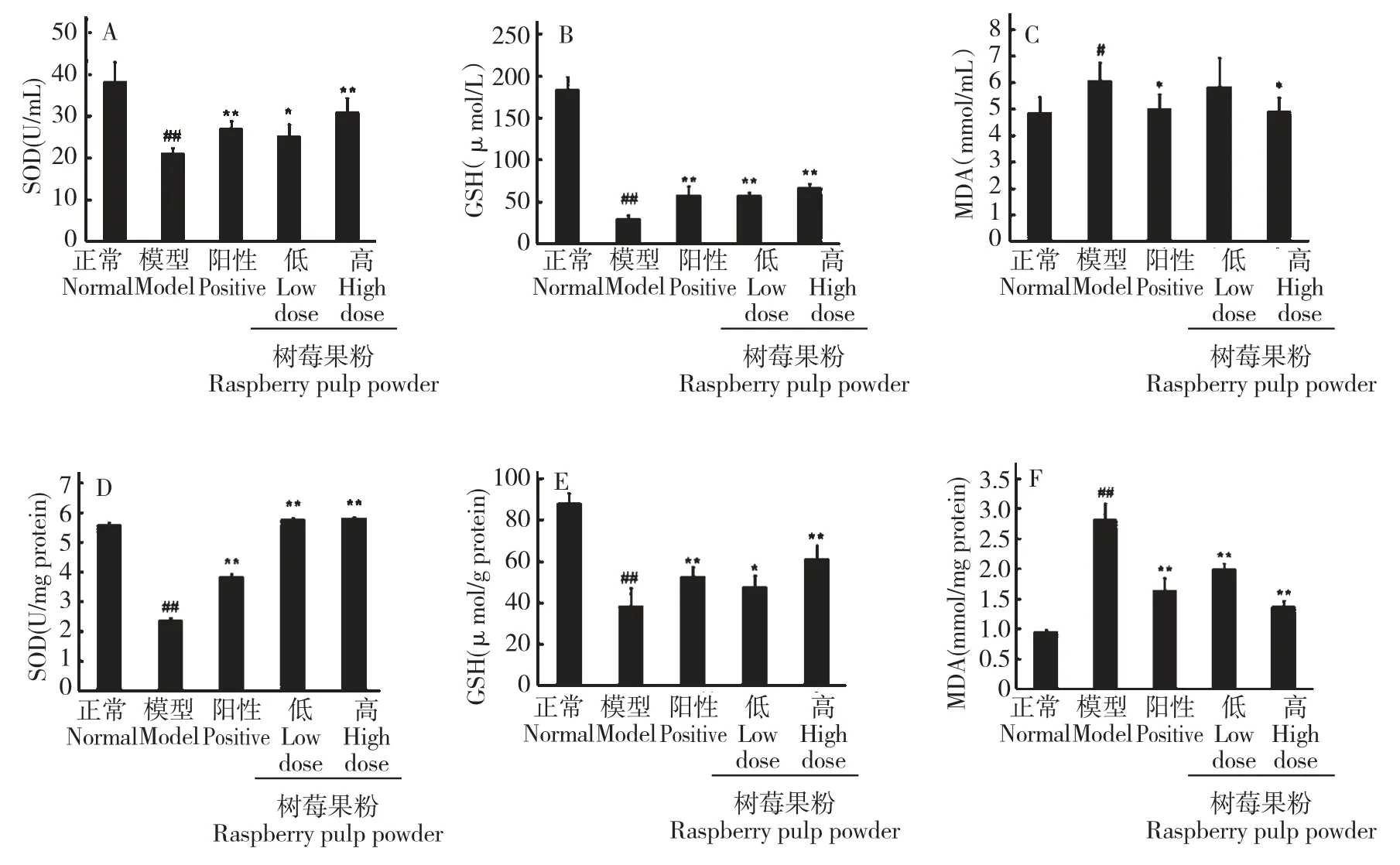
图7 树莓果粉对糖尿病大鼠胰腺和血清中SOD、GSH 和MDA 的影响Fig.7 Effects of RPP on SOD,GSH and MDA in pancreas and serum of STZ-induced diabetic rats
4 讨论
STZ 是一种天然化学物质,现已被广泛应用于Ⅰ型糖尿病动物模型的建立中。STZ 能特异性地损伤分泌胰岛素的胰岛β 细胞,并引起导致Ⅰ型糖尿病的自身免疫反应,且模型的临床表现与组织病理同人类的Ⅰ型糖尿病极为相似[8,9]。此外,STZ 诱导的糖尿病模型还具有氧化应激的特点,这正是其他糖尿病模型所缺乏的[10]。因此,本研究采用STZ 诱导的大鼠模型来研究树莓果粉在Ⅰ型糖尿病中降血糖、免疫调节及抗氧化的活性。
Ⅰ型糖尿病的临床表现为典型的“三多一少”症状,即多饮、多食、多尿和体重下降,并伴有血糖及尿糖的升高。在本研究中,树莓果粉能增加糖尿病大鼠的体重,降低其血糖,并对糖尿病大鼠受损的胰岛有一定的修复作用,显示出了较好的治疗Ⅰ型糖尿病的活性。
胰岛β 细胞的损伤是由机体异常的自身免疫反应导致的。这种复杂的自身免疫过程是由多种免疫细胞、细胞因子协同作用完成的,其过程大致如下:负责β 细胞抗原递呈的巨噬细胞和树突细胞激活CD4+T 淋巴细胞,巨噬细胞释放的IL-12 能刺激CD4+T 淋巴细胞分泌IFN-γ 和IL-2。IFN-γ 进一步激活其余巨噬细胞并使其依次释放IL-1β、TNF-α 以及自由基等,这些对β 细胞都会造成极大的损伤。此外,CD4+T 淋巴细胞分泌的细胞因子能协助CD8+T 淋巴细胞和B 淋巴细胞与抗原递呈细胞相互作用。最终,CD8+T 淋巴细胞直接攻击携带目标抗原的β 细胞,造成β 细胞严重损伤甚至裂解[11,12]。外周血中的CD4 和CD8 分子是CD4+与CD8+的可溶形式,它们被认为是T 淋巴细胞被激活的重要标志[13]。本研究发现,树莓果粉能明显降低糖尿病大鼠血清中CD4 和CD8 分子的含量,说明树莓果粉能减缓T 淋巴细胞的激活。此外,树莓果粉还能降低糖尿病大鼠血清中IFN-γ、IL-2 以及TNF-α的浓度。虽然B 淋巴细胞及其所产生的多种免疫球蛋白在Ⅰ型糖尿病的发生与发展过程中作用尚不明确,但本研究发现树莓果粉对糖尿病大鼠血清中的IgG、IgA 和IgE 存在一定的影响。以上结果说明,树莓果粉能减缓Ⅰ型糖尿病大鼠自身免疫反应的程度,从而减少了胰岛β 细胞的损伤。而本研究中的阳性药对以上免疫指标未产生明显影响。原因是格列本脲片是通过刺激胰腺胰岛细胞分泌胰岛素,抑制肝糖原分解和糖原异生作用以及增加胰外组织对胰岛素的敏感性来达到降血糖作用的,其并没有免疫调节的活性。
氧化应激也是胰岛β 细胞受损的重要因素之一。MDA 是脂质过氧化的产物之一,它的不断积累会破坏细胞膜结构,并引起细胞的代谢障碍产生细胞毒作用[14]。MDA 含量能间接反映细胞的损伤程度。SOD 是清除氧自由基的主要酶,能保护细胞免受氧化应激的伤害。GSH 是由蛋氨酸、甘氨酸和半胱氨酸组成的一种自由基清除剂。SOD 和GHS 在机体的自由基平衡中均具有重要作用,它们的含量能间接反映机体抗氧化损伤和清除氧自由基的能力[15]。本研究发现,树莓果粉能显著增强糖尿病大鼠胰腺和血清中的SOD 活性,增加GSH 含量,并明显降低MDA 的含量,说明树莓果粉能很好地改善胰岛β 细胞的氧化应激状况,从而缓解β 细胞的损伤。
综上所述,树莓果粉显示出了良好的治疗Ⅰ型糖尿病的活性,且其能通过减缓Ⅰ型糖尿病大鼠自身免疫反应的程度和改善氧化应激状况来缓解胰岛β 细胞的损伤。此研究为树莓的进一步开发和利用提供了坚实的实验基础和科学依据。
1 Szablewski L.Role of immune system in type 1 diabates mellitus pathogenesis.Int Immunopharmacol,2014,22:182-191.
2 Zipris D.Innate immunity in type 1 diabetes.Diabetes-Metab Res,2011,27:824-829.
3 Jia J,Zhang X,Hu YS,et al.Evaluation ofin vivoantioxidant activities ofGanoderma lucidumpolysaccharides in STZ-induced diabetic rats.Food Chem,2009,115:32-36.
4 Li RJ(李如江),Qiu SD(邱曙东),Chen HX(陈红霞),et al.Immunomodulatory effects ofAstragaluspolysaccharide in diabetic mice.J Chin Integr Med(中西医结合学报),2008,6:166-170.
5 Herold KC,William MD,Hagopian MD,et al.Anti-CD3 monoclonal antibody in new-onset type 1 diabetes mellitus.New Engl J Med,2002,346:1692-1698.
6 Meng XJ(孟祥娟),Liu B(刘斌),Re ZCD(热增才旦),et al.Progress of chemical constituents and pharmacology of Genus Rubus.Nat Prod Res Dev(天然产物研究与开发),2011,23:767-775.
7 Du LF(杜龙飞),Li J(李洁),Yang L(杨龙),et al.Chemical constituents from the fruits ofRubus chingiiHu.Nat Prod Res Dev(天然产物研究与开发),2014,26:1957-1960.
8 Kraine MR,Tisch RM.The role of environmental factors in insulin-dependent diabetes mellitus:an unresolved issue.Environ Health Persp,1999,5:777-781.
9 Hectors TL,Vanparys C,van der Ven K,et al.Environmental pollutants and type 2 diabetes:a review of mechanisms that can disrupt beta-cell function.Diabetologia,2011,54:1273-1290.
10 Lubec B,Hermon M,Hoeger H,et al.Aromatic hydroxylation in animal models of diabetes mellitus.Faseb J,1998,12:1581-1587.
11 Szablewski L.Role of immune system in type 1 diabetes mellitus pathogenesis.Int Immunopharmacol,2014,22:182-191.
12 Hasan GA,Sliem HA,Ellethy AT,et al.Role of immune system modulation in prevention of type 1 diabetes mellitus.Indian J Endocrinol Metabol,2012,16:904-909.
13 Li JL,Shi BL,Yan SM.Effects of dietary supplementation of chitosan on humoral and cellular immune function in weaned piglets.Anim Feed Sci Tech,2013,186:204-208.
14 Esterbauer H.Cytotoxicity and genotoxicity of lipid-oxidation products.Am J Clin Nutri,1993,57:779-785.
15 Djordjevic A,Spasic S,Jovanovic-Galovic A,et al.Oxidative stress in diabetic pregnancy:SOD,CAT and GSH-Px activity and lipid peroxidation products.J Matern Fetal Neonatal Med,2004,16:367-372.
