大鲵皮肤粘液多糖的提取及单糖组成分析
2015-01-08陈德经徐伟良季晓晖
陈德经,徐伟良,苏 文,季晓晖
1陕西理工学院陕西省资源生物重点实验室;2陕西理工学院生物科学与工程学院;3 陕西理工学院化学与环境科学学院,汉中 723001
多糖(Polysaccharides)又称多聚糖,是自然界中含量最丰富的一种生物聚合物[1],而从动物中提取的天然多糖因具有良好的抗氧化、免疫调节和抗肿瘤等作用受到国内外学者的关注,使得对动物多糖的研究日益增多和深入[2,3]。
大鲵(Andrias davidianusBlanchard)属大型两栖纲、有尾目、隐鳃鲵科,是国家二级保护动物,有活化石之称[4]。大鲵皮肤腺体主要有粘液腺(mucus gland)和颗粒腺(granular gland)两种,粘液腺体细胞可释放粘糖蛋白,与水结合后成为黏液,覆盖在上皮游离面,形成了一道天然的防护屏障[5,6]。有学者从大鲵体表黏液获得了大鲵低聚糖肽,并证明了该糖肽具有抗氧化、抗疲劳及对小鼠急性肝损伤有一定的保护作用[7-9]。大鲵皮肤颗粒腺能够分泌具有特殊性气味的白色粘稠状粘液,其成分是含有丰富的功能复杂多样的生物活性分子,具有广普抗菌、抗肿瘤等作用[10,11]。
本论文采用水提法、酶解法、碱提法及酸提法对大鲵皮肤粘液中的多糖进行提取,并采用柱前衍生高效液相色谱法对大鲵皮肤粘液多糖的单糖组分进行分析,为大鲵皮肤粘液多糖开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
成熟大鲵,陕西汉源生物科技有限公司提供;衍生化试剂:1-苯基-3-甲基-5-吡唑啉酮(PMP)购自上海涛宇国际贸易有限公司;葡萄糖(Glc)、甘露糖(Man)、半乳糖(Gal)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA)、N-乙酰氨基葡萄糖(GlcN)均为中检所产品;D-氨基半乳糖(GalN),购自大连美仑生物技术有限公司;碱性蛋白酶、酸性蛋白酶,购自宁夏和氏璧生物技术有限公司;三氟乙酸(≥99%),乙腈(色谱纯),其它试剂均为分析纯。
1.1.2 仪器与设备
Agilent1200 高效液相色谱(包括G1311A 四元泵,G1315B DAD 检测器,G1316A 柱温箱);XDBC18色谱柱(4.6 mm×150 mm,5 μm,美国Agilent 公司);722G 可见分光光度计(上海仪电分析仪器有限公司);LC-800 低速离心机(科大创新股份有限公司);KQ-100DA 型数控超声清洗器(苏州江东精密仪器有限公司);601 超级水浴(江苏-瑞华仪有限公司)。
1.2 方法
1.2.1 大鲵皮肤粘液的采集
采用机械刺激法。用软毛刷轻轻拍打或按摩大鲵背部、尾部等皮肤分泌腺较多部位,对其进行温和刺激,使大鲵分泌产生白色粘液,并刮取粘液装入收集瓶中。将采集的大鲵粘液真空冷冻干燥成冻干粉,于-20 ℃下保存待用。
1.2.2 大鲵皮肤粘液多糖的提取及分离
1.2.2.1 碱提法
多糖在碱性溶液中稳定,而蛋白聚糖中的糖肽键对碱具有不稳定性,因此可通过该法使多糖与结合态蛋白的糖肽键断裂,从而提高多糖得率。准确称量5 g 大鲵皮肤粘液冻干粉,以0.4 mol/L 氢氧化钠溶液在料液比为1∶25 g/mL,温度为45 ℃下,提取2 h[12];将提取液以4000 rpm,离心15 min,上清液加入无水乙醇醇沉至终浓度为76%,调pH 至7.0 左右,于4 ℃冰箱中静置8 h;离心去除上清液,沉淀用无水乙醇洗涤三次后进行真空干燥。
1.2.2.2 酸提法
基于醛酸性多糖对酸具有不稳定性,酸提取有助于多糖与结合态蛋白的醛酸键断裂,从而提高多糖得率及纯度。准确称量5 g 大鲵皮肤粘液冻干粉,以料液比1∶25 g/mL,浓度为0.3 mol/L 盐酸,在45 ℃,提取2 h[13,14]。将提取液以碱提法同样步骤进行离心、醇沉、干燥。
1.2.2.3 水提法
多糖是极性大分子化合物,大多数多糖易溶于热水,用水提取较温和,适用于透明质酸等不含硫酸基多糖的提取。准确称量5 g 大鲵皮肤粘液冻干粉,在料液比1∶25 g/mL,提取温度45 ℃条件下,提取2 h[15]。将提取液以碱提法同样步骤进行离心、醇沉。
1.2.2.4 酶解法
选用来源广泛且专一性低的碱性蛋白酶和酸性蛋白酶为试验用酶,蛋白酶易使糖蛋白和蛋白聚糖中游离的蛋白质水解,降低它们对原料的结合力,有利于多糖的浸出。准确称量5 g 大鲵皮肤粘液冻干粉2 份,在料液比1∶25 g/mL,酶解温度45 ℃,酶添加量均为2.5%的条件下,分别加入pH 值为9.0 的碱性蛋白酶和pH 值3.0 的酸性蛋白酶,对样品进行酶解2h[16]。将提取液以碱提法同样步骤进行离心、醇沉。
1.2.3 Sevage 法脱蛋白
将氯仿与正丁醇按体积比4∶1 混合制成Sevage除蛋白液,按不同提取方法所得大鲵粘液多糖溶液按体积的1/4 加入除蛋白液,混合后,剧烈振荡10 min,静置;离心去除变性蛋白,重复数次,至无变性蛋白质析出为止。再经MW 3500 Da 透析袋透析去除小分子杂质,浓缩,真空冷冻干燥,得大鲵粘液粗多糖,并利用公式(1)计算得率。

1.2.4 大鲵皮肤粘液多糖含量的测定——硫酸蒽酮法[17]
1.2.4.1 标准曲线的制作
准确称取0.1 g 葡萄糖,用双蒸水定容至100 mL,分别取出0.5、1、2、3、4、5 mL 分别加入到50 的容量瓶中,并用双蒸水定容至50 mL,配成浓度分别为10、20、40、60、80、100 μg/mL,以双蒸水做对照空白,各取1 mL 于试管中,再加入4 mL 蒽酮试剂(2 g/L),迅速浸入冰水中冷却,待几只试管均匀加完后,一起浸入100 ℃沸水中。自温度重新升至100℃起计时,准确保温10 min 后取出,用流动水冷却。在分光光度计上,进行光谱扫描,检测在波长620 nm 有最大吸收峰,并选择620 nm 检测波长,进行比色,并绘制标准曲线。
1.2.4.2 样品的测定
称取0.1 g 大鲵脱蛋白多糖干燥粉,用去离子水定容至10 mL 容量瓶中,超声震荡30 min,以4000 rpm,离心10 min,取1 mL 上清液定容至10 mL容量瓶中待用。如上述条件一致,取1 mL 粗多糖样品进行比色,依据标准曲线计算粗多糖浓度,并以公式(2)计算多糖含量。

1.2.5 HPLC 测定大鲵皮肤粘液多糖的单糖组成成分[18,19]
1.2.5.1 大鲵皮肤粘液多糖的水解及样品制备
吸取100 μL 质量浓度为4~5 g/L 的精制多糖样品溶液于5 mL 的具塞刻度试管中,加入100 μL的4 mol/L TFA,充N2封管,110 ℃烘箱中水解2 h;冷却后打开盖,加100 μL 甲醇后用N2吹干,如此重复加甲醇并用N2吹3 次,去除TFA。
加入50 μL 0.3 mol/L NaOH 溶液充分溶解残渣,再加50 μL 0.5mol/L 的PMP(0.4355 g/5mL)甲醇溶液,漩涡混匀,同样在70 ℃的烘箱中反应100 min,取出放置10 min 冷却至室温;加50 μL 0.3 mol/L 的HCL 中和;加水至1 mL,再加等体积的氯仿,振摇,静置,弃去氯仿相,如此萃取3 次。将水相用0.45 μm 微孔膜过滤后供HPLC 进样分析。
1.2.5.2 混合单糖标样的衍生
分别取100 μL 的混合单糖标准液(各单糖质量浓度均为0.36 g/L)与100 μL 的0.6 mol/L NaOH溶液,置于1 mL 的具塞试管中混合均匀;再取50 μL 的混合液于5 mL 的具塞试管中,加50 μL 0.5 mol/L 的PMP 甲醇溶液,漩涡混匀;在70 ℃烘箱中反应100 min;冷却后按“1.2.5.1”同法中和、萃取,并用微孔膜过滤。
1.2.5.3 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(250mm ×4.6 mm,5 μm);流动相:0.05 mol/L 磷酸盐(pH 6.9)缓冲液-乙腈(83∶17,V/V);柱温:30 ℃;检测波长:250 nm;流速:1 mL/min;进样体积:10 μL。
2 结果与讨论
2.1 大鲵皮肤粘液多糖得率及含量
不同提取方法所得多糖得率与脱蛋白后所测多糖含量结果如表1 所示。
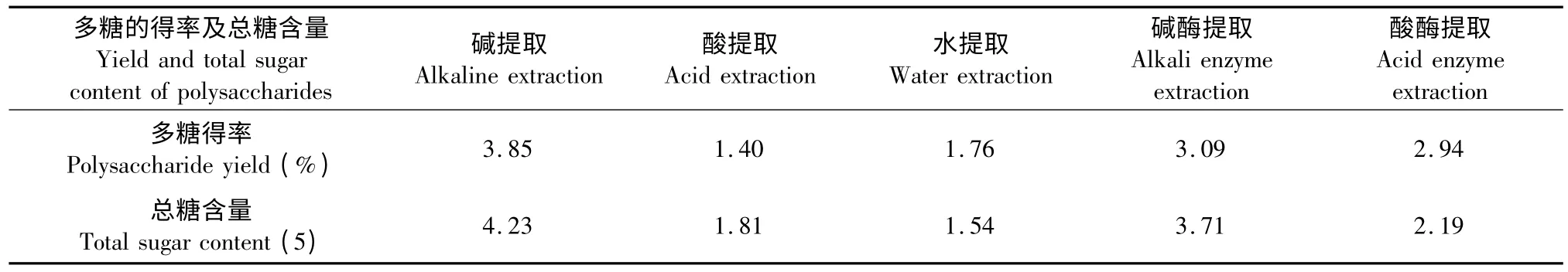
表1 大鲵皮肤粘液多糖的得率及总糖含量Table 1 The polysaccharides yield and total sugar content in skin mucus of A.davidianus
由1 表可知,碱提取多糖的得率最高,为3.85%;碱酶提取多糖得率次之,为3.09%;水提取和酸提取多糖的得率较低,分别为1.76%、1.40%。碱提取、酸提取、水提取、碱酶提取和酸酶提取多糖中总糖含量分别为4.23%、1.54%、1.81%、3.71%、2.19%。
2.2 大鲵皮肤粘液多糖的单糖组成测定
2.2.1 色谱分离条件的优化
选择磷酸盐缓冲液-乙腈为流动相对PMP-单糖衍生物进行色谱分离,据文献报道有梯度洗脱和等度洗脱两种方式[20-22]。先采用梯度洗脱模式:以溶剂A-15%(V/V)乙腈+50 mmol/L 磷酸盐缓冲液(pH=6.0),溶剂B-40 %(V/V)乙腈+50 mmol/L磷酸盐缓冲液(pH=6.0)作为流动相;时间梯度为0 min →9 min →25 min,相应浓度体梯度为0% →10% →55%B,进行色谱分离。再采用0.1 mol/L磷酸盐缓冲液(pH 6.7)-乙腈为流动相,进行等度洗脱分离。结果显示:梯度洗脱分离的7 种单糖峰形效果并不理想,2 种糖醛酸和2 种氨基单糖不能很好的分离。而利用等度洗脱,通过对分离条件选择的系列试验(包括缓冲液pH 值,乙腈体积分数及缓冲液浓度的选择),能够对7 种单糖得到较好的分离,且重现性好,如图1。并最终确定最佳色谱条件为:流动相:A-0.05mol/L 磷酸盐缓冲液(pH 6.9)+B-乙腈,体积比为A∶B=83∶17(V/V)。
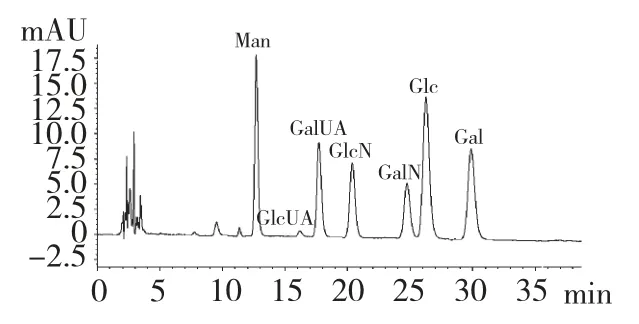
图1 混合单糖的PMP 衍生化产物的色谱图Fig.1 HPLC chromatograph of PMP-labeled standard monosaccharides
2.2.2 衍生化产物稳定性的考察
为了考察7 种单糖标样衍生化产物的稳定性,实验中从反应结束后开始计时,分别于6、8、10、12、16、20、24、32 h 进行色谱分析。实验结果表明,在反应结束后12 h 内各种单糖衍生物的峰面积基本保持不变,20 h 以后,各峰面积有不同程度的减少,32 h 后单糖峰面积减少近30%左右。因此,检测需要在反应结束后20 h 内完成,以得到准确的实验结果。
2.2.3 标准曲线及检出限
将7 种单糖配制成一系列不同浓度的混合标样,分别进行衍生化,并在相同条件下进样检测,以单糖浓度为横坐标,峰面积为纵坐标绘制标准曲线,结果表明各单糖在0.1~2.0 μmol/L 范围内呈良好的线性关系,结果见表2。

表2 7 种单糖的线性回归方程、相关系数及线性范围Table 2 Regression equations,correlation coefficients and linear ranges of seven monosaccharides

表3 不同提取方法所得多糖的单糖组分及摩尔比Table 3 monosaccharide composition and molar ratio under different extraction methods
2.2.4 不同提取方法所得多糖的单糖组成分析结果
经PMP 柱前衍生测得不同提取方法所得多糖的单糖组成及摩尔比如下,碱提取,Man∶GlcUA∶GalUA∶GlcN∶Glc∶Gal=1.71∶4.12∶1.09∶1.55∶1.01∶2.09,如图2-a;酸提取,Man∶GlcUA=0.101∶2.31,如图2-b;水提取,Man∶GlcUA∶Glc=0.01∶1.68∶0.11,如图2-c;碱酶提取,Man∶GlcUA∶GlcN=0.102∶8.79∶6.02,如图2-d;酸酶提取,Man∶GlcUA∶Glc=0.11∶2.64∶1.23,如图2-e。通过上述测定结果显示,碱提取多糖中含有6 种单糖组分,而酸提取多糖中仅含有2 种单糖组分,这是由于在碱性条件下,多糖稳定,易使多糖与结合态蛋白的糖肽键断裂,利于多糖的浸出,而在酸性条件下容易引起多糖中糖苷键的断裂,使多糖结构破坏。水提法和酶解法条件较温和,适用于酸性粘多糖的提取,所得多糖主要由Man、GlcUA 和Glc 3 种单糖组成[23,24]。
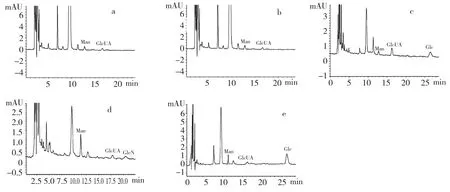
图2 不同提取方法所得多糖的-PMP 衍生化产物的色谱图Fig.2 HPLC chromatograms of PMP derivative products from different polysaccharide extracts
3 结论
本文研究了不同提取方法提取大鲵粘液多糖,其中碱提取大鲵粘液多糖的得率和含量均较高,适用于大鲵多糖的提取分离。建立的PMP 柱前衍生化高效液相色谱分析单糖的方法准确可靠,灵敏度较高,能够较好地测定大鲵皮肤粘液多糖的单糖组分。PMP 柱前衍生测得结果表明,不同提取方法所得大鲵粘液多糖的单糖组成成分及含量尽管各不相同,但主要由甘露糖、葡萄糖醛酸、葡萄糖3 种单糖成分组成。该方法对动物多糖样品的组成分析具有一定指导意义,亦为大鲵皮肤粘液多糖的开发利用提供了依据。
1 Liu CH,Lin QX,Gao Y,et al.Characterization and antitumor activity of a polysaccharide fromStrongylocentrotus nuduseggs.Carbohydr Polymers,2007,67:313-318.
2 Liu XJ(刘兴杰),Liu CL(刘传琳),Ren H(任虹),et al.Comparison of alkaline extraction of glycosaminogl ycans from four marine invertebrates.J Yantai Univ(烟台大学学报),2001,14:264-268.
3 Wang SB,Cheng YN,Wang FS,et al.Inhibition activity of sulfated polysaccharide ofSepiella maindroniink on matrix metalloproteinase (MMP)-2.Biomed Pharm,2008,62:297-302.
4 Hou JH(侯进慧),Zhu BC(朱必才),Tong YW(童玉玮),et al.Research advances of Chinese giant salamander.Sichuan J Zool(四川动物),2004,23:262-266.
5 Liu JY(刘炯宇),Jiang JP(江建平),Xie F(谢锋),et al.Structure and antimicrobial peptides of amphibian skin.Chin J Zool(动物学杂志),2004,39:112-116.
6 Huang ZH(黄智慧),Ma AJ(马爱军),Wang M(汪岷).Research progression in secretion of fish skin mucous and its function.Marine Sci(海洋科学),2009,33:90-94.
7 Qu M(曲敏).Preparation,properties,bioactivities and applications of giant salamander glycopeptides.Shenyang:Shenyang Agricultural University(沈阳农业大学),PhD.2012.
8 Li W(李伟),Yu XY(于新莹),Tong CQ(佟长青),et al.Study on the enzymatic hydrolysates of skin mucous from Andrias davidianus and its anti-fatigue effect.Sci Technol Food Ind(食品工业科技),2011,32:146-148.
9 Qu M(曲敏),Tian LR(田丽冉),Tong CQ(佟长青),et al.Hepatoprotective effects of giant salamander glycopeptides against carbon tetrachloride(CCl4)-induced hepatic injury in mice.Sci Technol Food Ind(食品工业科技),2013,34:350-352.
10 Guo WT(郭文韬).Study on genetic diversity and skin adjunct’s characteristics of Chinese giant salamander.Wuhan:Huazhong University of Science and Technology(华中科技大学),PhD.2013.
11 Wang LF(王利锋),Li XY(李学英),Wang DZ(王大忠).Characterization and bioactivity of antimicrobial peptides from the skin secretions of theAndrias davidianus.Chin J Biochem Pharm(中国生化药物杂志),2011,32:269-272.
12 Xiang D(向东),Lai F(赖凤),Ying LP(英梁平).Alkaline extraction of pumpkin polysaccharide.Sci Technol Food Ind(食品工业科技),2004,25:120-122.
13 Zhang ZC(张志才),Liu GQ(刘高强),Zhang KC(章克昌),et al.Study on extraction of the polysaccharides from mycelium ofTremella auramtialbaby NaOH hydrolysis and ultrafiltration.Food Sci(食品科学),2005,26:145-148.
14 Ju XR(鞠兴荣),Shui D(税丹),He R(何荣),et al.Study on the optimization of the extraction technology of polysaccharides from rapeseed meal by acid using response surface method.J Chin Cereals Oils Assoc(中国粮油学报),2012,27(3):90-93.
15 Yin HG(殷涌光),Han YZ(韩玉珠),Ding HW(丁宏伟).Review on advancement of animal polysaccharides.Food Sci(食品科学),2006,27:256-263.
16 Zhao XU(赵小旭).Extraction,purification,structural analysis and antioxidant activity of polysaccharide from Rana Dybowskii skin.Heilongjiang:Northeast Forestry University(东北林业大学),PhD.2012.
17 Zhang J,Li JY,Li JP,et al.Determination of polysaccharide in rhizoma ofPanax japonicusby anthrone sulfuric acid method and phenol sulfuric method.Central South Pharm(中南药学),2012,10:412-423.
18 Dai J (戴军),Zhu S (朱松),Tang J (汤坚),et al.Analysis of monosaccharide compositions in polysaccharides from D1Salina by pre-column derivatization high performance liquid chromatography.J Instru Anal(分析测试学报),2007,26:206-210.
19 Zhang JJ,Zhang QB,Wang J,et al.Analysis of the monosaccharide composition of fucoidan by precolumn derivation HPLC.Chin J Oceanol Limnol,2009,27:578-582.
20 Yang XB(杨兴斌),Zhao Y(赵燕),Zhou SY(周四元),et al.Analysis of monosaccharide composition in Angelica polysaccharides by pre-column derivatization high performance liquid chromatography.Chin J Anal Chem(分析化学),2005,33:1287-1290.
21 Wang ZW(王泽文),Leng KL(冷凯良),Sun WH(孙伟红),et al.Analysis of monosaccharides and uronic acids in fucoidon from seaweed by pre-column derivatization high performance liquid chromatography.J Anal Sci(分析科学学报),2011,27:26-30.
22 Li HL,Long CN,Zhou J.Rapid analysis of mono-saccharides and oligo-saccharides in hydrolysates of lignocellulosic biomass by HPLC.Biotechnol Lett,2013,35:1405-1409.
23 Xu CL(徐翠莲),Du LR(杜林洳),Fan SF(樊素芳),et al.Progress of polysaccharides extraction,purification and identification methods.Henan Sci(河南科学),2009,27:1524-1529.
24 Zhao JF(赵纪峰),Wang HJ(王海军),Su J(苏晶),et al.Traditional Chinese medicine polysaccharide extraction and separation technology was studied.Chongqing Chin Med Res(重庆中草药研究),2007,1:29-32.
