火棘不可萃取多酚的提取工艺优化及抗氧化研究
2015-01-08许盈芃李楚楚方天润陈西喆鄢又玉
许盈芃 ,刘 顺,李楚楚,方天润,邱 凡,陈西喆,鄢又玉*
1武汉轻工大学生物与制药工程学院,武汉 430023;2 湖北神农蜂语生物产业有限公司,十堰 442000
火棘(Pyracantha fortuneana)是蔷薇科火棘属植物,其果又名将军粮、救军粮、赤阳子、红果等,广泛分布于我国湖南、湖北、陕西及西南诸省。在传统中医中,火棘果常被用于治疗消化不良[1],现代研究发现火棘果提取物可抑制酪氨酸酶活性,减少黑色素的生成,在日本已作为增白剂用于化妆品中[2],然而目前我国对火棘资源的开发不够深入,每年大量的野生火棘资源被白白浪费。
多酚类化合物是指分子结构中有若干酚性羟基的植物成分的总称,包括黄酮类、单宁类、酚酸类以及花色苷类等[3]。植物来源的多酚类化合物具有抗氧化[4]、抗 菌抗病毒[5]、抗肿瘤癌变[6]、抗肥胖[7]、降血糖[8]、降血脂[9]、抗心血管疾病[10]等广泛的生理活性和药理活性。总酚(total polyphenol,TEPP)分为可萃取多酚(EPP)和不可萃取多酚(NEPP)两部分[11]。可萃取多酚主要是指通过简单的有机-水相溶剂萃取就可以获得的处于游离状态的多酚,而不可萃取多酚主要是指结合于细胞壁上的一些水合单宁酸和原花青素类,需通过化学或与细胞壁相关的酶处理,破坏多酚物质与细胞壁结合的化学键,才能将其分离[12]。有研究表明,不可萃取原花青素可用硫酸从残渣中水解而得[13],不可萃取多酚的含量在多种植物资源中远高于可萃取多酚,在抗氧化方面的作用远大于可萃取多酚[14,15],它们在食品、保健尤其是胃肠健康方面具有广阔的应用前景[16]。但目前国内研究主要集中在几种特色资源的可萃取多酚提取及功效研究方面,而不可萃取多酚的研究文献甚少。
本实验重点旨在优化火棘不可萃取多酚的提取工艺,以提取可萃取多酚的火棘果残渣为原料,采用Folin-ciocalteu法测定多酚含量[17],辅 助ABTS法[18]和FRAP 法[19]对不可萃取多酚进行快速抗氧化能力测定。在单因素试验基础上进一步通过Box-Behnken 响应面设计,优化得到NEPP 提取的最优工艺。以期为未来火棘产业化深加工提供理论依据及开发方向。
1 材料与方法
1.1 材料试剂与仪器
火棘果,2014年11月中旬采自湖北恩施来凤地区,经华中科技大学植物学博士杨悦鉴定为全缘火棘Pyracantha atalantioides的果实;无水乙醇、浓H2SO4、无水Na2CO3均为分析纯,上海国药集团化学试剂公司;Folin-ciocalteu 试剂,Sigma 分装,上海北诺生物科技有限公司;没食子酸标准品(中国药品生物制品检定所,批号:110831-201403);总抗氧化能力检测试剂盒(FRAP 法)、总抗氧化能力试剂盒(ABTS 法),江苏省碧云天生物技术研究所;Lambda 25 紫外-可见光分光光度计,美国PE 公司;DF-101B 集热式磁力加热搅拌器,金坛市医疗仪器厂;Centrifuge 5424R 型台式高速冷冻离心机,德国Eppendorf 公司;Molelement1018a 型摩尔超纯水机,上海摩勒科学仪器有限公司;Anke LXJ-Π B 型低速大容量离心机,上海安亭科学仪器厂;BS 系列电子天平,北京赛多利斯仪器系统有限公司;SB5200DTS双频超声波清洗机,宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 没食子酸标准曲线的建立
准确称取0.05 g 没食子酸标准品,加蒸馏水溶解后转移到100 mL 容量瓶中定容,分别取0.5 g/L没食子酸标准溶液2、4、6、8、10、12、14 mL 加入到7个100 mL 容量瓶中,加水定容。各吸取1 mL 置于10 mL 试管中,分别加入Folin-ciocalteu 试剂5 mL,漩涡混匀后静置3 min,再分别加入170 g/L Na2CO3溶液1.0 mL,混匀后置于34 ℃恒温水浴中反应40 min;同时做空白对照,于765 nm 波长处测定吸光度。
1.2.2 火棘EPP 的去除及NEPP 的提取
称取一定量干燥粉碎过20 目筛的火棘果粉,按料液比1∶10 g/mL 加入90%(V/V)乙醇,90 ℃下回流提取1 h,过滤,滤渣重复提取2 次,合并3 次滤液,4 ℃条件下10000 rpm 离心20 min 以待后续EPP 含量测定(因3 次提取后滤液中EPP 含量甚微,可忽略,故前3 次提取合并滤液中EPP 可近似看做原料中总的EPP)。提取后的滤渣置80 ℃烘箱干燥,粉碎,过20 目筛。
去除EPP 的火棘果粉→加入乙醇-硫酸提取溶剂→水浴回流提取→冷水冷却→10000 rpm 离心15 min→上清液中NEPP 含量的测定。
1.2.3 不可萃取多酚得率的测定
采用Folin-Ciocalteu 法测定NEPP 含量:将5 g去EPP 火棘干粉处理得到的各NEPP 提取液统一稀释至180 mL,然后取1 mL 再次稀释80 倍备用,参照1.2.1 同法操作测定NEPP 溶液吸光度,并带入2.1 没食子酸标准曲线关系式中进行相关换算,火棘提取物中NEPP 含量(%)表示为去EPP 火棘干粉中以没食子酸当量的NEPP 的质量百分数。
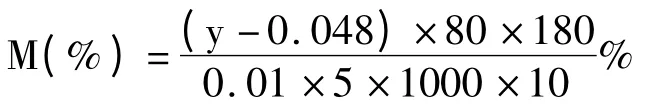
其中y 为NEPP 样品溶液的吸光度。
1.2.4 单因素试验设计
取5.0 g 原料,以乙醇-硫酸为提取溶剂。考察不同乙醇浓度(100%、95%、90%、85%、80%),乙醇-硫酸中乙醇所占比例(100%、95%、90%、85%、80%),料液比(1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30 g/mL),提取时间(1、3、5、7、9 h),水浴温度(30、45、60、75、90 ℃)对NEPP 提取率的影响,结果参见图1。
1.2.5 响应面实验设计
在单因素试验的基础上,固定乙醇-硫酸中乙醇所占比例为95%及料液比1∶20 g/mL,运用Design-Expert 8.0.6 软件,根据Box-Behnken 设计,以乙醇浓度(X1)、提取时间(X2)、提取温度(X3)为主要考察因素,以NEPP 得率为响应值,设计实验如下表1。

表1 Box-Behnken 设计因素水平及编码值Table 1 Factors and levels of Box-Behnken design
1.2.6 抗氧化(ABTS 法及FRAP 法)检测方法的建立
以实验制备的不同浓度的NEPP 溶液为待检样品,分别以Trolox 和FeSO4·7H2O 为标准物,绘制标准曲线。具体操作参见碧云天生物技术研究所提供的总抗氧化能力测定试剂盒(ABTS 快速法及FRAP 法)说明书。取10 mmol/L Trolox 标准溶液用蒸馏水稀释成0.15、0.3、0.6、0.9、1.2 和1.5 mmol/L。在96 孔板每个检测孔中加入20 μL 过氧化物酶工作液。以蒸馏水为空白对照,标准曲线检测孔内加入10 μL 各浓度Trolox 标准溶液,样品检测孔内加入10 μL 各种样品,分别混匀。每个孔内加入170 μL ABTS 工作液,混匀,室温孵育6 min 后在415 nm 进行测定。另外称取27.8 mg FeSO4·7H2O,溶解并用蒸馏水稀释至0.15、0.3、0.6、0.9、1.2 和1.5 mmol/L 。96 孔板的每个检测孔中加入180 μL FRAP 工作液。蒸馏水为空白对照,标准曲线检测孔内加入5 μL 各种浓度的FeSO4标准溶液,样品检测孔内加入5 μL 各种样品,混匀,37 ℃孵育3~5 min 后在595 nm 进行测定。
2 结果与分析
2.1 没食子酸标准曲线的建立
参照1.2.1 设计测定结果,以没食子酸浓度(X,μg/mL)对吸光度(Y)进行线性回归,得回归方程Y=0.010X +0.048(R2=0.9996),吸光度在质量浓度为10~80 μg/mL 间线性关系良好。
2.2 火棘不可萃取多酚提取单因素试验
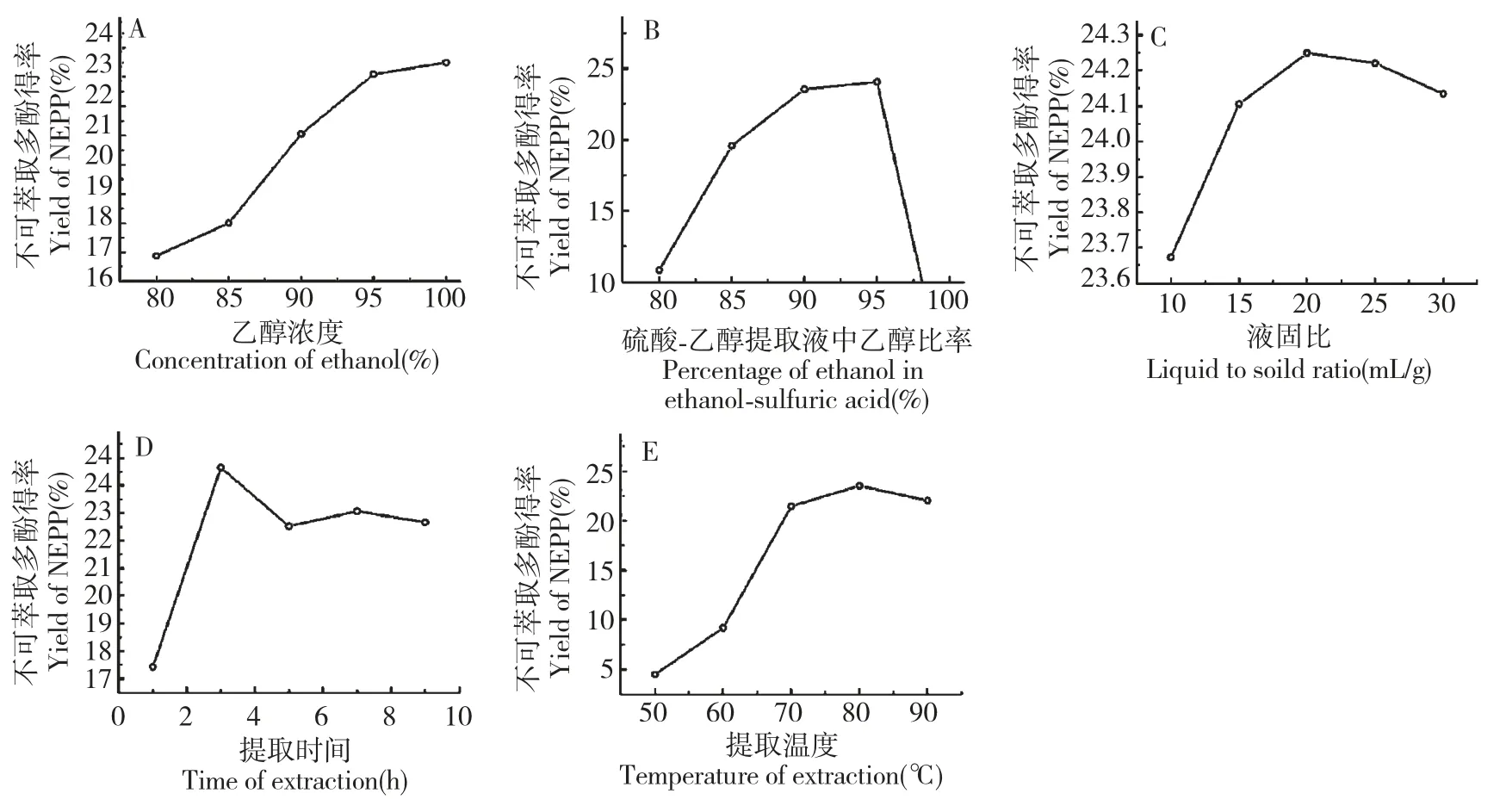
图1 乙醇浓度(A)、乙醇-硫酸中乙醇所占比率(B)、液料比(C)、提取时间(D)及提取温度(E)对火棘不可萃取多酚得率的影响Fig.1 Effect of ethanol concentration (A),proportion of ethanol in ethanol-sulfuric acid (B),liquid to solid ratio (C),extraction time (D)and temperature (E)on NEPP yield of P.fortuneana
由图1(A)可知,提高乙醇浓度有利于NEPP 的提取,当乙醇浓度≥95%后,提取量上升趋势渐缓,另外,出于成本经济考虑,故选择乙醇浓度95%。由图1(B)可知,乙醇-硫酸中乙醇所占比例≥95%之后,NEPP 提取率开始下降,乙醇浓度低于90%后NEPP 得率急剧下降,故乙醇-硫酸中乙醇所占比例选为95%比较合适。由图1 (C)可知,料液比在1∶20 g/mL 时NEPP 的提取率达到极值,继续增大料液比,NEPP 得率略有下降,考虑到不增加后续浓缩工序负担,料液比选为1∶20 g/mL 比较合适。由图1(D)可知,随着提取时间的增加,NEPP 提取率先升后降,提取时间为3 h 时,提取率达到极值,进一步增加提取时间,NEPP 提取率反而下降,这可能与高温强酸条件下,提取出的NEPP 被降解破坏有关,故选择提取时间为3 h。由图1(E)可知,总体上随着温度的升高NEPP 提取率增大,提取温度90 ℃时,提取率最高,温度高于90 ℃之后,提取率反而略有下降,这可能与NEPP 的高温降解有关。故选择提取温度90 ℃左右比较合适。
2.3 火棘不可萃取多酚提取响应面优化实验
2.3.1 响应面实验结果
参照1.2.5 设计,得到实验结果见表2。

表2 Box-Behnken 实验设计及结果Table 2 Box-Benhnken experimental design and the results
以NEPP 得率为主要响应值,将表2 中实验数据经过Design-Expert 8.0.6 软件进行多元回归拟合,得到回归方程:Y=4.40-0.25X1+0.37X2-并对模型进行方差分析,结果见表3。
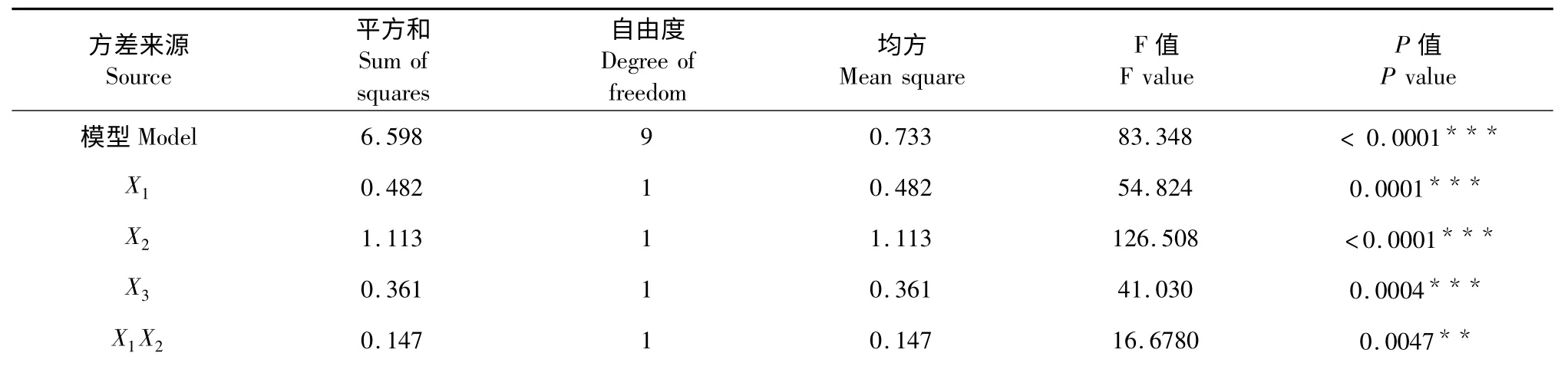
表3 回归方程方差分析Table 3 Variance analysis for each item of regression equation

注:* P <0.05 显著作用;**P <0.01 高度显著作用;***P <0.001 极显著作用。Note:* P <0.05 significant effect;**P <0.01 very significant effect;***P <0.001 extremely significant effect.
由表3 可知,除了X2X3项表明乙醇浓度和温度的交互作用不显著、X1X3项表明时间和温度的交互作用显著外,其他项均为极显著。实验选用的模型(P<0.001)极显著,失拟项(P>0.05)不显著,表明该响应面模型用于优化NEPP 工艺是可行的。信噪比Adeq Precisior=25.386 比较高,说明该模型可以用于预测,而模型校正判定系数,说明该模型能解释97.89%的响应值变化。判定系数R2=0.990 8,说明模型拟合程度良好,可以使用该模型分析和预测火棘NEPP 的提取率0 与R2=0.990 8 的值相差不大说明该响应面方程无需做进一步优化。
2.3.2 NEPP 提取工艺响应面图分析与对比
根据2.3.1 所得回归方程,考察拟合响应面的形状,绘制响应面立体分析图及相应的等高线图,结果见图2。各影响因素及交互作用对响应值的影响可通过图2 中响应面图曲面陡峭程度和等高线图中等高线密集程度直观地反映出来。由图2(A)可知,乙醇浓度效应面相对更陡,等高线相对更密集。因此乙醇浓度的影响更为显著,随着乙醇浓度增加,NEPP 得率先增后减;提取时间的影响次之;由图2(B)可知,提取时间效应面相对更陡,等高线相对更密集。因此提取时间的影响更为显著,随着提取时间增加,NEPP 得率先增后减;提取温度的影响次之;由图2(C)可知,乙醇浓度效应面相对更陡,等高线相对更密集。因此乙醇浓度的影响更为显著,随着乙醇浓度增加,NEPP 提取率先增后减;提取时间的影响次之;NEPP 提取率随乙醇浓度的增大而增大;提取温度的影响对比前2 个因素相对较弱但仍十分显著,NEPP 提取率随提取温度的升高先升后降。从图6(a-c)可以看出,响应面的最高点和等高线在所选的范围内存在极值,响应面的最高点同时也是等高线中的最小椭圆的中心点[20]。等高线均成椭圆形说明各因素的交互作用强,也即3 个因素取不同的编码值对Y 的影响表现出不同的规律,对火棘NEPP 提取率的影响显著[21],这一结论也与表3 方差分析结果一致。
2.3.3 最优提取工艺验证
在节约成本同时使NEPP 提取率尽可能高的前提下,通过响应面模型及其软件优化得到的最佳工艺条件为:提取时间2.68 h,乙醇浓度94.44%,水浴温度83.47 ℃,此时NEPP 提取率最大理论值为4.49989%。为检验该模型的可靠性,按照上述最优方案进行3 组平行实验。实际提取条件:提取时间2.7 h,乙醇浓度95%,水浴温度83 ℃,对3 组结果取平均值,所得NEPP 提取率为4.4294%,实际值与预测值接近。可见此模型可靠,可用于优化火棘不可萃取多酚提取工艺。
2.4 NEPP 抗氧化量效关系分析
参照1.2.6 实验设计测定相关结果后,以Trolox 标准溶液浓度(X,mmol/L)对吸光度(Y)进行线性回归,得回归方程Y=-0.000 4X+0.587 1(R2=0.9998),吸光度在质量浓度为100~1300 μg/mL 间线性关系良好。以FeSO4标准溶液浓度(X,mmol/L)对吸光度(Y)进行线性回归,得回归方程Y=0.1006 X+0.002 4(R2=0.9994)。吸光度在质量浓度为150~1500 μg/mL 间线性关系良好。

图2 乙醇浓度和提取时间(A)、提取温度和提取时间(B)及提取温度和乙醇浓度(C)对火棘不可萃取多酚得率影响的响应面及等高线图Fig.2 Response surface plots and contour plots showing the mutual effects of ethanol concentration and extraction time (A),extraction temperature and extraction time (B)as well as extraction temperature and ethanol concentration (C)on the extraction yield of NEPP from P.fortuneana
本实验主要研究任务是对火棘中不可萃取多酚的提取工艺进行优化,在优化的同时兼测提取液总抗氧化能力的变化。由表2 中17 组实验设计,我们分别测得NEPP 溶液吸光度并推算出其相应质量浓度,ABTS 及FARP 总抗氧化吸光度响应值,以NEPP浓度(x,mg/mL)分别对ABTS 及FARP 响应值(y)进行线性拟合,结果参见图3,分别得回归方程y1=5.10196x+0.44512(R2=0.8907),y2=2.31721x +0.24157(R2=0.8505)。分析可知NEPP 浓度与ABTS 及FRAP 总抗氧化能力呈现正相关,相关性良好。
2.5 火棘EPP 及NEPP 含量的测定
按1.2.2 设计提取火棘EPP,重复3 组,每组重复提取3 次合并,按Folin-Ciocalteu 法测定吸光度,并带入2.1 没食子酸标准曲线计算出提取液中EPP质量浓度(μg/mL),根据提取液体积及提取物料质量,3 次结果取平均值,可得火棘中EPP 含量为40.4 mg/g;按2.3.3 响应面最优提取方案提取3 组,同法算出火棘中NEPP 含量167.328 mg/g,因为NEPP提取时溶剂中加入强酸,一次提取时强酸对植物细胞壁的破坏就相当彻底,因此一次提取的NEPP 量可近似看做火棘果皮肉粉中NEPP 总量。显然,通过计算可知,NEPP 占TPP 总量的80.55%,占火棘总酚的绝大部分,从而进一步证明优化NEPP 的提取工艺相当重要。

图3 不可萃取多酚浓度与抗氧化能力相关性分析Fig.3 Correlation analysis of NEPP and its antioxidant capacity
3 结论
通过单因素试验确定提取工艺中最适乙醇浓度为95%,提取时间3 h,乙醇-硫酸中乙醇所占比例为95%,料液比为1∶20(质量浓度,g/mL),提取温度95 ℃。进一步应用响应面软件建立优化方案,模型显著,最佳提取工艺条件为:提取时间2.68 h,乙醇浓度94.44%,温度83.47 ℃。此时,NEPP 提取量可达167.328 mg/g,EPP 提取量仅为40.4 mg/g,NEPP占TEPP 含量的80.55%,约为EPP 含量的四倍。
同时对NEPP 与抗氧化能力进行了相关性分析,结果表明NEPP 浓度与ABTS 及FRAP 抗氧化能力之间均存在良好的正相关关系,但相关性并非特别显著,这可能是由于火棘中还含有其它具有抗氧化能力的成分,或是不同种类的不可萃取多酚的抗氧化能力不一而造成的,而且同一种多酚类物质对超氧自由基和羟自由基的清除率也是不同的,这可能与它们的结构有关[22]。因此未来我们应该进一步深入研究火棘总酚的分类、结构及其与抗氧化功效或其他功效之间的关系,以期推动火棘资源产业化。
1 Deng RF (邓如福),Wang SG (王三根),Li GR (李关荣).Studies on the nutritional components of the fruit of the wild plant-firethorn.Acta Nutr Sin(营养学报),1990,1:79-84.
2 Van Gelder CWG,Flurkey WH,Wichers HJ.Sequence and structural features of plant and fungal tyrosinases.Phytochemistry,1997,45:1309-1323.
3 Yong JW,Zhong C,Jian WM,et al.Optimization of ultrasonic-assisted extraction process ofPoria cocospolysaccharides by response surface methodology.Carbohydr Polym,2009,77:713-717.
4 Pandey KB,Rizvi SI.Plant polyphenols as dietary antioxidants in human health and disease.Oxid Med Cell Longev,2009,2:270-278.
5 Jia Q,Liu X,Wu X,et al.Hypoglycemic activity of a polyphenolic oligomer-rich extract ofCinnamomum parthenoxylonbark in normal and streptozotocin-induced diabetic rats.Phytomedicine,2009,16:744-750.
6 Cai Y,Luo Q,Sun M,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer.Life Sci,2004,74:2157-2184.
7 Jadeja RN,Thounaojam MC,Ramani UV,et al.Anti-obesity potential ofClerodendron glandulosum.Coleb leaf aqueous extract.J Ethnopharmacol,2011,135:338-343.
8 Anderson RA,Broadhurst CL,Polansky MM,et al.Isolation and characterization of polyphenol type-A polymers from cinnamon with insulin-like biological activity.J Agric Food Chem,2004,52:65-70.
9 Saliu JA,Ademiluyi AO,Akinyemi AJ,et al.In vitroantidiabetes and antihypertension properties of phenolic extracts from bitter leaf (Vernonia amygdalinaDel.).J Food Biochem,2012,36:569-576.
10 Furuuchi R,Sakai H,Hirokawa N,et al.Antihypertensive effect of boysenberry seed polyphenols on spontaneously hypertensive rats and identification of orally absorbable proanthocyanidins with vasorelaxant activity.Biosci Biotechnol Biochem,2012,76:1694-1701.
11 Saura-Calixto F,Serrano J,Goñi I.Intake and bioaccessibility of total polyphenols in a whole diet.Food Chem,2007,101:492-501.
12 Arranz S,Saura-Calixto F,Shaha S,et al.High contents of nonextractable polyphenols in fruits suggest that polyphenol contents of plant foods have been underestimated.J Agric Food Chem,2009,57:7298-7303.
13 Matthews S,Mila I,Scalbert A,et al.Extractable and non-extractable proanthocyanidins in barks.Phytochemistry,1997,45:405-410.
14 Madhujith T,Shahidi F.Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics.Food Chem,2009,117:615-620.
15 Chandrasekara A,Shahidi F.Content of insoluble bound phenolics in millets and their contribution to antioxidant capacity.J Agric Food Chem,2010,58:6706-6714.
16 Pérez-Jiménez J,Díaz-Rubio ME,Saura-Calixto F.Non-extractable polyphenols,a major dietary antioxidant:occurrence,metabolic fate and health effects.Nutr Res,2013,26:118-129.
17 Slinkard K,Singleton VL.Total phenol analysis:automation and comparison with manual methods.Am J Enol Viticult,1977,28:49-55.
18 Lu G (卢弓),Li GY(李光勇),Wei JF(魏金凤),et al.Establishment of micro-model for scavenging ABTS Free Radical.Nat Prod Res Dev(天然产物研究与开发),2013,25:1533-1535.
19 Benzie IFF,Strain JJ.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay.Anal Biochem,1996,1:70-76.
20 Huang Q(黄群),Yang WG(杨万根),Yu J(余佶),et al.Process optimization for antioxidant peptide preparation fromEucommiaseed meal protein by enzymatic hydrolysis.Food Sci(食品科学),2013,34:205-209.
21 Xu X,Gao Y,Liu G,et al.Optimization of supercritical carbon dioxide extraction of sea buckthorn (Hippophae thamnoidesL.)oil using response surface methodology.LWTFood Sci Technol,2008,41:1223-1231.
22 Li W(李伟),Zhang YT (张应团).The antioxidation effect ofPyracantha fortuneanapolyphenolin vitro.Sci Tech Food Ind(食品工业科技),2008,29:121-123.
