不同激素配比对半支莲细胞生长与甜菜红素积累及抗氧化酶活性的影响
2015-01-08王玉娇管恒洁
赵 胡,王玉娇,管恒洁,刘 雪
阜阳师范学院生物与食品工程学院,阜阳 236037
甜菜素是一种含氮类吡啶衍生物水溶性色素,因最早在甜菜根中发现而得名,包括甜菜红素(betacyanin)和甜菜黄素(betaxanthin)2 种形式[1]。尤其是甜菜红素不仅作为传统意义上食品添加剂的成分,而且作为重要的植物次生代谢物质在离体条件下具有很强的抗氧化和清除氧自由基能力,可以用来治疗与过氧化胁迫有关的人体机能失调和抑制癌细胞增殖的功效[2,3]。因此,甜菜素的医用价值最近几年引起了人们的广泛关注。
半支莲(Portulaca grandifloraHook)系马齿苋科马齿苋属一年生草本植物,因含丰富的甜菜红素化合物,全草均可入药,有清热解毒、消肿止痛、活血化瘀的功效[4]。鉴于甜菜红素药用成分的特殊功效和在人们日常生活中的广泛应用,发展甜菜红素特有野生植物种植与开发,社会及经济效益均极其显著。近年来,随着对甜菜红素研究的不断深入,国内外需求量显著增加。但由于从野生植物资源中提取甜菜红素,不仅受植物生长条件和季节的限制,而且提取量并不能满足市场的供应需求。植物细胞培养技术生产次生代谢物克服植物受地理、季节等各种环境因素的影响,保证产物在一个限定系统中连续、均匀生产,有效地提高了人们获取植物次生代谢产物范围和生产规模。利用植物细胞生产有益人类需求的植物次生代谢物已受到人们广泛的关注并已成功应用到多种药用植物天然活性成分的生产[5]。国内外有关对半支莲的研究主要集中在组织培养及再生体系建立,关于半支莲细胞培养及甜菜红素产物含量的报道还比较少见[4,6]。本试验就不同植物激素配比对半支莲细胞生长和甜菜红素含量的影响进行了研究,并从细胞抗氧化酶系统方面对不同激素配比对甜菜红素形成差异的成因进行初步分析和探讨,为进一步用植物细胞培养技术生产甜菜红素及研究甜菜红素在植物细胞内的代谢调节机制提供基础数据资料。
1 材料与方法
1.1 材料
半支莲种子购自阜阳市花卉市场,在实验室盆栽一个月后,以幼嫩的带紫红色茎段为外植体经0.1%升汞消毒、无菌水清洗后接种到MS +2,4-D(2.0 mg/L)培养基中,在25 ± 1 ℃光照下培养,光照强度为25 μmol/m2/s,光周期(白天/黑暗)为16 h/8h,培养15 d,诱导半支莲愈伤细胞备用。
1.2 实验设计
采用由不同激素配比类型的MS 固体培养基对半支莲愈伤细胞进行培养以期筛选细胞生长量最大和甜菜红素产量最高的激素配比类型培养基。半支莲细胞培养基激素配比设计是以固定细胞分裂素的浓度为1.0 mg/L,生长素浓度分别为0.5 mg/L 和1.0 mg/L 为基础,筛选两种类型细胞分裂素(6-BA,KT)和三种类型生长素(NAA、IAA 和2,4-D)配比对细胞生长量和细胞色素表型的影响。确定生长素类型对细胞色素表型影响以后,进一步地细化浓度分别为0.1、0.5 mg/L 和1.0 mg/L 的不同细胞分裂素(6-BA,KT)对半支莲细胞生长量和甜菜红素含量的影响。
1.3 试验方法与测试指标
在无菌操作室里,精确称取色泽鲜嫩一致的半支莲愈伤细胞1.00 ±0.01 g,分别接种于不同激素配比的MS 固体培养基中,重复三瓶,培养温度与光照条件同上,培养期30 d。
1.3.1 愈伤细胞干重测定
取不同激素配比MS 固体培养基培养30 d 的愈伤细胞和原初接种半支莲愈伤细胞1.00 ±0.01 g各3 份,滤纸吸去细胞中过多的水分后用铝箔纸包裹细胞置于80 ℃干燥箱中烘干至恒重,称其重量为干重。细胞增长量为:培养30 d 后细胞干重-原初接种半支莲愈伤细胞干重。
1.3.2 甜菜红素提取及含量测定
甜菜红素提取及含量测定参照文献方法并做修改[7]。具体做法:称取1 g 新鲜半支莲细胞加入20 mL 甲醇研磨,破碎细胞释放出色素。10000 g 离心10 min,弃上清,沉淀细胞碎片用20 mL 去离子水浸提30 min,10000 g 离心10 min,沉淀再次用去离子水浸提,离心,直到细胞色素抽提殆尽,定容后,在538 nm 处分光光度计测定甜菜红素的光吸收值,以上操作均在0~4 ℃下进行。根据甜菜红素的摩尔消光系数56,600 L/cm/mol 计算甜菜红素浓度及细胞中甜菜红素含量。
细胞中甜菜红素的含量为:
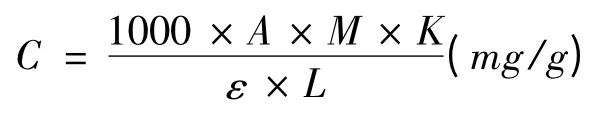
式中,A为吸光值;M为甜菜红素平均分子量,K为稀释倍数,ε 为甜菜红素的摩尔消光系数;L为比色皿的口径。
1.3.3 酶液提取
分别取不同激素配比培养下的半支莲细胞1.00 ±0.01 g,按W∶V=1∶5 加入50 mmol/L pH 为7.8 的含有4 g/L 不溶性聚乙烯吡咯烷酮PVP 的磷酸缓冲液(PBS),加少许石英砂于冰浴中研磨成浆,用10000 g 于4 ℃离心10 min,弃沉淀,上清液即为酶提取液,待测。蛋白含量测定,按照Bradford 的方法测定[8],采用考马斯亮蓝G250 法于595 nm 波长测定光吸收值,根据绘制的标准曲线换算可溶性蛋白含量。
1.3.4 超氧化物歧化酶(SOD)活性测定
采用氯化硝基四氮唑蓝(NBT)光化学还原法测定,参照文献方法[9]。当光照时体系中产生氧自由基能还原NBT 形成蓝色物质,在波长为560 nm 处测定消光值,以抑制光还原NBT 50%为1 个酶活性单位,酶活性以每毫克蛋白含酶量计算。
1.3.5 过氧化物酶(POD)和过氧化氢酶(CAT)活性测定
参照文献方法进行[10]。当反应体系存在H2O2,POD 能使愈创木酚氧化,生成茶褐色物质,该物质在470 nm 处有最大光吸收值,以每分钟内吸光值变化为0.01 为1 个酶活性单位。H2O2在240 nm处有最大光吸收值,过氧化氢酶能分解H2O2,使反应溶液吸光值随反应时间而降低,根据测量吸光值的变化速率即可测出H2O2的活性。
1.3.6 数据处理
采用Microsoft Excel 2007 和SPSS19.0 相结合,对不同激素配比处理数据进行LSR-单因素最小显著性差异分析(ANOVA),比较各处理之间差异显著性,数据以平均值 ± 标准误表示。
2 结果与分析
2.1 不同激素配比对半支莲细胞生长量的影响
对在不同激素配比的MS 固体培养基上生长30 d 的半支莲细胞生长量进行比较如图1,结果表明:不同种类、不同剂量激素配比对半支莲细胞生长量差异显著。在相同细胞分裂素浓度下添加2,4-D 对细胞的增长量显著高于NAA 和IAA。其中当向培养基中添加浓度均为1.0 mg/L 的2,4-D 和6-BA时,细胞的生长量最大,细胞干重达332.68 mg 分别是相同浓度下NAA 和IAA 处理下细胞干重的21.0倍和4.3 倍。当培养基中细胞分裂素为6-BA 时,NAA 和IAA 2 种生长素低浓度组(0.5 mg/L)处理对细胞生长量高于高浓度组(1.0 mg/L)处理;而1.0 mg/L 2,4-D 处理对细胞生长量高于0.5 mg/L浓度组处理,如在6-BA 或KT 为1.0 mg/L 时,1.0 mg/L 2,4-D 处理对细胞生长量分别比0.5 mg/L 浓度组处理高44.1%或47.1%。总体来看,2,4-D 处理下半支莲细胞生长量高于NAA 和IAA 处理;而在相同浓度2,4-D 存在条件下,向培养基中添加6-BA 对半支莲细胞生长效果要好于KT。
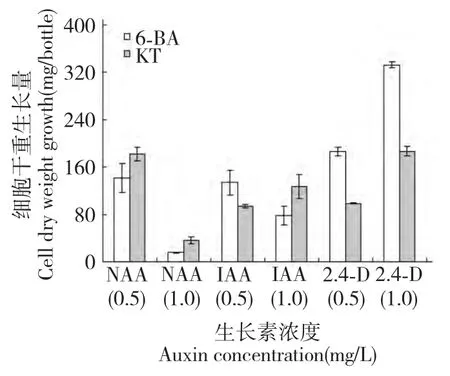
图1 生长素对培养30 d 半支莲细胞生长的影响Fig.1 Effect of auxins on 30 days-cultured P.grandiflora cell growth
2.2 不同激素配比对半支莲细胞表型的影响
不同激素配比下半支莲细胞色素表型差异见图2。由图2 可知,不同生长素类型及剂量对半支莲细胞色素表型的影响差异显著。在6-BA 为1.0 mg/L,向培养基中添加NAA,细胞没有甜菜红素产生,细胞生长缓慢,表型暗褐色,生长质量较差(图2A)。从图2B 和2C 可以看出如用2,4-D 代替NAA,细胞不仅生长质量大大改善,而且细胞也产生甜菜红素,并随着2,4-D 浓度的增加(图2B 和2C 2,4-D 浓度分别为0.5 mg/L 和1.0 mg/L)细胞色素加深,表明2,4-D 显著促进细胞产生甜菜红素。
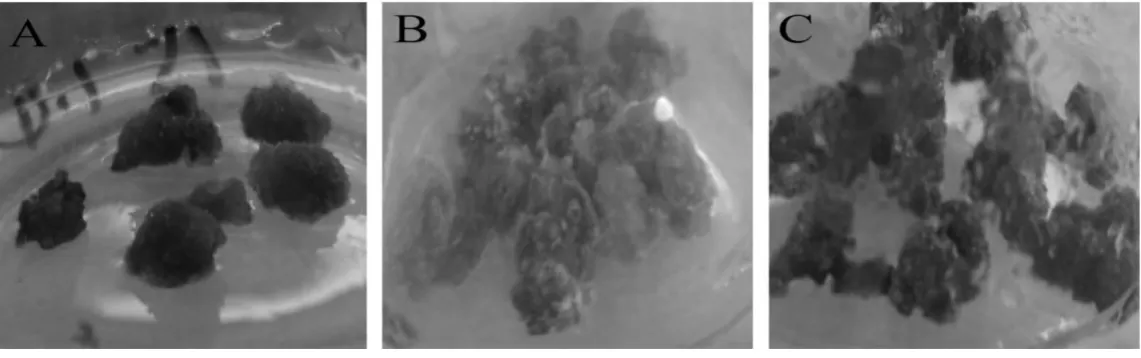
图2 不同生长素对半支莲细胞表型的影响Fig.2 Effect of different auxins on P.grandiflora cell phenotype
2.3 2,4-D 与不同浓度细胞分裂素配比对半支莲细胞生长量的影响
由于2,4-D 对半支莲细胞甜菜红素的产生具有显著地促进作用,进一步地实验需要通过细化不同浓度细胞分裂素与2,4-D 结合筛选半支莲细胞生长量最大的激素浓度组合,以期在细胞生产甜菜红素的前提下进一步地筛选细胞生长量最大激素配比浓度。对在2 种2,4-D 浓度下3 种不同浓度的6-BA和KT 对培养30 d 半支莲细胞生长量的影响见图3。由图可知,在2,4-D 浓度为1.0 mg/L、6-BA 浓度为0.5 mg/L 细胞生长量最大为465.50 mg,在此浓度下细胞生长量分别比6-BA 浓度为0.1 mg/L 和1.0 mg/L 高22.4%和28.5%,而KT 在各浓度组间对细胞生长量差异不显著且低于6-BA 处理的细胞生长量。这一结果表明,在半支莲细胞产生甜菜红素的前体下,细胞生长量最大的激素配比为2,4-D浓度为1.0 mg/L 和6-BA 浓度为0.5 mg/L 激素组合。
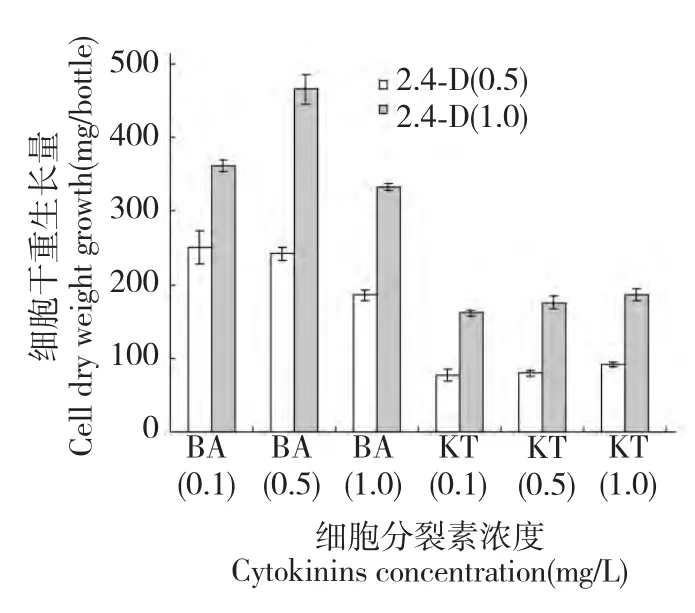
图3 细胞分裂素对培养30 天半支莲细胞生长的影响Fig.3 Effect of cytokinins on 30 days-cultured P.grandiflora cell growth
2.4 2,4-D 与不同浓度细胞分裂素配比对半支莲细胞甜菜红素含量的影响
2,4-D 与不同浓度细胞分裂素配比对培养30 d半支莲细胞甜菜红素含量的差异见图4。由图可知,与细胞生长量对2,4-D 与不同浓度细胞分裂素配比作用效应类似,在2,4-D 浓度为1.0 mg/L、6-BA 浓度为0.5 mg/L 细胞甜菜红素含量最高达75.12 mg/g,在此浓度下细胞甜菜红素含量比6-BA浓度1.0 mg/L 高24.8%,而与6-BA 浓度0.1 mg/L细胞甜菜红素含量差异不显著,暗示较高浓度的6-BA 不仅抑制细胞生长而且也降低细胞中甜菜红素含量。而KT 在各浓度组间对细胞甜菜红素含量差异不显著且低于6-BA 处理下的细胞甜菜红素含量。这一结果表明,半支莲细胞甜菜红素含量与细胞生长量对最适激素配比相吻合,细胞甜菜红素最高的激素配比亦为2,4-D 浓度为1.0 mg/L 和6-BA浓度为0.5 mg/L 激素组合。
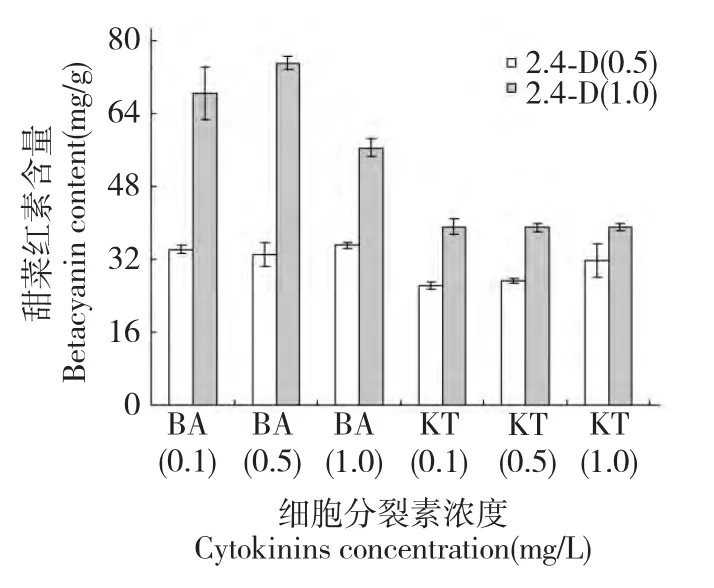
图4 细胞分裂素对培养30 d 半支莲细胞甜菜红素含量的影响Fig.4 Effect of cytokinins on betacyanin content of 30 dayscultured P.grandiflora cell
2.5 不同激素配比对半支莲细胞抗氧化酶活性的影响
根据上述的研究结果发现向培养基中添加生长素NAA 或IAA,半支莲细胞不产生甜菜红素,而添加生长素2,4-D 细胞开始变红,且随着2,4-D 浓度增加,细胞色泽越红,表明2,4-D 对半支莲细胞甜菜红素合成的促进效应。为进一步地探讨不同激素配比对半支莲甜菜红素合成差异的成因,本实验测定了不同激素配比对培养30 d 半支莲细胞参与活性氧代谢的抗氧化酶活性影响,以期分析活性氧代谢是否介导了半支莲细胞甜菜红素合成调控作用。由表1 可知,不同激素配比对半支莲细胞抗氧化酶活性的影响差异显著,当向培养基中添加抑制甜菜红素合成生长素NAA 或IAA 时,SOD、POD 和CAT 的活性最低,而向培养基中添加浓度为1.0 mg/L 2,4-D时SOD、POD 和CAT 的活性最高,向培养基中添加浓度为0.5 mg/L 2,4-D 时SOD、POD 和CAT 的活性介于两者之间。如在MS 培养基中2,4-D 为1.0 mg/L 和6-BA 为0.5 mg/L 激素组合培养的半支莲细胞SOD、POD 和CAT 的活性分别是NAA 为0.5 mg/L 和6-BA 为1.0 mg/L 激素组合培养的半支莲细胞相应酶活性的2.7 倍、3.1 倍和2.4 倍;比2,4-D 为0.5 mg/L 和6-BA 为0.5 mg/L 激素组合培养的半支莲细胞相应酶活性高20.6%、30.8%和34.7%。这一结果表明,甜菜红素激素诱导培养基上生长半支莲细胞抗氧化酶活性显著地高于不产色素的激素配比培养基上生长的半支莲细胞。
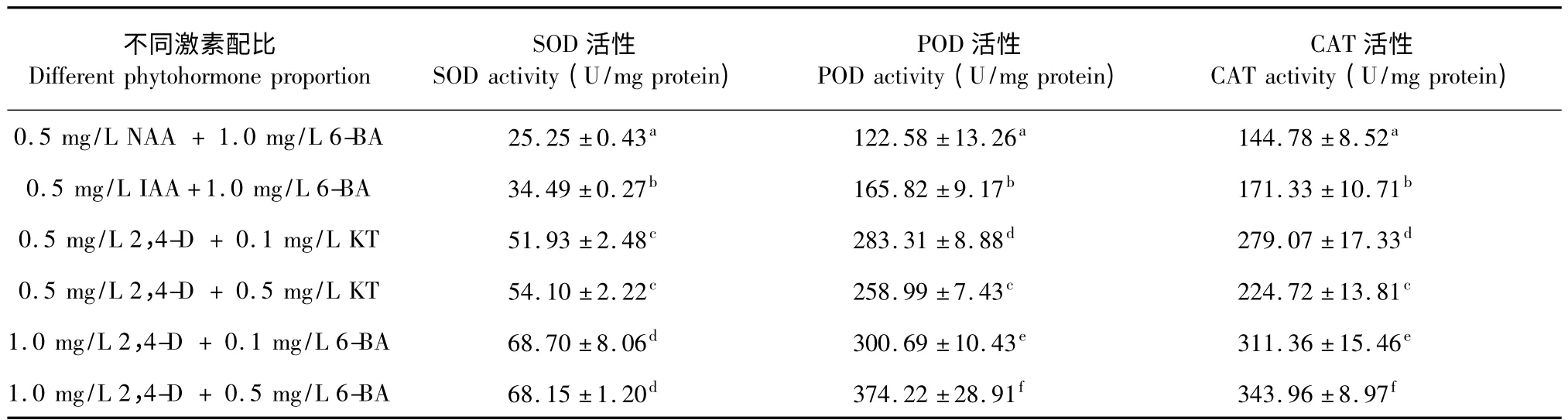
表1 不同激素配比对培养30 d 半支莲细胞抗氧化酶活性的影响Table 1 Effect of different phytohormone proportion on antioxidant enzyme activities of 30 days-cultured P.grandiflora cell
3 讨论
激素配比是影响植物细胞生长量或生长速率的一个重要因素。在植物细胞培养中,一般生长素在低浓度时能够诱导细胞分裂,促进细胞伸长生长,浓度较高则会抑制生长,高浓度甚至会使植物受伤;细胞分裂素主要作用是促进细胞分裂。另外,细胞的生长状况不仅受激素浓度的影响,还与激素种类有关。从本文的研究结果来看,2,4-D 促进半支莲细胞的生长效果比NAA 和IAA 好,不仅表现在细胞的生长量高,而且细胞生长状态也优于后两种激素。生长素2,4-D 与细胞分裂素6-BA 搭配对促进半支莲细胞的分裂效果要优于2,4-D 与KT 结合。许金光等[11](2007)发现在MS 培养基上生长素NAA 和细胞分裂素KT 各为3.0 mg/L 和0.1 mg/L 激素组合对三尖杉细胞生长量高于其他激素组合处理;而阮氏钏等[12](2015)研究不同激素配方对青钱柳细胞干物质量增加的影响,结果表明,在MS 培养基上NAA 1.0 mg/L 和KT 0.5 mg/L 激素组合最有利于细胞干重的增加。由此可见,细胞生长量积累所依赖的激素配比与物种紧密相关。
本文研究结果还发现,2,4-D 不仅具有促进半支莲细胞生长的效果,而且作为诱导激素能明显刺激细胞合成甜菜红素,调控半支莲细胞合成色素的最佳激素配比与细胞生长量的最佳激素组合相同,亦为2,4-D 1.0 mg/L 和6-BA 0.5 mg/L 激素组合,反应了半支莲细胞生长与甜菜红素的合成具有同步一致性,可能属于细胞生长偶联型的次生代谢模型。植物激素的种类与浓度及其配比方式不仅影响细胞生长,而且对细胞中次生代谢物积累也具有重要的调节作用。2,4-D 对瑞香狼毒细胞黄酮的积累是有利的[13],而对紫草细胞中紫草宁的合成具有严重的抑制作用[14]。由此可看出,不同植物激素对不同植物细胞次生代谢产物的积累有明显的差异。在本试验中发现,2,4-D 是最主要的影响因素,较高浓度的2,4-D 对半支莲细胞的生长和甜菜红素的积累都是有利的;而NAA 和IAA 对细胞生长和色素的积累不利。
为进一步地分析不同激素配比对半支莲细胞甜菜红素合成差异成因,本试验初步分析不同激素配比对培养30 d 半支莲细胞参与活性氧代谢的3 种抗氧化酶活性的差异,研究结果表明SOD、POD 和CAT 3 种酶活性与相应激素配比下的细胞中甜菜红素的含量高度相关。2,4-D 为半支莲细胞培养中甜菜红素合成的诱导激素,向培养基中添加2,4-D 后,SOD、POD 和CAT 3 种酶活性显著高于向培养基添加NAA 的3 种酶活性。SOD、POD 和CAT 活性提高表明细胞中和H2O2等活性氧代谢活跃,暗示活性氧可能参与了半支莲细胞中甜菜红素生物合成的调控。大量文献报道和H2O2等活性氧分子参与植物的次生代谢调控,如参与黑曲霉诱导子对长春花细胞吲哚生物碱合成的促进作用[15]。Wang 等[16](2007)发现盐地碱蓬根系在受到氧化胁迫时H2O2含量升高,H2O2作为信号分子转运到叶片,导致叶片甜菜红素含量增加。Gandía-Herrero 和Francisco García-Carmona[17](2013)认为多巴双加氧酶是甜菜红素生物合成途径中关键限速酶,该酶催化将酪氨酸在酪氨酸酶羟化作用下形成的环状多巴转化为开环多巴,随后自发反应生成甜菜红素的基本生色团—甜菜醛氨酸。Casique-Arroyo 等[18](2014)研究发现各种生物或非生物胁迫引起多巴双加氧酶基因表达上调进而导致千穗谷(Amaranthus hypochondriacusL)中甜菜红素大量合成,推测可能的机制是各种环境胁迫引起H2O2含量上升,H2O2作为信号分子促进该酶基因表达引起甜菜红素的积累。Wu 等[19](2004)研究经紫外线照射后的红豆杉细胞后细胞中紫杉醇和H2O2含量增加,并进一步地发现H2O2通过提高细胞内源另一种植物激素茉莉酸(JA)合成途径中关键酶基因脂氧合酶(LOX)基因的表达提高JA 的含量,JA 作为植物次生代谢产物合成正调控激素从而促进了细胞中紫杉醇的合成。从本试验的研究结果来看,在含2,4-D 培养基中半支莲细胞活性氧代谢活跃,甜菜红素大量合成,表明细胞内产生的H2O2可能参与了半支莲细胞甜菜红素的合成,相关的H2O2调控半支莲甜菜红素合成途径的研究目前正在进行。
1 Wang CQ (王长泉),Liu T (刘涛),Wang BS (王宝山).Advances in betalain research in higher plants.Chin Bull Bot(植物学通报),2006,23:302-311.
2 Taira J,Tsuchida E,Katoh MC,et al.Antioxidant capacity of betacyanins as radical scavengers for peroxyl radical and nitric oxide.Food Chem,2015,166:531-536.
3 Khan MI,Sri Harsha PSC,Giridhar P,et al.Pigment identification,nutritional composition,bioactivity,and in vitro cancer cell cytotoxicity ofRivina humilisL.berries,potential source of betalains.LWT -Food Sci Tech,2012,47:315-323.
4 Zhang HQ (张洪清).Regeneration and genetic transformation ofPortulaca grandiflora.Harbin:Harbin Normal University (哈尔滨师范大学),MSc.2009.
5 Qi FH (齐凤慧),Zhan YG (詹亚光),Jing TZ (景天忠).A review on elicitors and their regulation on secondary metabolites in plant cell culture.Nat Prot Res Dev(天然产物研究与开发),2008,20:568-573.
6 Jain AK,Bashir M.In-vitropropagation of a medicinal plantPortulaca grandiflora.Hook.World J Agric Sci,2010,6:327-330.
7 Nakashima T,Araki T,Ueno O.Photoprotective function of betacyanin in leaves ofAmaranthus cruentusL.under water stress.Photosynthetica,2011,49:497-506.
8 Bradford MM.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem,1976,72:248-254.
9 Beaucham C,Fridovic I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels.Anal Biochem,1971,44:276-287.
10 Chance B,Machly AC.Assay of catalase and peroxidase.Colowick SP,Kaplan NO.Methods in Enzymology.NewYork:Academic Press,1955,764-775.
11 Xu JG (许金光),Liu CJ (刘长江).Effect of different explants and medium composition on callus growth ofCephalotaxus fortuneiHook.f.Nat Prot Res Dev(天然产物研究与开发),2007,19:461-464.
12 Ruan SC (阮氏钏),Yang WX (杨万霞),Fang SZ (方升佐),et al.Influence of types of basic medium,hormone formulations on accumulation of secondary metabolites inCyclocarya paliurussuspension cells.J Nanjing Forest Univ(南京林业大学学报),2015,39(2):47-51.
13 Wang WX (王文星),An Q (安琪),Wang Y (汪莹),et al.A study on cell suspension culture and flavonoids accumulation ofStellera chamaejasme.Acta Prataculturae Sin(草业学报),2010,19:132-139.
14 Yazaki K,Matsuoka H,Ujihara T,et al.Shikonin biosynthesis inLithospermum erythrorhizon:light-induced negative regulation of secondary metabolism.Plant Biotech,1999,16:335-342.
15 Zhang XF (张向飞),Zhang RT (张荣涛),Wang NN (王宁宁),et al.Effects of fungal elicitors on accumulation of indole alkaloids inCatharanthus roseuscalli.Chin Tradit Herb Drugs(中草药),2004,35:201-204.
16 Wang CH,Chen M,Wang BS.Betacyanin accumulation in the leaves of C3halophyteSuaeda salsaL.is induced by watering roots with H2O2.Plant Sci,2007,172:1-7.
17 Gandía-Herrero F,García-Carmona F.Biosynthesis of betalains:yellow and violet plant pigments.Cell,2013,18:334-343.
18 Casique-Arroyo G,Martínez-Gallardo N,de la Vara LG,et al.Betacyanin biosynthetic genes and enzymes are differentially induced by (a)biotic stress inAmaranthus hypochondriacus.Plos One,2014,9:99012.
19 Wu J,Ge X.Oxidative burst,jasmonic acid biosynthesis,and taxol production induced by low-energy ultrasound inTaxus chinensiscell suspension cultures.Biotech Bioeng,2004,85:714-721.
