锡尾矿真菌的次生代谢产物研究
2015-01-08李铭刚
郭 健,李铭刚,董 媛,徐 伟,李 艳*
1吉林医药学院,吉林 132013;2 云南大学云南省微生物研究所,昆明 650091
特殊环境下生长的微生物与环境经长期的相互作用,可能产生具有特殊结构和生理意义的次生代谢产物。特殊生境微生物一直是近年来微生物领域研究的热点。特殊生境微生物的天然产物为新药的筛选和新型先导化合物的发现提供了大量的研究材料。菌株P-20 分离自云南省锡业股份有限公司下的锡尾矿土样,该矿坝土壤样品经电感耦合等离子体原子发射光谱仪(ICP-AES)测定,其金属质量分数为:铁14.64% ﹑锡0.29% ﹑铅0.044% ﹑砷0.18%、铜0.12%,pH 值8.64,是重金属污染的弱碱性环境,同时也是“人造”特殊环境[1]。P-20 的液体发酵提取物在薄层层析(TLC)板上呈现出较丰富的化学条带。本实验从其发酵提取物中分离出14个化合物。根据理化性质和波谱分析,分别鉴定为:司他弗林(1)、布雷非德菌素E (2)、布雷非德菌素H (3)、布雷非德菌素D(4)、(2S,3S)-3,5-二羟基-2-((Z)-4-(羟 甲 基)-8-甲 基-3,7-二 烯-1-基)-2-甲基-3,4,8,9-四氢吡喃并[2,3-e]异吲哚-7(2H)-酮(5)、5-((1R,2R,5R,6R)-2,5-二羟基-7-氧杂二环[4.1.0]庚烷-2-基)-3-((1S,2S,4aR,6S,8aS)-2,6-二甲基-1,2,4a,5,6,7,8,8a-八氢萘-1-羰基)-4-羟基吡啶-2(1H)-酮(6)、(3s)-6,8 -二羟基-3 -甲基-3,4 -二氢-1H-苯并吡喃-1 -酮(7)、腺苷(8)、4 -羟基苯甲醛(9)、5-氨基-2-羟基苯乙酸甲酯(10)、尿嘧啶核苷(11)、乙酰司他弗林(12)、尼克酰胺(13)、(S)-7-苯甲基-6-甲基-6,7-二氢苯并[6,7][1,4]二氮杂卓[2,1-b]喹唑啉-5,13-二酮(14)。据文献报道,化合物2、3 和4 为Brevicompanine 类二酮哌嗪类生物碱,2[2]和3[3]具有抗炎作用和免疫活性;化合物1 和12 具有抗流感病毒作用[4,6]。本实验采用MTT 法检测显示化合物5 具有一定的抗肿瘤活性,其对HT-29、A-549 和MCF-7 三种细胞的ED50分别为21.59、23.45 μg/mL 和37.36 μg/mL。
1 材料与方法
1.1 仪器与材料
质谱仪(VG Auto Spec-3000,英国);核磁共振仪(Bruker AV.DRX500,瑞士);高效液相色谱仪(Waters515-2996,美国);真空旋转蒸发仪(BUCHI,瑞士);柱层析用凝胶(Sephadex LH-20,安玛西亚生物技术上海有限公司);柱层析用硅胶(G200~300目,青岛海洋化学工业制品厂);薄层层析用硅胶GF254(青岛海洋化学工业制品厂);试剂均为分析纯或色谱纯。
1.2 菌株来源
菌株于2011年5月分离自云南个旧大屯锡尾矿矿土,初步鉴定为真菌。微生物样品保留于云南大学云南省微生物研究所,由李铭刚老师实验室提供。菌株编号为P-20。
1.3 发酵培养
从已活化的菌株斜面上挑取一定量的菌丝,转接到200 mL PDA 液体培养基内(500 mL 瓶中);28℃,180 rpm 摇床培养2~3 d,得到种子液。菌体从种子瓶接种到200 mL PDA 液体培养基内(500 mL瓶中),每瓶接种量约20 mL;28 ℃,180 rpm 摇床培养4~5 d。配制培养基均用土壤浸出液(200 g 矿土,1000 mL 水,浸泡3 d 后取上清液)。发酵总量为100 L。
1.4 提取分离
用滤袋过滤发酵液,将菌丝体和上清液分开。上清液用乙酸乙酯反复萃取三次,之后将萃取液在40 ℃条件下浓缩蒸干,得到上清液粗提物。菌丝体则用丙酮浸泡2 d,期间用超声仪超声三次,每次超声持续时间为30 min。过滤丙酮浸泡物,保留丙酮浸汁液并加热浓缩至水溶液;水溶液同样由乙酸乙酯反复萃取三次后浓缩蒸干,得到菌丝体胞内产物粗提物。经TLC 点板分析后,将上清液粗提物和菌丝体粗提物合并,得到总发酵提取物94 g。采用正相硅胶柱,氯仿-甲醇溶剂系统40∶1、9∶1、和1∶1(v/v)进行梯度洗脱。对9 ∶1(v/v)组分进行凝胶柱(Sephadex LH-20)层析后,分成7 组。组分2 经硅胶柱层析,氯仿-甲醇(20∶1,v/v)洗脱,高效液相制备色谱进行制备,得化合物1(11 mg)和2(15 mg)。组分3 组分经硅胶柱层析,石油醚-乙酸乙酯(4∶1)洗脱,高效液相制备色谱进行制备,得化合物3(12 mg),化合物4(13 mg)以及5(14 mg)。组分4 经硅胶柱层析,石油醚-丙酮(7∶3)洗脱,重结晶后得化合物7(10 mg),高效液相制备色谱进行制备得化合物6(8 mg)和8(13 mg)。组分5 经氯仿-甲醇(9∶1)洗脱,高效液相制备色谱进行制备,得化合物9(10 mg),化合物10(6 mg)以及化合物11(9 mg)。组分6 经石油醚-丙酮(65∶35)洗脱,高效液相制备色谱进行制备得化合物12(10 mg)和化合物13(13 mg)。组分7 经石油醚-乙酸乙酯(6∶4)洗脱,得到三个组分G7S1~G7S3。G7S3再经硅胶柱层析,氯仿-甲醇(20∶1),高效液相制备色谱进行制备得化合物14(10 mg)。
1.5 MTT 法检测分离化合物的抗肿瘤活性
利用MTT 法考察部分化合物的抗肿瘤活性。分别取对数生长期的肿瘤细胞HT-29,A-549 和MCF-7 接种于96 孔板(空白组加入等体积的DMEM 培养液),2 ×104个/孔,37 ℃,5%CO2条件下培养至细胞贴壁。实验组分别加入100 μL 以无血清培养基配制的不同浓度的样品溶液至终浓度分别为6.25、12.5、25、50、100 μg/mL;初次活性筛选的化合物终浓度为25 μg/mL。对照组加入等体积的无血清DMEM 培养液,每组6 个复孔,培养24 h。弃上清,每孔加入0.5 mg/mL 的MTT 100 μL,继续培养4 h。弃上清,再加入150 μL DMSO,振荡10 min,测定OD490,按如下公式计算抑制率%,并使用Origin 8.0 计算

2 实验结果
2.1 结构鉴定
化合物1 白色固体(甲醇);分子式为C23H31NO4;ESI-MSm/z:408[M +Na]+;1H NMR (DMSOd6,500 MHz)δ:1.59~1.23 (2H,m,H-1),2.36~1.55 (2H,m,H-2),3.36 (1H,t,J=7.0 Hz,H-3),1.47(1H,dd,J=13.1,3.2 Hz,H-5),2.14~1.66(2H,m,H-6),1.99~1.27 (2H,m,H-7),1.75(1H,m,H-8),3.09~2.10 (2H,d,J=17.8 Hz,H-11),0.93(3H,s,H-12),0.89 (3H,s,H-13),1.10(3H,d,J=7.2 Hz,H-14),0.84 (3H,s,H-15),6.63(1H,s,H-5'),4.17-4.08 (2H,d,J=16.9 Hz,H-8'),4.48(1H,br s,3-OH),9.76 (1H,br s,6'-OH),8.28 (1H,br s,NH);13C NMR (DMSO-d6,125 MHz)δ:23.6(C-1),25.7(C-2),72.3(C-3),37.5(C-4),44.3(C-5),23.5(C-6),27.6(C-7),39.2(C-8),37.1(C-9),83.1(C-10),32.0(C-11),30.1(C-12),26.8(C-13),16.9(C-14),20.1(C-15),112.0(C-1'),147.2(C-2'),120.6 (C-3'),131.7(C-4'),99.1 (C-5'),156.0(C-6'),170.6(C-7'),42.6 (C-8')。以上数据与文献对照一致[6],故确定该化合物为Stachyflin(司他弗林)。
化合物2 白色固体(甲醇,氯仿);分子式为C25H33N3O3;ESI-MSm/z:456 [M +Na]+;1H NMR(CDCl3,500 MHz)δ:3.94 (1H,dd,J=10.0,3.0 Hz,H-3),6.08(1H,s,H-5a),8.01(1H,d,J=7.3 Hz,H-7),7.29(1H,dd,J=7.3,7.3 Hz,H-8),7.14(1H,dd,J=7.6,7.3 Hz,H-9),7.26(1H,d,J=7.6 Hz,H-10),2.61~2.37 (2H,dd,J=12.7,5.7-11.3 Hz,H-12),3.83(1H,dd,J=11.3,5.7 Hz,H-11a),2.01-1.55 (2H,dd,14.1,8.9-9.7,H-12),1.71 (1H,m,H-13),0.97(3H,d,J=6.6 Hz,H-14),0.91(3H,d,J=6.6 Hz,H-15),5.81(1H,dd,J=17.2,10.9 Hz,H-17),5.12-5.10 (2H,dd,J=10.9-17.2,5.3 Hz,H-18),0.96(3H,s,H-19),1.15(3H,s,H-20),3.53-2.57 (2H,m,H-22),1.21(3H,t,J=7.4,H-23),6.16(1H,br s,2-NH);13C NMR(CDCl3,125 MHz)δ:169.1(C-1),108.1(C-3),179.7(C-4),116.2(C-5),139.8(C-6),211.2(C-7),54.1(C-8),37.6(C-9),31.2(C-10),36.4(C-11),34.7(C-12),43.0(C-13),43.4(C-14),131.5(C-15),132.7(C-16),32.4(C-17),18.1(C-18),23.3(C-19),70.7(C-1'),60.3(C-2'),57.5(C-3'),67.4(C-4'),25.6(C-5'),31.5(C-6')。以上数据与文献对照一致[7],故确定该化合物为Brevicompanine E。
化合物3 黄绿色固体(甲醇,氯仿);分子式为C24H31N3O3;ESI-MSm/z:432 [M+Na]+;1H NMR(CDCl3,500 MHz)δ:3.94 (1H,d,J=4.1 Hz,H-3),6.22(1H,s,H-5a),8.06(1H,d,J=7.3 Hz,H-7),7.31(1H,dd,J=7.3,7.3 Hz,H-8),7.12(1H,dd,J=7.6,7.3 Hz,H-9),7.28(1H,d,J=7.6 Hz,H-10),2.60~2.28 (2H,dd,J=12.6,5.7-11.6 Hz,H-11),3.82(1H,dd,J=11.6,5.7 Hz,H-11a),2.65(1H,m,H-12),1.05 (3H,d,J=6.8 Hz,H-13),0.92(3H,d,J=6.8 Hz,H-14),5.78(3H,dd,J=16.8,11.1 Hz,H-16),5.14-5.12 (2H,dd,J=16.8,6.0 Hz,H-17),0.98(3H,s,H-18),1.16(3H,s,H-19),3.40-2.63(2H,m,H-21),1.23(3H,t,J=7.2,H-22),6.06 (1H,br s,2-NH);13C NMR(CDCl3,125 MHz)δ:168.2(C-1),60.1(C-3),164.2(C-4),78.4(C-5a),143.7 (C-6a),118.5 (C-7),129.3(C-8),124.3(C-9),124.8(C-10),132.0(C-10a),61.1(C-10b),38.1(C-11),58.8(C-11a),29.4(C-12),19.1(C-13),16.0(C-14),40.8(C-15),143.3(C-16),114.9(C-17),23.5(C-18),33.2(C-19),173.9(C-20),28.5(C-21),9.1(C-22)。以上数据与文献对照一致[7],故确定该化合物为Brevicompanine H。
化合物4 淡黄色油状(甲醇,氯仿);分子式为C24H33N3O3;ESI-MSm/z:434 [M+Na]+;1H NMR(CDCl3,500 MHz)δ:4.07 (1H,dd,J=8.3,3.6 Hz,H-3),5.91(1H,s,H-5a),6.60(1H,d,J=7.8 Hz,H-7),7.16(1H,dd,J=7.8,7.7 Hz,H-8),6.78(1H,dd,J=7.7,7.2 Hz,H-9),7.18(1H,d,J=7.2 Hz,H-10),2.53~2.35(2H,dd,J=12.5,6.0~11.4Hz,H-11),4.03(1H,dd,J=11.4,6.0 Hz,H-11a),1.97~1.66 (2H,dd,J=11.4~14.1,6.0-9.0 Hz,H-12),1.73 (1H,m,H-13),0.98(3H,d,J=6.7 Hz,H-14),0.93(3H,d,J=6.7 Hz,H-15),5.92(1H,dd,J=16.9,11.0 Hz,H-17),5.13~5.08(2H,dd,J=16.9,5.6 Hz,H-18),1.01(3H,s,H-19),1.10(3H,s,H-20),4.97~4.86(2H,d,J=10.2,H-21),3.33(3H,s,H-21),6.16(1H,br s,2-NH);13C NMR (CDCl3,125 MHz)δ:168.7(C-1),53.4(C-3),165.1(C-4),80.4(C-5a),149.6(C-6a),107.0(C-7),129.2(C-8),118.7(C-9),125.4(C-10),129.8(C-10a),60.4(C-10b),38.8(C-11),58.3(C-11a),28.4(C-12),24.2(C-13),23.3(C-14),21.3(C-15),41.3(C-16),143.2(C-17),114.6(C-18),23.1(C-19),22.6(C-20),78.5(C-21),55.7(C-22)。以上数据与文献对照一致[7],故确定该化合物为Brevicompanine D。
化合物5 无色固体(甲醇,氯仿);分子式为C23H31NO5;ESI-MSm/z:424 [M+Na]+;1H NMR(CDCl3,500 MHz)δ:6.78 (1H,s,H-4),3.01~2.64 (2H,dd,J=17.7,5.7~7.3 Hz,H-7),3.90(1H,dd,J=7.3,5.7 Hz,H-8),4.28(2H,br s,H-13),1.74(2H,m,H-14),2.30(1H,m,H-15),5.33(1H,dd,J=7.5,7.5 Hz,H-16),2.08(2H,m,H-18),2.06(1H,m,H-19),5.09 (1H,dd,J=1.3,1.3 Hz,H-20),1.65(3H,s,H-22),1.57(3H,s,H-23),4.11~4.07(2H,d,J=12.4 Hz,H-24),1.28(3H,s,H-25);13C NMR (CDCl3,125 MHz)δ:174.5(C-2),132.4(C-3),101.3(C-4),158.6(C-5),113.8(C-6),27.6(C-7),68.6(C-8),80.3(C-9),150.3(C-11),124.1(C-12),44.3(C-13),39.1(C-14),22.3(C-15),129.0(C-16),139.9(C-17),36.2(C-18),27.8(C-19),125.6(C-20),132.2(C-21),25.7(C-22),17.9(C-23),60.1(C-24),18.6(C-25)。以上数据与文献对照一致[8],故确定该化合物为Stachybotrin A{(2S,3S)-3,5-二羟基-2-((Z)-4-(羟甲基)-8-甲基-3,7-二烯-1-基)-2-甲基-3,4,8,9-四氢吡喃并[2,3-e]异吲哚-7(2H)-酮}。
化合物6 白色固体(氯仿);分子式为C24H31NO6;ESI-MSm/z:452[M+Na]+;1H NMR (CDCl3,500 MHz)δ:7.51(1H,d,J=2.8 Hz,H-6),4.35(1H,dd,J=10.8,6.0 Hz,H-8),1.50(1H,dd,J=10.8,2.8 Hz,H-9),1.86~0.78(2H,m,H-10),1.66~0.97(2H,m,H-11),1.45(1H,m,H-12),1.69~0.72(1H,m,H-13),1.75(1H,m,H-14),5.30(1H,m,H-15),5.33 (1H,m,H-16),2.80(1H,m,H-17),0.75(3H,d,J=7.3 Hz,H-18),0.84(3H,d,J=6.3 Hz,H-19),3.52(1H,d,J=3.3 Hz,H-2'),3.33(1H,dd,J=3.3,2.9 Hz,H-3'),4.06(1H,m,H-4'),1.80~1.31(2H,m,H-5'),2.14~1.68(2H,m,H-6');13C NMR (CDCl3,125 MHz)δ:169.1(C-2),108.1(C-3),179.7(C-4),116.2(C-5),139.8(C-6),211.2(C-7),54.1(C-8),37.6(C-9),31.2(C-10),36.4(C-11),34.7(C-12),43.0(C-13),43.4(C-14),131.5(C-15),132.7(C-16),32.4(C-17),18.1(C-18),23.3(C-19),70.7(C-1'),60.3(C-2'),57.5(C-3'),67.4(C-4'),25.6(C-5'),31.5(C-6')。以上数据与文献对照一致[9],故确定该化合物为Apiosporamide{5-((1R,2R,5R,6R)-2,5-二羟基-7-氧杂二环[4.1.0]庚烷-2-基)-3-((1S,2S,4aR,6S,8aS)-2,6-二甲基-1,2,4a,5,6,7,8,8a-八氢萘-1-羰基)-4-羟基吡啶-2(1H)-酮}。
化合物7 黄色固体(甲醇,氯仿);分子式为C10H10O4;ESI-MSm/z:217 [M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:4.68 (1H,m,H-3),2.91~2.80(1H,dd,J=11.6,2.8 Hz,H-4),6.23(1H,s,H-5),6.18 (1H,s,H-7),1.38 (3H,d,J=6.3 Hz,H-9);13C NMR (DMSO-d6,125 MHz)δ:169.5(C-1),75.4(C-3),33.8(C-4),142.3 (C-4a),106.9(C-5),164.6(C-6),100.9(C-7),163.4(C-8),100.0 (C-8a),20.3(C-9)。以上数据与文献对照一致[10],故确定该化合物为(3s)-6,8 -二羟基-3 -甲基-3,4 -二氢-1H-异色原-1-酮。
化合物8 黄色固体(甲醇);分子式为C10H13N5O4;ESI-MSm/z:290 [M +Na]+;1H NMR (DMSO-d6,500 MHz)δ:8.12 (1H,s,H-2),8.34(1H,s,H-8),5.86 (1H,d,J=6.2 Hz,H-1'),4.59(1H,t,J=5.3 × (2)Hz,H-2'),4.13(1H,m,H-3'),3.95(1H,q,J=3.5 ×(3)Hz,H-4'),3.66-3.55(2H,m,H-5'),7.34(2H,br s,6-NH2);13C NMR (DMSO-d6,125 MHz)δ:152.3(C-2),149.1(C-4),119.4(C-5),156.1(C-6),139.8(C-8),87.9(C-1'),73.5(C-2'),70.6(C-3'),85.5(C-4'),61.6(C-5')。以上数据与文献对照一致[11],故确定该化合物为腺苷。
化合物9 淡黄色固体(甲醇,氯仿);分子式为C7H6O2;ESI-MSm/z:155 [M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:8.40 (1H,d,J=8.4 Hz,H-2,6),7.56(1H,d,J=8.4 Hz,H-3,5),10.42(1H,s,H-7);13C NMR (DMSO-d6,125 MHz)δ:127.9(C-1),132.2(C-2,6),116.1(C-3,5),164.3(C-4),190.8 (C-7)。以上数据与文献对照一致[12],故确定该化合物为对-羟基苯甲醛。
化合物10 浅黄色油状(甲醇,氯仿);分子式为C9H11NO3;ESI-MSm/z:204[M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:3.47 (2H,s,H-2),6.47(1H,dd,J=8.4,2.7 Hz,H-3'),6.59 (1H,dd,J=8.4,2.7 Hz,H-4'),6.53(1H,d,J=2.7 Hz,H-6'),3.57(3H,s,H-7');13C NMR (DMSO-d6,125 MHz)δ:171.8(C-1),35.2(C-2),121.7(C-1'),149.6(C-2'),117.6 (C-3'),115.4 (C-4'),147.8 (C-5'),114.3(C-6'),51.5(C-7')。以上数据与文献对照一致[13],故确定该化合物为5-氨基-2-羟基苯乙酸甲酯。
化合物11 无色油状(甲醇,氯仿);分子式为C9H12N2O6;ESI-MSm/z:267 [M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:5.64 (1H,d,J=8.4 Hz,H-5),7.88 (1H,d,J=8.4 Hz,H-6),5.77 (1H,d,J=5.4 Hz,H-2'),4.01 (1H,m,H-3'),3.95 (1H,m,H-4'),3.83 (1H,m,H-5'),3.57 (2H,m,H-6');13C NMR (DMSO-d6,125 MHz)δ:150.7 (C-2),163.1(C-4),101.6 (C-5),140.6 (C-6),87.7 (C-2'),73.5 (C-3'),69.8 (C-4'),84.8 (C-5'),60.8 (C-6')。以上数据与文献对照一致[14],故确定该化合物为尿嘧啶核苷。
化合物12 白色固体(甲醇,氯仿);分子式为C25H33NO5;ESI-MSm/z:450 [M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:2.09~1.70(2H,m,H-3),2.39-1.61(2H,m,H-2),4.67(1H,t,J=7.3 Hz,H-3),1.57(1H,m,H-5),1.95-1.74(2H,m,H-6),2.05-1.34(2H,m,H-7),1.79(1H,m,H-8),3.11-2.15(2H,d,J=17.6 Hz,H-11),1.04(3H,s,H-12),0.80 (3H,s,H-13),1.12(3H,d,J=7.3 Hz,H-14),0.85(3H,s,H-15),2.07(3H,s,H-17),6.65(1H,s,H-5'),4.16-4.10(2H,d,J=17.1,H-8'),9.76(1H,br s,6'-OH),8.28(1H,br s,NH);13C NMR (DMSO-d6,125 MHz)δ:24.1(C-1),22.7(C-2),75.1(C-3),36.4(C-4),43.5(C-5),23.0(C-6),27.2(C-7),39.0(C-8),37.2(C-9),82.6(C-10),31.8(C-11),29.7(C-12),26.1(C-13),17.0(C-14),19.8(C-15),169.8(C-16),20.8(C-17),112.1(C-1'),146.9(C-2'),120.7 (C-3'),131.8(C-4'),99.4(C-5'),156.1(C-6'),170.3(C-7'),42.5(C-8')。以上数据与文献对照一致[15],故确定该化合物为Acetylstachyflin(乙酰司他弗林)。
化合物13 淡黄色固体(甲醇);分子式为C6H6N2O;ESI-MSm/z:145[M+Na]+;1H NMR(DMSO-d6,500 MHz)δ:9.03 (1H,d,J=1.4 Hz,H-2),8.21(1H,d,J=7.5 Hz,H-4),7.49 (1H,dd,J=7.5,4.8 Hz,H-5),9.03(1H,d,J=1.4 Hz,H-6);13C NMR (DMSO-d6,125 MHz)δ:152.0(C-2),129.7(C-3),135.2(C-4),123.5(C-5),152.0(C-6),166.6(C-7)。以上数据与文献对照一致[16],故确定该化合物为Nicotinamide(尼克酰胺)。
化合物14 黄色固体(甲醇,氯仿);分子式为C24H19N3O2;ESI-MSm/z:404 [M+Na]+;1H NMR(CDCl3,500 MHz)δ:7.89 (1H,d,J=8.1 Hz,H-4),7.60(1H,dd,J=8.1,7.2 Hz,H-5),7.69(1H,dd,J=8.0,7.2 Hz,H-6),7.73(1H,d,J=8.0 Hz,H-7),8.28(1H,d,J=7.7 Hz,H-12),7.64(1H,dd,J=7.7,7.3 Hz,H-13),7.94(1H,dd,J=8.2,7.3 Hz,H-14),7.91(1H,d,J=8.2 Hz,H-15),4.86(1H,dd,J=7.6,7.6 Hz H-19),3.82-3.41 (2H,dd,J=14.8,7.6 Hz,H-20),7.40(1H,br d,J=7.4 Hz,H-22,26),7.28(1H,br t,J=7.4 Hz,H-23,25),7.23(1H,br d,J=7.4 Hz,H-24),3.05(3H,s,H-27);13C NMR (CDCl3,125 MHz)δ:130.1(C-4),129.7(C-5),131.6(C-6),129.1 (C-7),134.5(C-8),125.4 (C-10),162.0 (C-11),123.1 (C-12),128.4(C-13),135.8(C-14),128.8(C-15),147.5(C-16),154.1(C-18),59.6(C-19),33.6(C-20),138.5(C-21),129.8(C-22,26),129.5(C-23,25),127.7(C-24),28.2(C-27)。以上数据与文献对照一致[17],故确定该化合物为Benzomalvin A{(S)-7-苯甲基-6-甲基-6,7-二氢苯并[6,7][1,4]二氮杂卓[2,1-b]喹唑啉-5,13-二酮}。
2.2 MTT 法检测结果
MTT 法检测化合物1~6、12、14(其余化合物无活性)对HT-29、A-549 和MCF-7 三种细胞的抑制率如表1 所示。
表1 部分化合物(25 μg/mL)对三种肿瘤细胞的抑制率(%,± s)Table 1 Inhibition rates of compounds 1~6,12 and 14 (25 μg/ mL)on three tumor cells (%,± s)

表1 部分化合物(25 μg/mL)对三种肿瘤细胞的抑制率(%,± s)Table 1 Inhibition rates of compounds 1~6,12 and 14 (25 μg/ mL)on three tumor cells (%,± s)
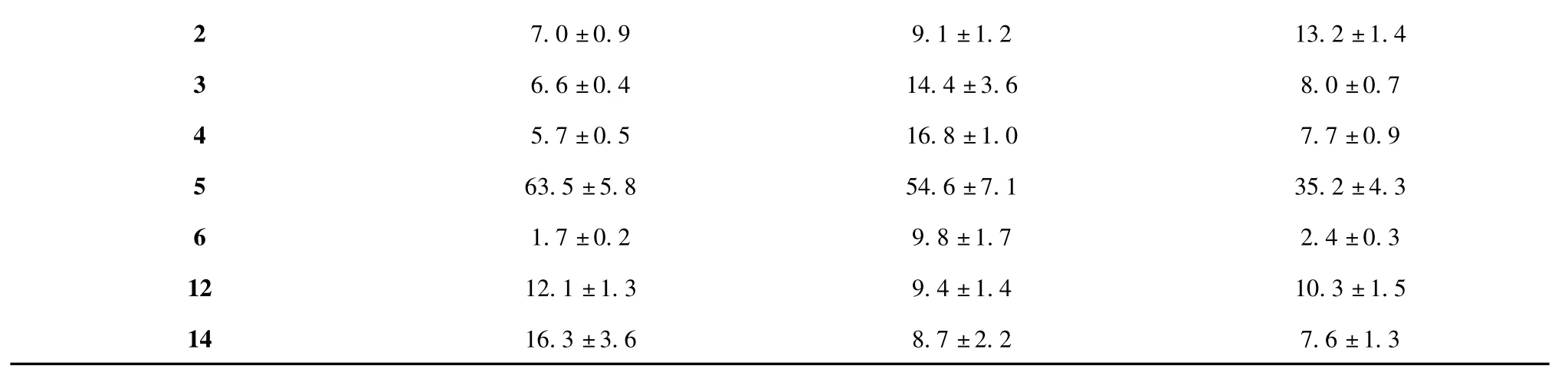
结果显示,在分离得到的化合物中,化合物5 具有较明显的抗肿瘤活性。检测不同浓度的化合物5对肿瘤细胞的抑制率,结果如图1 所示。
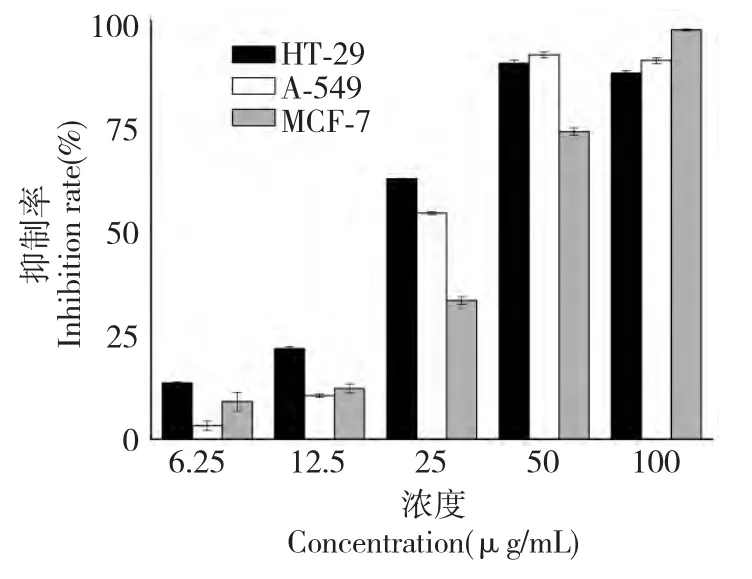
图1 化合物5 对肿瘤细胞的抑制效果Fig.1 Inhibition effect of compound 5 on three tumor cells
从图1 可以看出,对HT-29 和A-549 细胞,在6~50 μg/mL 的浓度范围内,随着化合物5 浓度的增加,抑制率逐渐增强。在浓度为50 μg/mL 时,抑制率达到最大值。对MCF-7 细胞,在6~100 μg/mL的浓度范围内,抑制率逐渐随化合物5 浓度的增加而增强。三种细胞的ED50分别为21.59 μg/mL、23.45 μg/mL 和37.36 μg/mL。
3 结论
从锡尾矿真菌P-20 液体发酵产物中分离得到14 个化合物,为锡尾矿真菌次生代谢产物的研究提供信息。经MTT 法检测到化合物5 有较明显的抗肿瘤活性。对于这些化合物的其他活性有待进一步研究。
1 Guo J (郭健),Guo F(郭斐),Ding ZG(丁章贵),et al.Research progress on tailing wasteland in microbial natural products.J Yunnan Univ(云南大学学报),2012,34:105-109.
2 Yang X,Du L,Tang X,et al.Brevicompanine E reduces lipopolysaccharide-induced production of proinflammatory cytokines and enzymes in microglia by inhibiting activation of activator protein-1 and nuclear factor-kappaB.J Neuroimmunol,2009,216(1-2):32-38.
3 Du L,Yang X,Zhu T,et al.Diketopiperazine alkaloids from a deep ocean sediment derived fungusPenicillium sp..Chem Pharm Bull,2009,57:873-876.
4 Motohashi Y,Igarashi M,Okamatsu M,et al.Antiviral activity of stachyflin on influenza A viruses of different hemagglutinin subtypes.Virol J,2013,10:118-128.
5 Qiu CL (邱潮林),Gong YY(龚玉瑜).A study on comparison of two methods-TUNEL and MTT for testing the chemosensitivity to anti-tumor agents.Shanghai J Immunol(上海免疫学杂志),2000,20:107-109.
6 Minagawa K,Kouzuki S,Kamigauchi T.Stachyflin and acetylstachyflin,novel anti-influenza A virus substances,produced byStachybotrys sp.RF-7260 I.Isolation,structure elucidation and biological activities.J Antibiot,2002,55:155-164.
7 Du L (杜林).Secondary metabolites of five flamentous fungal strains:structures and bioactivities.Qingdao:Ocean University of China (中国海洋大学),PhD.2009.
8 Xu X,De Guzman FS,Gloer JB,et al.Stachybotrins A and B:novel bioactive metabolites from a brackish water isolate of the fungusStachybotrys sp.J Org Chem,1992,57:6700-6703.
9 Alfatafta AA,Gloer JB,Scott JA,et al.Apiosporamide,a new antifungal agent from the coprophilous fungusApiospora montagnei.J Nat Prod,1994,57:1696-1702.
10 Sadequl I,Ken I,Hidenori W.Synthesis of (-)-mellein,(+)-ramulosin,and related natural products.Tetrahedron,2007,63:1074-1079.
11 Awaya J,Matsuyama K,Iwai Y,et al.Production of 9-beta-Darabinofuranosyladenine by a new species of Streptomyces and its herbicidal activity.J Antibiot,1979,32:1050-1053.
12 Hari PD,Masato W,Takashi W.Phenolic compounds from the aerial parts ofDiplomorpha canescens.Chem Pharm Bull,2012,60:554-556.
13 Takuya H,Hiroki N,Yuka T.Axially chiral dicarboxylic acid catalyzed activation of quinone imine ketals:enantioselective arylation of enecarbamates.J Am Chem Soc,2013,135:16010-16013.
14 Huang RM,Zhou XF,Peng Y.Nucleosides from the marine spongeCallyspongiasp..Chem Nat Compd,2011,46:1010-1011.
15 Minagawa K,Kouzuki S,Tani H,et al.Novel stachyflin derivatives fromStachybotryssp.RF-7260.Fermentation,isolation,structure elucidation and biological activities.J Antibiot,2002,5:239-248.
16 Gamov GA,Dushina SV,Aleksandriiskii VV.Nicotinamide solvation state in aqueous dimethyl sulfoxide.Russ Chem Bull,2013,62:1183-1190.
17 Sun HH,Barrow CJ,Sedlock DM.Benzomalvins,new substance Pinhibitors from aPenicilliumsp..J Antibiot,1994,47:515-522.
