胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法的建立
2015-01-05郑新添黄翠琴黄其春戴爱玲谭晓珺
郑新添,黄翠琴,黄其春,戴爱玲,谭晓珺
(龙岩学院 福建省预防兽医学与兽医生物技术重点实验室,福建 龙岩 364000)
胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法的建立
郑新添,黄翠琴,黄其春,戴爱玲,谭晓珺
(龙岩学院 福建省预防兽医学与兽医生物技术重点实验室,福建 龙岩 364000)
【目的】 建立检测胞内劳森菌的SYBR Green Ⅰ real-time PCR方法,为猪增生性肠炎的准确诊断奠定基础。【方法】 针对胞内劳森菌16S rDNA序列设计引物,扩增16S rDNA,构建pT-LI-16S重组质粒。以pT-LI-16S为模板建立检测胞内劳森菌的SYBR Green Ⅰ real-time PCR方法,检测其特异性、敏感性和重复性,并用该方法对51份疑似增生性肠炎病例进行检测。【结果】 建立的SYBR Green Ⅰ real-time PCR方法特异性强,与大肠杆菌、沙门氏菌、金黄色葡萄球菌和副猪嗜血杆菌等无交叉反应;在标准质粒含量为1.0×102~1.0×108拷贝/μL时,质粒含量与循环阈值(Ct)之间具有良好的线性关系(R2=0.992),最小可检测到10 拷贝/μL的重组质粒;重复性检测显示其批内变异系数小于2%。该方法对粪便及小肠组织中胞内劳森菌的检出率分别为46.9%和84.2%,高于普通PCR的检出率(分别为40.7%和78.9%)。【结论】 建立的SYBR Green Ⅰ real-time PCR方法特异性强、敏感性高、重复性好,能对胞内劳森菌进行快速检测及定量分析,可用于猪增生性肠炎的诊断。
胞内劳森菌;荧光定量PCR;猪增生性肠炎;检测方法
由胞内劳森菌(Lawsoniaintracellularis)引起的猪增生性肠炎(Porcine proliferative enteritis,PPE)是猪的一种接触性肠道疾病,以回肠和结肠隐窝内未成熟的肠细胞发生腺瘤样增生为特征[1]。PPE在全球猪场流行,严重影响猪的生长速度和饲料转化率,给猪场造成了严重损失[2],是危害世界养猪业的重要疾病之一[3]。近年来,国内甚至亚洲的猪场,由胞内劳森菌引起的增生性肠炎的发病率呈上升趋势[4-5]。胞内劳森菌是一种专性胞内寄生菌,其生长需要某些特定细胞,不能在无细胞培养基中培养,因此不能采用常规细菌学方法对PPE进行诊断[6]。临床上胞内劳森菌以隐性感染居多,其导致的肠炎与猪圆环病毒引起的肠炎相似,肉眼难以区分,因此依临床症状及剖检病变仅可做出初步诊断,确诊还需进行实验室检查[7]。本研究拟建立区别于普通PCR的检测胞内劳森菌的SYBR Green Ⅰ real-time PCR技术,旨在为PPE的诊断、流行病学调查及胞内劳森菌的定量检测等工作奠定基础。
1 材料与方法
1.1 材 料
1.1.1 主要试剂与仪器 SYBR®Premix ExTaqTM(Tli RNaseH Plus)、pMD18-T载体、DNA回收试剂盒、限制性内切酶PstⅠ和EcoRⅠ等购自宝生物工程(大连)有限公司,粪便DNA提取试剂盒(Stool DNA Kit,Omega)购自厦门鹭荣生物科技发展有限公司,2×PowerTaqPCR MasterMix和PCR产物回收试剂盒等购自北京百泰克生物技术有限公司,Mastercycler ep realplex荧光定量PCR仪为Eppendorf公司产品,全波长读数仪Multiskan GO为Thermo Scientific 公司产品。
1.1.2 菌株和样品 猪回肠炎活疫苗LawsoniaintracellularisVaccine(Enterisol Ileitis)购自勃林格殷格翰公司;大肠杆菌、沙门氏菌、副猪嗜血杆菌和金黄色葡萄球菌等均由福建省预防兽医学与兽医生物技术重点实验室鉴定和保存;51份疑似胞内劳森菌感染样品(粪便32份,肠组织19份)采集于2009-2014年送检至龙岩学院动物医学研究所的猪只,患猪经临床和病理剖检初步诊断感染PPE。
1.1.3 引物的设计与合成 以胞内劳森菌的16S rDNA序列(GenBank登录号:U30147)为靶基因,利用DNAStar软件设计1对SYBR Green Ⅰ real-time PCR 引物:LI-f.5′-TTCTCCTTTCTCATGTCCCATAAG-3′,LI-r.5′-TGCTATCTCTGCTGCATGTAATG-3′,预期扩增片段长度为160 bp。参照文献[8]合成1对检测胞内劳森菌的普通PCR引物:P1.5′-GCAGCACTTGCAAACAATAAACT-3′,P2.5′-TTCTCCTTTCTCATGTCCCATAA-3′。引物由宝生物工程(大连)有限公司合成。
1.2 引物特异性验证及标准重组质粒模板的构建
1.2.1 核酸的提取 用于构建real-time PCR的胞内劳森菌核酸的提取方法为:取100 μL 胞内劳森菌疫苗液,加入12 μL体积分数10%的SDS和2 μL蛋白酶K(20 μg/mL),37 ℃温育1 h,95 ℃ 10 min,加入232 μL 无水乙醇,沉淀10 min,12 000 r/min离心10 min,弃上清,沉淀用体积分数75%乙醇洗涤2遍,干燥后用20 μL TE 溶解。小肠组织胞内劳森菌核酸的提取参照文献[9]的方法进行;粪便中胞内劳森菌DNA采用Stool DNA Kit试剂盒提取,方法参照产品说明书。
1.2.2 重组质粒pT-LI-16S的构建 首先用PCR扩增胞内劳森菌 16S rDNA,其反应体系为: 2×PowerTaqPCR MasterMix 10 μL,LI-f和LI-r 各0.5 μL, 胞内劳森菌DNA 1 μL,ddH2O 补充至20 μL。PCR反应程序为: 95 ℃ 5 min;95 ℃ 40 s,52 ℃ 1 min,72 ℃ 30 s,共35个循环;72 ℃ 5 min。取PCR产物进行15 g/L琼脂糖凝胶电泳分析,用DNA回收试剂盒回收目的条带,并将其与pMD18-T 载体连接,构建重组质粒pT-LI-16S。将重组质粒转化大肠杆菌DH5α,挑取白色菌落,提取质粒,经PCR和限制性内切酶PstⅠ和EcoRⅠ双酶切鉴定为阳性的重组克隆子,进一步进行测序鉴定。
1.3 SYBR Green Ⅰ real-time PCR反应条件的确立
建立20 μL反应体系,以稀释的标准重组质粒为模板,对反应温度、引物浓度及循环次数等参数进行优化,通过对循环阈值(Ct)、荧光强度及溶解曲线等的比较,判定最佳反应条件。
1.4 SYBR Green Ⅰ real-time PCR的特异性、敏感性和重复性试验
1.4.1 特异性 提取大肠杆菌、沙门氏菌、金黄色葡萄球菌、副猪嗜血杆菌等细菌的基因组DNA,以之及胞内劳森菌核酸为模板,用优化的反应条件进行SYBR Green Ⅰ real-time PCR检测,以胞内劳森菌DNA为阳性对照,评价所建立方法的特异性。
1.4.2 敏感性 用紫外分光光度计测定重组质粒pT-LI-16S的OD260,按照1 OD260双链DNA=50 ng/μL的换算关系计算质粒的质量浓度(A),然后根据拷贝数=A/重组质粒摩尔质量×6.02×1023,将质粒的质量浓度转换为拷贝数浓度(拷贝/μL),并将重组质粒以10倍倍比梯度稀释后作为标准模板,用优化的SYBR Green Ⅰ real-time PCR体系扩增,利用实时荧光定量PCR仪系统软件进行分析,绘制标准曲线并确定荧光定量PCR的敏感性。
1.4.3 重复性 以重组质粒pT-LI-16S为模板,取5个含量梯度,分别为1.0×106,1.0×105,1.0×104,1.0×103和1.0×102拷贝/μL,每个梯度重复3次,在相同扩增条件下进行平行试验,测定组内变异系数,评价其重复性。
1.5 SYBR Green Ⅰ real-time PCR的临床应用
将临床采集的51份疑似PPE样品,分别用普通PCR[10]和SYBR Green Ⅰ real-time PCR 检测,比较两者的检出率。
2 结果与分析
2.1 重组质粒pT-LI-16S的构建
用real time PCR引物对胞内劳森菌16S rDNA经普通PCR扩增,结果获得了与预期长度160 bp一致的片段(图1)。
图1 胞内劳森菌16S rDNA的PCR扩增
1.DNA标样;2.PCR扩增产物
Fig.1 PCR amplification of 16S rDNA ofLawsoniaintracellularis1.DNA Marker;2.PCR products
胞内劳森菌重组质粒pT-LI-16S的PCR鉴定(图2,泳道1)及PstⅠ和EcoRⅠ双酶切鉴定 (图2,泳道2,3)结果表明,该重组质粒克隆的外源基因序列为胞内劳森菌16S rDNA特异性片段。
图2 重组质粒pT-LI-16S的PCR鉴定和酶切鉴定
1.以pT-LI-16S为模板的PCR扩增产物;2.重组质粒pT-LI-16S的PstⅠ+EcoRⅠ双酶切;3.重组质粒pT-LI-16S;M.DNA标样
Fig.2 Recombinant plasmid identification using PCR and double enzyme digestion 1.PCR product amplified with pT-LI-16S as the template; 2.pT-LI-16S digested byPstⅠ+EcoRⅠ;3.Recombinant plasmid pT-LI-16S;M.DNA Marker
2.2 胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法反应条件的确立
对SYBR Green Ⅰ real-time PCR的引物浓度、反应温度及循环次数等进行优化,结果表明20 μL 最佳反应体系为: Premix ExTaq10 μL,上、下游引物(25 pmol/μL)各0.5 μL,模板1 μL,ddH2O 8 μL。反应程序为:95 ℃ 预变性2 min;95 ℃ 30 s,52 ℃ 20 s,72 ℃ 20 s,循环40次。
2.3 胞内劳森菌SYBR Green Ⅰ real-time PCR的特异性检测
用优化后的反应体系,以大肠杆菌、沙门氏菌、金黄色葡萄球菌及副猪嗜血杆菌等为对照,对所建立的新方法的特异性进行检测,结果表明该反应体系仅对胞内劳森菌出现扩增信号,而对照病原体均为阴性反应(图3),表明建立的 real-time PCR检测方法具有良好的特异性。
2.4 胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法的敏感性试验
将已测定质量浓度的重组质粒pT-LI-16S经过换算稀释成1.0×100~1.0×109拷贝/μL,按优化的反应条件进行实时荧光定量PCR扩增,结果见图4-A;在模板含量为1.0×102~1.0×108拷贝/μL时,模板含量与Ct值之间的线性关系较好,其线性相关系数R2=0.992,回归方程为y=-3.180x+33.71(图4-B)。模板含量为10 拷贝/μL 时其Ct值小于阴性对照Ct值,而当模板含量为1 拷贝/μL时其Ct值与阴性对照组相同,因此该检测法的最低检测限为10拷贝/μL。
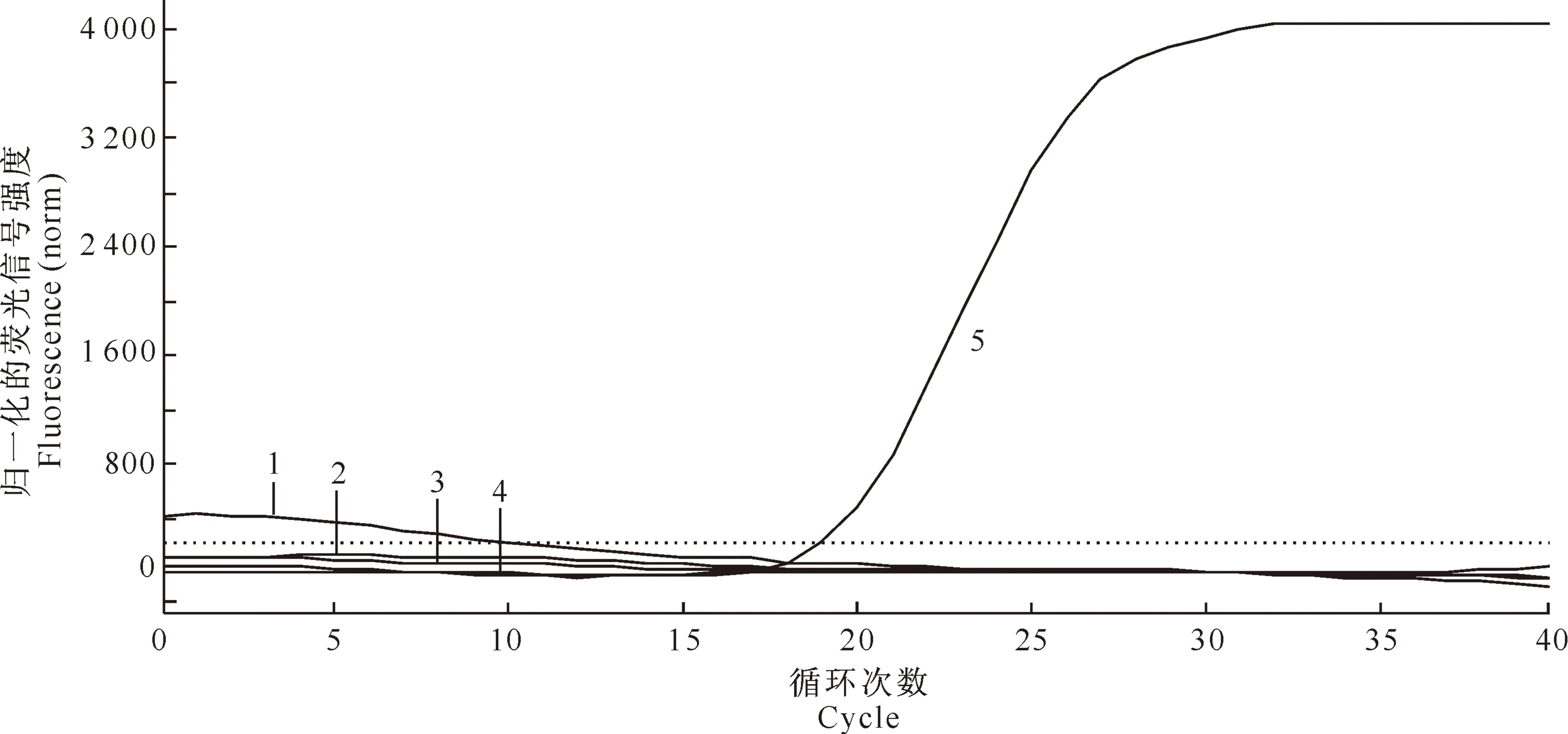
图3 胞内劳森菌SYBR Green Ⅰ real-time PCR特异性的检测
1.大肠杆菌;2.沙门氏菌;3.副猪嗜血杆菌;4.金黄色葡萄球菌;5.胞内劳森菌
Fig.3 Specificity test onLawsoniaintracellularisSYBR Green Ⅰ real-time PCR
1.E.coli;2.Salmonella;3.Haemophilusparasuis;4.Staphylococcusaureus;5.L.intracellularis
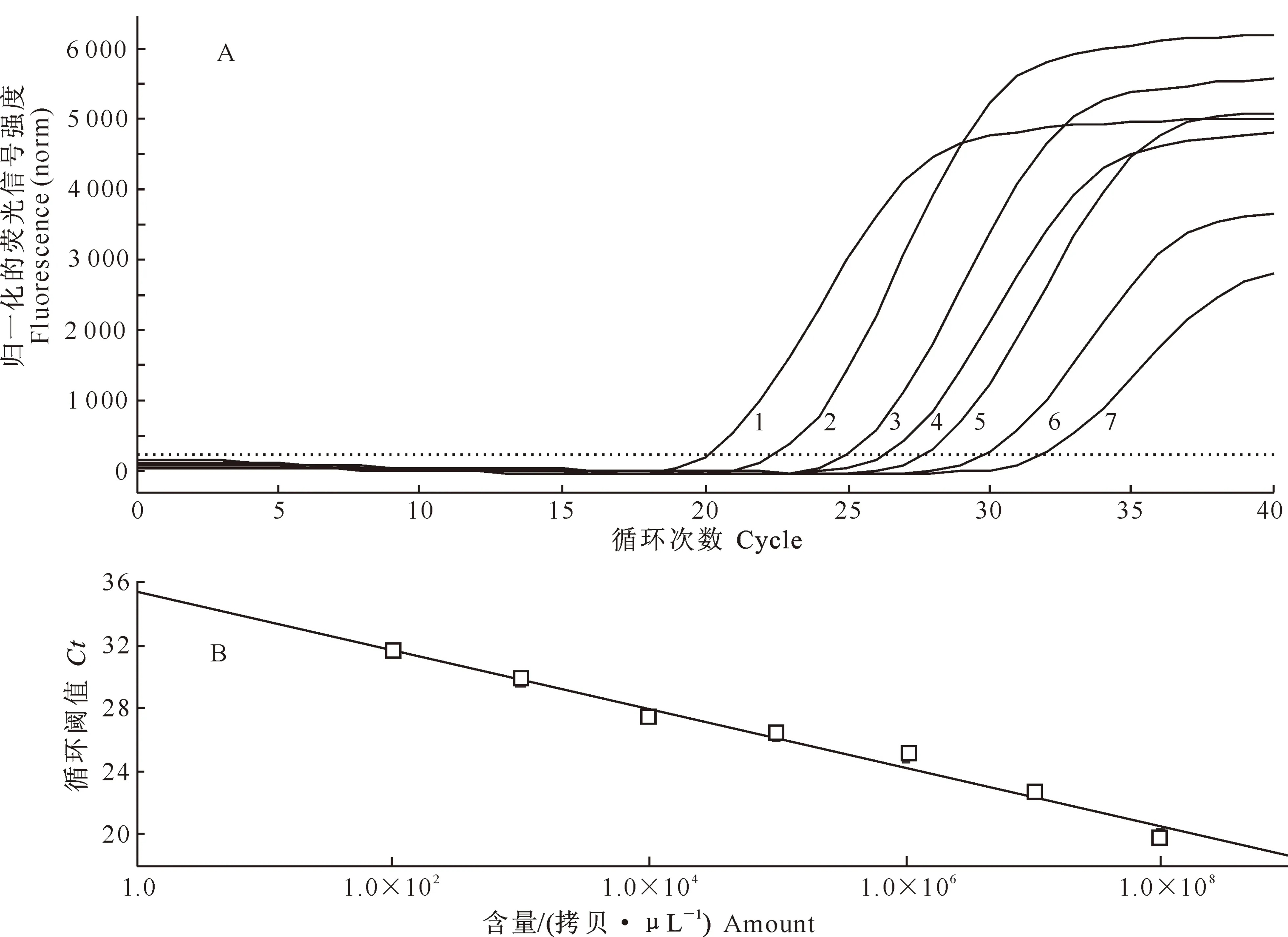
图4 胞内劳森菌SYBR Green Ⅰ real-time PCR的敏感性检测
A.不同模板含量的扩增曲线;B.Ct值与模板含量之间的拟合曲线
1~7.模板含量分别为1.0×108~1.0×102拷贝/μL
Fig.4 Sensitivity test ofLawsoniaintracellularisSYBR Green Ⅰ real-time PCR A.Amplification plot of each template concentration;B.Fitted cure ofCtvalue and templates concentration
1-7.Concentration of the template were 1.0×108-1.0×102copies/μL,respectively
2.5 胞内劳森菌SYBR Green Ⅰ real-time PCR检测方法的重复性试验
以重组质粒pT-LI-16S为模板,用5个含量梯度(1.0×102~1.0×106拷贝/μL)进行重复性试验,观察不同组内的变异情况,结果显示,各次重复均有扩增信号出现(图5),上述5个梯度的组内Ct变异系数(CV)在0.45%~1.53%(表1),说明该检测法的重复性较好。
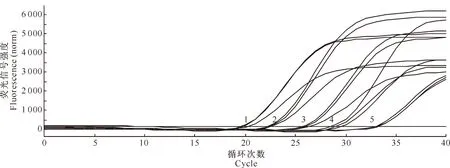
图5 胞内劳森菌SYBR Green Ⅰ real-time PCR的重复性检测

表1 胞内劳森菌SYBR Green Ⅰ real-time PCR的重复性检测统计结果Table 1 Repeatability test of Lawsonia intracellularis SYBR Green Ⅰ real-time PCR
2.6 SYBR Green Ⅰ real-time PCR与普通PCR临床检测结果的比较
将采集的51份PPE疑似样品,分别用普通PCR和SYBR Green Ⅰ real-time PCR进行检测,结果(表2)表明,SYBR Green Ⅰ real-time PCR对粪便、小肠组织中胞内劳森菌的检出率分别为46.9%和84.2%,高于普通PCR的检出率(分别为40.7%和78.9%)。两者的阳性符合率为83.9%(26/31),阴性符合率为90%(18/20)。

表2 SYBR Green Ⅰ real-time PCR检测方法对胞内劳森菌临床样品的检测 Table 2 Detection of Lawsonia intracellularis in clinical samples by SYBR Green Ⅰ real-time PCR %
3 讨 论
PPE的实验室诊断方法目前主要包括涂片镜检法、血清学方法、细菌分离培养法、传统PCR等。涂片镜检法快速、简便,但特异性较差;胞内劳森菌的细胞培养法操作繁琐,且国内未见成功分离的报道。通过PCR技术检测粪便中的胞内劳森菌是目前最常用的适于屠宰前诊断PPE的方法[8,11],尽管该方法敏感性高、特异性强,且由于粪便中胞内劳森菌的含量不高,同时存在PCR抑制因子,因此可能造成一定的假阴性。改进的方法之一是建立敏感性更高、特异性更强的荧光定量PCR检测方法。荧光定量PCR与普通PCR相比,除了特异性更强、敏感性更高外,还可避免交叉污染[12],诊断的可靠性更高。TaqMan探针法和SYBR Green Ⅰ染料法是常见的2种实时荧光定量检测方式,后者具有引物设计方便、成本较低等特点,因此更适合疫病检测方法采用。基于上述原因,本研究建立了一套检测胞内劳森菌的SYBR Green Ⅰ real-time PCR方法。
为提高real-time PCR的敏感性,在引物设计上,选择了胞内劳森菌基因组中同源性较高的16S rDNA序列[13]为靶基因作参考序列。同时,通过对real-time PCR反应体系的优化,使该方法最低可检测到10拷贝/μL重组质粒DNA,与TaqMan法的检测灵敏度相当[14]。本研究建立的real-time PCR定量方法属于绝对定量,该定量方法与相对定量相比,具有获得基因绝对数量且不同试验结果可相互对比等优点[15]。为了检验real-time PCR方法的定量检测性能,采用了具有稳定、准确等特点[16]的质粒法制备标准曲线,并根据标准曲线建立了模板含量与循环次数的拟合曲线。结果显示在1.0×102~1.0×108拷贝/μL时,模板含量与Ct值之间有较好的线性关系,相关系数R2值为0.992。为检验建立的real-time PCR检测法在临床上的应用效果,对采集的51份疑似PPE病例样品进行了检测,结果显示该SYBR Green Ⅰ real-time PCR法对粪便及肠组织中胞内劳森菌的检出率均高于普通PCR,显示出临床应用价值。
总之,本研究建立的检测胞内劳森菌的SYBR Green Ⅰ real-time PCR方法特异性强、敏感度高,可用于小肠、粪便等样品中胞内劳森菌的定量检测。
[1] Jacobson M,Fellstrom C,Jensen-Waern M.Porcine proliferative enteropathy:An important disease with questions remaining to be solved [J].Veterinary Journal,2010,184(3):264-268.
[2] Jensen H M.Health management with reduced antibiotic use-experiences of a Danish pig vet [J].Animal Biotechnology,2006,17(2):189-194.
[3] Kroll J J,Roof M B,Hoffman L J,et al.Proliferative enteropathy:A global enteric disease of pigs caused byLawsoniaintracellularis[J].Anim Health Res Rev,2005,6(2):173-197.
[4] 黄 忠,宋长绪,王浩文,等.华南五省区猪增生性肠炎的血清学调查 [J].中国兽医科学,2006,36(9):748-751.
Huang Z,Song C X,Wang H W,et al.Serological investigation of porcine proliferative enteronitis in five provinces of South China [J].Veterinary Science in China,2006,36(9):748-751.(in Chinese)
[5] Wu Z,Ling Y,Tian D,et al.Seroprevalence ofLawsoniaintracellularisantibodies in intensive pig farms in China [J].BMC Veterinary Research,2014,10(1):100.
[6] 廖延雄.胞内劳森菌及其所致的增殖性肠病 [J].畜牧与兽医,2002,34(2):1-5.
Liao Y X.Lawsonia intracellularis and proliferative enteronitis [J].Animal Husbandry &Veterinary Medicine,2002,34(2):1-5.(in Chinese)
[7] 郑新添,杨小燕.猪增生性肠炎诊断技术研究进展 [J].中国畜牧兽医,2011,38(4):203-206.
Zheng X T,Yang X X.Progress in diagnostical techniques for porcine proliferative enteropathy [J].China Animal Husbandry and Veterinary Medicine,2011,38(4):203-206.(in Chinese)
[8] Vannucci F A,Gebhart C J.Recent advances in understanding the pathogenesis ofLawsoniaintracellularisinfections [J].Veterinary Pathology,2014,51(2):465-477.
[9] Jordan D M,Knittel J P,Roof M B,et al.Detection ofLawsoniaintracellularisin swine using polymerase chain reaction methodology [J].Journal of Veterinary Diagnostic Investigation,1999,11(1):45-49.
[10] 郑新添,杨小燕,陈 杰,等.猪增生性肠炎的PCR诊断 [J].黑龙江畜牧兽医,2010(1):117-118.
Zheng X T,Yang X X,Chen J,et al.Diagnosis of porcine proliferative enteritis by polymerase chain reaction [J].Heilongjiang Animal Science and Veterinary Medicine,2010(1):117-118.(in Chinese)
[11] Pedersen K S,Holyoake P,Stege H,et al.Diagnostic performance of different fecalLawsoniaintracellularis-specific polymerase chain reaction assays as diagnostic tests for proliferative enteropathy in pigs:A review [J].Journal of Veterinary Diagnostic Investigation,2010,22(4):487-494.
[12] 朱 捷,杨成君,王 军.荧光定量 PCR 技术及其在科研中的应用 [J].生物技术通报,2009(2):73-76.
Zhu J,Yang C J,Wang J.Real-time fluorescent quantitative PCR and application in scientific research [J].Biotechnology Bulletin,2009(2):73-76.(in Chinese)
[13] 谢丽华,张 宁,何苹萍,等.猪胞内劳森菌 16S rRNA 基因的克隆及序列分析 [J].中国兽医学报,2009,29(8):968-972.
Xie L H,Zhang N,He P P,et al.Cloning and sequencing analysis of 16S rRNA gene ofLawsoniaintracellularis[J].Chinese Journal of Veterinary Science,2009,29(8):968-972.(in Chinese)
[14] Nathues H,Holthaus K,Grosse Beilage E.Quantification ofLawsoniaintracellularisin porcine faeces by real-time PCR [J].Journal of Applied Microbiology,2009.
[15] 李 丽,赵成萍,李 宏,等.质粒制备绝对定量PCR标准曲线方法的建立 [J].农业生物技术学报,2011,19(6):1157-1162.
Li L,Zhao C P,Li H,et al.Establishment of the plasmid standard curve generation method for absolute quantification PCR [J].Journal of Agricultural Biotechnology,2011,19(6):1157-1162.(in Chinese)
[16] Zimmermann B,Holzgreve W,Wenzel F,et al.Novel real-time quantitative PCR test for trisomy 21 [J].Clin Chem,2002,48(2):362-363.
Establishment of SYBR Green Ⅰ real-time PCR assay for detection ofLawsoniaintracellularis
ZHENG Xin-tian,HUANG Cui-qin,HUANG Qi-chun,DAI Ai-ling,TAN Xiao-jun
(FujianProvincialKeyLaboratoryofPreventiveVeterinaryMedicineandVeterinaryBiotechnology,LongyanUniversity,Longyan,Fujian364000,China)
【Objective】 The present study established a SYBR Green Ⅰ real-time PCR assay for detection ofLawsoniaintracellularis.【Method】 16S rDNA gene ofL.intracellularis,amplified by PCR using specific primers was cloned to construct recombinant plasmid pT-LI-16S.With the plasmid pT-LI-16S as template,the real-time PCR assay for detection ofL.intracellulariswas established and its specificity,sensitivity and repeatability were evaluated.The method was also applied to 51 clinical samples of porcine proliferate enteritis.【Result】 The established assay had no cross reaction withE.coli,Salmonella,StaphylococcusaureusandHaemophilusparasuis.There was a good linear relationship between the template concentration and theCtvalue when the standard template concentration was in range of 1.0×102-1.0×108copies/μL.The detection limit was 10 copies/μL recombinant plasmid.The repeatability test indicated that the intra-variations were less than 2%.The positive rates ofL.intracellularisin fecal and intestine tissue were 46.9% and 84.2%,respectively,both were higher than the rates (40.7% and 78.9%) tested by conventional PCR.【Conclusion】 The established real-time PCR assay was specific,sensitive,accurate and suitable for the quick detection and quantity analysis ofL.intracellularis.Thus,it can be used to diagnose porcine proliferative enteritis.
Lawsoniaintracellularis;real-time PCR;porcine proliferative enteritis;diagnosis
时间:2015-11-11 16:16
10.13207/j.cnki.jnwafu.2015.12.006
2014-07-09
福建省教育厅A类项目(JA11247);福建省农业科技重点项目(2011N0025)
郑新添(1981-),男,福建上杭人,讲师,硕士,主要从事动物病原学研究。E-mail:zh-xintian@163.com
黄翠琴(1978-),女,福建宁化人,副教授,博士,主要从事兽医寄生虫学研究。 E-mail:Cuiqinh@126.com
S852.61;S858.283.21
A
1671-9387(2015)12-0029-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151111.1616.012.html
