猪繁殖与呼吸综合征病毒美洲型RT-LAMP检测方法建立
2015-01-03,,,,,,,,,
,,,,,,,,,
(北京出入境检验检疫局,北京 100113)
猪繁殖与呼吸综合征病毒美洲型RT-LAMP检测方法建立
蒲 静,汪 琳,尹 羿,柏亚铎,任 彤,张 伟,高志强,乌日古玛拉,时培蛟,肖春芳
(北京出入境检验检疫局,北京100113)
本研究针对猪繁殖与呼吸综合征病毒美洲型ORF6基因的6个区域,利用2对引物建立检测猪繁殖与呼吸综合征病毒的RT-LAMP快速检测方法,该方法具有高灵敏度,高特异性的优点,在2小时左右即可得出结果,其灵敏度与PRRSV荧光RT-PCR检测方法相近,高于普通RT-PCR检测方法。将灭活的猪繁殖与呼吸综合征病毒美洲型培养物作10倍系列稀释,结果显示建立的荧光RT-PCR的检测极限可达10-7,RT-PCR检测方法的检测极限为10-5,RT-LAMP检测方法达到10-8,表明建立的RT-LAMP检测方法非常灵敏,可用于检测猪组织样本中的美洲型猪繁殖与呼吸综合征病毒。
猪繁殖与呼吸综合征病毒;美洲型;RT-LAMP
猪繁殖和呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)以妊娠母猪流产,早产,产死胎、弱胎、木乃伊胎以及仔猪和肥育猪的呼吸道症状为特征[1,2]。猪繁殖和呼吸综合征病毒(PRRSV)是一种单股正链的RNA病毒,可分为两个基因型,即欧洲型和美洲型[3]。PRRSV 基因组长约15kb,具有9个开放阅读框架(ORFs)。常用的分子生物学方法为普通RT-PCR和荧光RTPCR,荧光RT-PCR是国际上公认快速准确的技术之一,但存在设备相对昂贵的缺点[4-7]。 等温扩增技术RT-LAMP不需要模板的热变性,扩增效率高,具有不需要特殊仪器、快速、特异性强的特点,而且结果判定简单。本研究针对美洲型PRRS病毒建立了RT-LAMP检测技术[8-9]。并通过特异性和灵敏度评价,进而用于临床样本检测,为现场检测美洲型PRRS病毒提供一种快速可靠的方法[10]。
1 材料与方法
1.1 主要试剂和仪器
TRIZOL,购自Invitrogen公司;AMV 反转录酶,dNTP购自Promega 公司;Bst DNA 聚合酶购自NEB 公司;betaine购自Sigma 公司;SYBR Green I 购自Invitrogen 公司;HNB(hydroxynaphthol blue),分子式C20H11N2Na3O11S3,M=620.47g/ Mol,购自Fluka公司;Taq DNA聚合酶和PCR相关试剂,购自Promega公司;PRRS病毒美洲型荧光RT-PCR检测试剂盒,本实验室研制;RNA酶抑制剂,购自Promega公司;无水乙醇,分析纯,-20 ℃ 预冷;75%乙醇,用新开启的分析纯无水乙醇和DEPC 水(符合GB 6682-92 要求)配制,-20 ℃预冷。
台式冷冻高速离心机(离心速度可达12 000 r/ min);台式电子天平;常规PCR仪;荧光PCR检测仪(ABI 7900HT,Roche 1.1);离心机(离心速度3 000 r/min)。
1.2 灭活病毒及核酸
检测方法研究中用病毒株及其来源如表1所列。

表1 各种病毒种类
1.3 病毒RNA提取
向加有600μL裂解液的灭菌离心管中加入待测样本200μL,用吸头反复抽吸混匀;再加入200μL氯仿,混匀器上振荡混匀5s或颠倒混匀15次(不宜过于强烈,以免产生乳化层);12000g离心 15min;另取灭菌离心管,加入600μL异丙醇(-20℃预冷),并加入上述离心后的上层液相(注意不要吸出中间层,该层富含DNA和蛋白质),颠倒混匀;12000g离心15min;轻轻倒去上清,倒置于吸水纸上,吸干液体;加入600μL 75%乙醇(-20℃预冷),颠倒洗涤;12000g离心10min;轻轻倒去上清,倒置于吸水纸上,尽量吸干液体;离心5s,将管底部少量液体用微量加样器吸干。室温干燥5min;干燥后于沉淀中加11μL DEPC水,轻轻混匀,溶解管壁上的RNA(即为所需RNA)。
1.4 引物设计
为确保探针的保守性和特异性,我们针对目前已知的3个不同亚群的猪繁殖与呼吸综合征病毒核酸[11],选取ORF6基因编码区特定序列作为靶区域,应用DNAMAN在多重序列比对的基础上,设计引物(图1,表2)。引物FIP和BIP针对的2个扩增区域之间用TTTT进行连接,以便于扩增时成环。
1.5 引物筛选
将上述引物对进行试验。根据采用的反应体系(表3),猪繁殖与呼吸综合征病毒美洲型07-14提取RNA后,将RNA以1:104稀释后,进行RT-LAMP检测,反应参数为60℃/60min,80℃/15min。
1.6 RT-LAMP反应体系的建立与优化
1.6.1 反应物浓度优化
MgSO4、betaine、dNTP的浓度以及反应时间和温度对LAMP反应效率有一定影响,通过逐一优化,确定反应体系和条件。
1.6.2 反应温度和时间的优化
对反应温度和时间都进行了优化试验,以期达到最佳扩增效率,主要比较了以下几种循环条件的扩增效率。
方法A - 60℃:60min,80℃ 15min;
方法B - 60℃:90min,80℃ 15min;
方法C - 60℃:120min,80℃ 15min;
方法D - 62℃:120min,80℃ 15min;
方法E - 50℃:15min,60℃:120min,80℃ 15min。
1.7 灵敏度试验
将猪繁殖与呼吸综合征病毒07-14核酸作10-1~10-8稀释,分别用RT-LAMP,普通RT-PCR和荧光RT-PCR检测,比较方法的灵敏度。
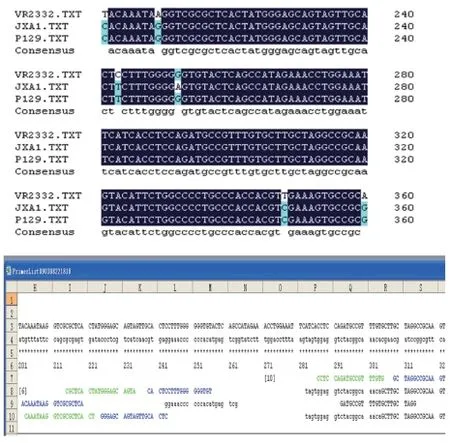
图1 猪繁殖与呼吸综合征病毒美洲型3个不同亚群的的序列比对和引物设计
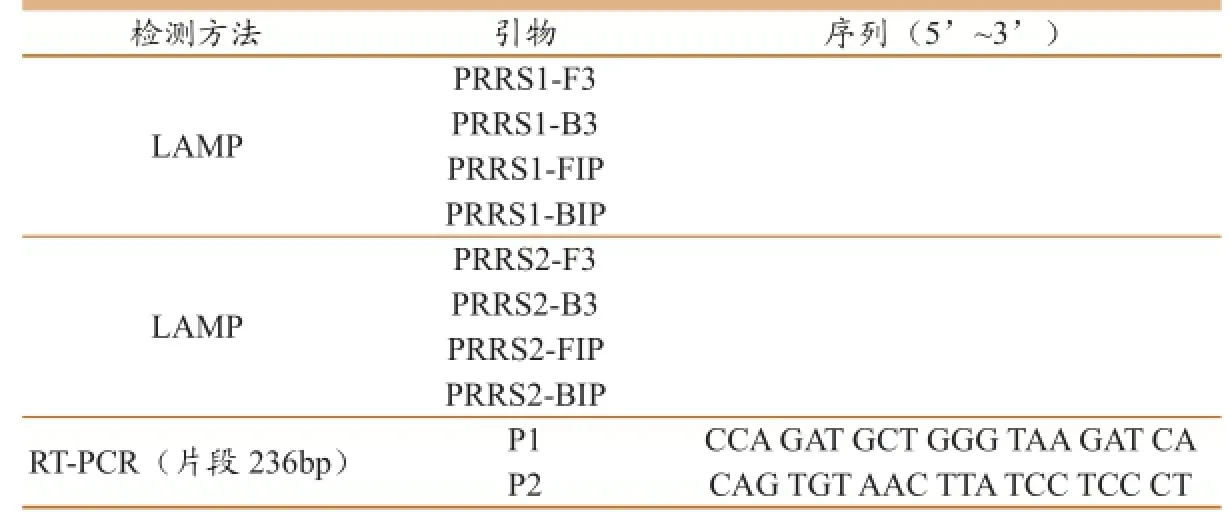
表2 研究过程中涉及引物名称、序列
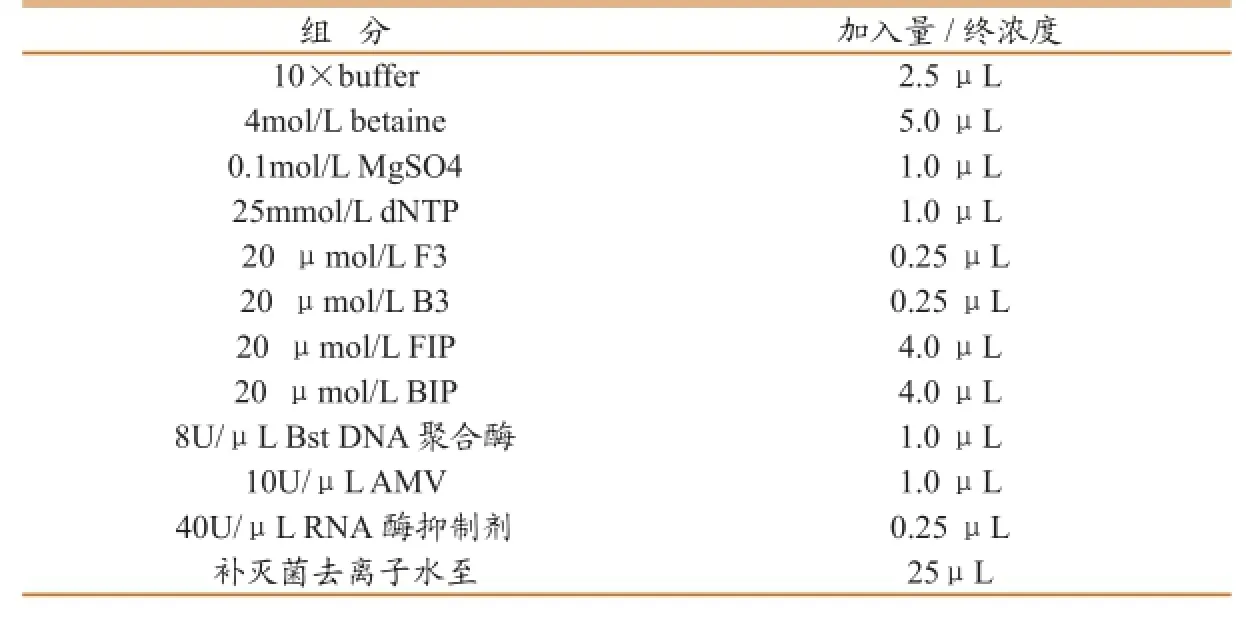
表3 RT-LAMP反应体系
1.8 特异性试验
用所建立的方法对欧洲型PRRS病毒LV核酸、猪伪狂犬病病毒核酸、猪瘟病毒C株核酸和猪链球菌2型ZY株核酸,分别进行检测,验证方法的特异性。
1.9 重复性试验
连续3次分别用建立的RT-LAMP检 测 方 法 10-5、10-6、10-7稀 释 病 毒07-14核酸的进行重复性试验,验证方法的可重复性和稳定性。
1.10 快速显色研究
在建立RT-LAMP检测方法基础上,分别将SYBR Green I 和HNB两种染色液加入反应体系,比较显色情况。SYBR Green I购买后直接使用;HNB为粉末,称量0.946g,用DEPC水定容于50mL离心管中。取6管1.5mL离心管,每管加入900μL DEPC水,再分别加入100μL 30mmol/L HNB;配成3mmol/L HNB溶液。
1.11 临床样品检测
2006—2007年某地区数个规模化猪场采集的病料(各种内脏和肌肉组织)49份应用建立的RT-LAMP方法进行检测,并与荧光RT-PCR和常规RT-PCR检测方法进行比较。
2 结果
2.1 引物筛选结果
采用上述条件,筛选出能检出所用3株美洲型病毒核酸,且扩增稳定的引物对:PRRS2-F3,PRRS2-B3,PRRS2-FIP,PRRS2-BIP。
2.2 反应体系优化结果
按照GB/T19438.1所叙方法提取病毒RNA。由于MgSO4,betaine,dNTP的浓度以及反应时间和温度对LAMP反应效率有一定影响,通过逐一优化,确定了如下反应体系和条件(表4)。
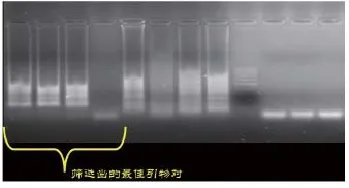
图2 引物筛选试验结果
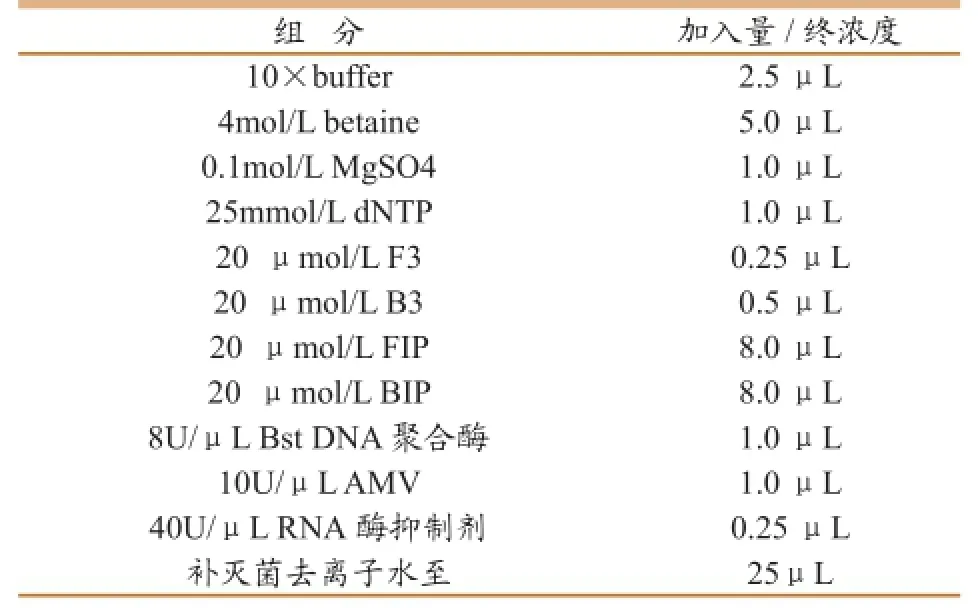
表4 建立的RT-LAMP反应体系
2.3 反应温度和时间优化
采用5种条件对相同的反应体系进行扩增,效率相近,因此选择效果最好的等温方法,即以方法C作为等温扩增时的反应条件。
2.4 灵敏度试验
将病毒07-14核酸作10-1~10-8稀释,应用建立的RT-LAMP检测,显示该方法的灵敏度达到10-8(图3)。用建立的方法与荧光定量RT-PCR方法和常规RT-PCR方法进行比较,表明建立的方法灵敏度与荧光定量RT-PCR方法相近,但明显高于常规RT-PCR检测方法(图6)。

图3 RT-LAMP对病毒07-14核酸检测灵敏度
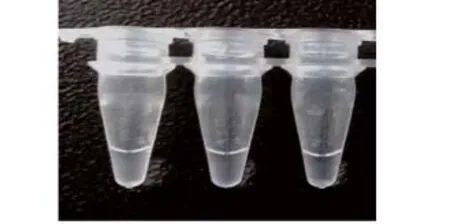
图4 反应结束后,阳性扩增可见明显的混浊(左侧2管),阴性反应清亮(右侧1管)
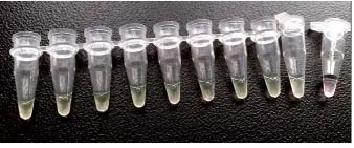
图5 反应结束后,加入SYBR Green I进行染色的结果

图6 RT-LAMP与荧光定量RT-PCR方法和常规RT-PCR方法的比较
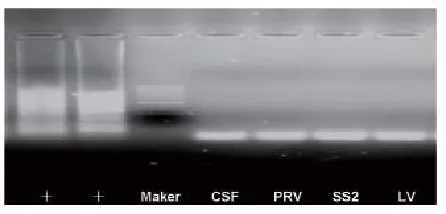
图7 建立的RT-LAMP的特异性试验结果
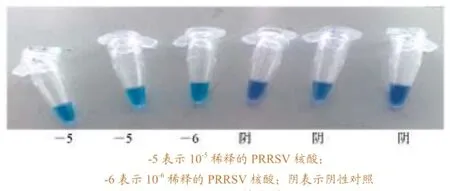
图8 HNB染色结果
2.5特异性试验
用所建立的方法对欧洲型PRRS病毒LV核酸、猪伪狂犬病病毒核酸、猪瘟病毒C株核酸和猪链球菌2型ZY株核酸分别进行检测,验证方法的特异性。结果显示本法特异性良好,无交叉反应(图7)。
2.6 重复性试验结果
连续3次分别用建立的RT-LAMP检测方法10-5,10-6,10-7稀释病毒07-14核酸的进行重复性试验,以验证方法的可重复性和稳定性。结果显示3个稀释度的病毒核酸均为阳性,重复性好。
2.7 快速显色研究
在建立RT-LAMP检测方法基础上,分别将SYBR Green I 和HNB两种染色液加入反应体系,比较显色情况。结果显示SYBR Green I在反应前加入反应体系影响扩增结果,且显色明显程度不如HNB。而HNB在反应前加入反应体系不影响扩增效果(图8)。
2.8 临床样品检测结果
2006—2007年某地区数个规模化猪场采集的病料(各种内脏和肌肉组织)49份应用建立的RT-LAMP方法进行检测,并与荧光RTPCR和常规RT-PCR检测方法进行比较。结果显示RT-LAMP与荧光RTPCR结果完全一致,符合率100%,检出率高于普通RT-PCR检测结果(表5)

表5 49份临床样品的检测结果
3 讨论
猪繁殖与呼吸综合征于1987年首先出现于美国[12],20多年来特别是2006年发生于我国的高致病性PRRS,给养猪业造成巨大经济损失而引起了科学界的关注[13-15]。
PRRS 的诊断方法有多种[16],往往依据临床症状和病理变化只可做出初步诊断,所以还应该根据实验室诊断技术加以确诊。对于病原检测,目前常用方法为病毒分离鉴定、抗原捕获检测和分子生物学检测方法[17-20]。有报道用定量TaqMan RT-PCR 方法检测PRRSV,通过与其它方法比较发现,在省时、易用性、敏感性及特异性上都有很不错的表现,而且不仅能够减少交叉污染的风险,还能区分不同的毒株[21-23]。我们通过运用建立的方法对猪瘟病毒核酸、伪狂犬病毒核酸以及猪链球菌2型核酸进行检测,无交叉反应,表明特异性良好。试验中还发现LAMP由于产物量大,开盖检测很容易发生气溶胶污染,因此需要更为严格的实验室管理措施,尽量做到不开盖检测。
本研究中,应用建立的方法对49份临床样本进行了检测,结果显示建立的RT-LAMP检测方法与荧光RT-PCR试验结果完全一致。
[1]Albina E. Epidemiology of porcine reproductive and respiratory syndrome(PRRS):an overview[J].Vet Microbiol,1997,55(1-4):309-316.
[2]Allende R,Kutish G F,Laegreid W,et al. Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J]. Arch Virol,2000,145(6):1149-1161.
[3]Allende R,Lewis T L,Lu Z,et al. North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions[J]. J Gen Virol,1999,80(2):307-315.
[4]Andreyev V G,Wesley R D,Mengeling W L,et al. Genetic variation and phylogenetic relationships of 22 porcine reproductive and respiratory syndrome virus(PRRSV)field strains based on sequence analysis of open reading frame 5[J]. Arch Virol. 1997,142(5):993-1001
[5]Asagoe T,Inaba Y,Jusa E R,et al. Effect of heparin on infection of cells by equine arteritis virus[J]. J Vet Med Sci,1997,59(8):727-728.
[6]Bautista E M,Faaberg K S,Mickelson D,et al. Functional properties of the predicted helicase of porcine reproductive and respiratory syndrome virus[J]. Virol,2002,298(2):258-270.
[7]Bautista E M,Goyal S M,Collins J E. Serologic survey for Lelystad and VR-2332 strains of porcine respiratory and reproductive syndrome(PRRS)virus in US swine herds[J]. J Vet Diagn Invest,1993,5(4):612-614.
[8]Chang C C,Yoon K J,Zimmerman J J,et al. Evolution of porcine reproductive and respiratory syndrome virus during sequential passages in pigs[J]. J Virol,2002,76(10):4750-4763.
[9]Cheon D S,Chae C. Antigenic variation and genotype of isolates of porcine reproductive and respiratory syndrome virus in Korea[J]. Vet Rec,2000,147(8):215-218.
[10]Cheon D S,Chae C. Restriction fragment length polymorphism analysis of open reading frame 5 gene of porcine reproductive and respiratory syndrome virus isolates in Korea[J]. Arch Virol,2000,145(7):1481-1488.
[11]Chung W B,Lin M W,Chang W F,et al. Persistence of porcine reproductive and respiratory syndrome virus in intensive farrow-to-fi nish pig herds[J]. Can J Vet Res,1997,61(4):292-298.
[12]Conzelmann K K,Visser N,Van Woensel P,et al. Molecular characterization of porcine reproductive and respiratory syndrome virus,a member of the arterivirus group[J]. Virology,1993,193(1):329-339.
[13]Dea S,Gagnon C A,Mardassi H,et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome(PRRS)virus:comparison of the North American and European isolates[J]. Arch Virol,2000,145(4):659-688.
[14]Dea S,Sawyer N,Alain R,et al. Ultrastructural characteristics and morphogenesis of porcine reproductive and respiratory syndrome virus propagated in the highly permissive MARC-145 cell clone[J]. Adv Exp Med Biol,1995,380:95-98.
[15]Dee S A,Torremorell M,Rossow K,et al. Identifi cation of genetically diverse sequences(ORF 5)of porcine reproductive and respiratory syndrome virus in a swine herd[J]. Can J Vet Res,2001,65(4):254-260.
[16]Delputte P L,Vanderheijden N,Nauwynck H J,et al. Involvement of the matrix protein in attachment of porcine reproductive and respiratory syndrome virus to a heparin-like receptor on porcine alveolar macrophages[J].J Virol,2002,76(9):4312-4320.
[17]Dobbe J C,van der Meer Y,Spaan W J,et al. Construction of chimeric arteriviruses reveals that the ectodomain of the major glycoprotein is not the main determinant of equine arteritis virus tropism in cell culture[J]. Virol,2001,288(2):283-294.
[18]Drew T W. A review of evidence for immunosuppression due to porcine reproductive and respiratory syndrome virus[J]. Vet Res,2000,31(1):27-39.
[19]Duan X,Nauwynck H J,Favoreel H W,et al. Identifi cation of a putative receptor for porcine reproductive and respiratory syndrome virus on porcine alveolar macrophages[J]. J Virol,1998,72(5):4520-4523.
[20]Snijder E J,Meulenberg J J M. The molecular biology of arteriviruses[J].J Gen Virol,1998,79(5):961-979.
[21]Faaberg K S,Elam M R,Nelsen C J,et al. Subgenomic RNA7 is transcribed with different leader-body junction sites in PRRSV(strain VR2332)infection of CL2621 cells[J]. Adv Exp Med Biol,1998,440:275-279.
[22]Fernandez A,Suarez P,Castro J M,et al. Characterization of regions in the GP5 protein of porcine reproductive and respiratory syndrome virus required to induce apoptotic cell death[J]. Virus Res,2002,83(1/2):103-118.
[23]Forsberg R,Storgaard T,Nielsen H S,et al. The genetic diversity of European type PRRSV is similar to that of the North American type but is geographically skewed within Europe[J]. Virol,2002,299(1):38-47
Development of an RT-LAMP Assay for Detection of American Type Porcine Reproductive and Respiratory Syndrome Virus(PRRSV)
Pu Jing,Wang Ling,Ying Yi,Bo Yaduo,Zhang Wei,Gao Zhiqiang,Wurigumala,Shi Peijiao,Xiao Chunfang(Beijing Exit-Entry Inspection and Quarantine Bureau,Beijing 100113)
Two pairs of primers targeting six regions of American-type porcine reproductive and respiratory syndrome virus ORF6 gene,and RT-LAMP assay was established for the rapid detection of porcine reproductive and respiratory virus with high sensitivity and specifi city. It could be fi nished in about 2 hours. The sensitivity of the assay was similar to PRRSV fluorescent RT-PCR,and higher than the normal RT-PCR. The inactivated porcine reproductive and respiratory syndrome virus culture was serially diluted in 10-folds,and tested with PRRSV fl uorescent RT-PCR,RTLAMP assay and normal RT-PCR. The result showed that the fl uorescence RT-PCR detection limit was up to 10-7,the normal RT-PCR detection limit was 10-5,and the RT-LAMP detection limit was 10-8,indicating RT-LAMP assay was very sensitive. The assay could be used for rapid detection of the American-type porcine reproductive and respiratory syndrome virus in various pig tissue samples.
porcine reproductive and respiratory syndrome;American- type virus;RT-LAMP
S852.651
:A
:1005-944X(2015)02-0057-06
国家质检总局科技计划项目(2013IK027)资助
:蒲静
