脉冲强光技术在食品工业中的应用与展望
2014-12-25唐明礼陈妍婕王晓琳刘丽霞王勃刘贺何余堂惠丽娟马涛
唐明礼,陈妍婕,王晓琳,刘丽霞,王勃,刘贺,何余堂,惠丽娟,马涛
(渤海大学化学化工与食品安全学院,渤海大学粮油科学与技术研究所,辽宁锦州,121013)
脉冲强光(PL)是新兴的冷杀菌加工技术,可减少健康风险并保持食品原有品质和营养价值。1999年,PL已获得美国药品食品监督管理局(FDA)批准在食品加工、生产处理等方面的应用[1]。PL技术利用高能量(高达35MW)、瞬时(10-2~10-3ms)、广光普(200~1 100 nm)来灭活微生物[2-6],其灭活机制主要来自于UV-C光化学效应形成的胸腺嘧啶二聚体阻止了DNA复制,红外的热效应使光修复机能失活,以及水分的蒸发对膜结构的破坏[7-9],图1为PL杀菌装置和原理图,PL表面杀菌实验柜由动力单元、惰性气体灯单元、处理室和自动控制单元组成,它的工作电压为2 800V,脉冲能量100~500J,脉冲次数为0~100次,频次每秒可达4次,PL自动化程度高、操作简单,将样品均匀地分布在无菌的石英板上,通过调整石英板来实现样品与脉冲氙灯之间的距离,根据实验条件对操作界面进行参数设置达到实验所需条件。与紫外系统相比,PL具有较大的输入能量,非常短的时间内可在食品表面产生大量的能量,但根据FDA法规,脉冲光强光处理食品的能量密度不能超过12 J/cm2[10]。PL 具有成本效益、高处理系统、纳入生产线能力、处理时间短、无化学物质残留、FDA承认可用于包装材料的处理、保持食品的原有属性、非常短的时间内微生物的数量显著降低等特点[11],表明PL是很有潜能的工具来减少食品表面、包装材料、加工环境中的致病菌及腐败菌。
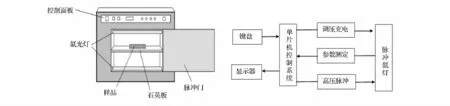
图1 PL杀菌装置及原理图Fig.1 PL sterilization devices and schematics
1 PL的影响因素
预防食品污染是食品生产中的重要问题,PL杀菌是复杂的过程,针对特定食品及微生物,需了解影响PL杀菌效果的影响因素,以此优化PL参数设置,保证微生物安全,提高食用安全性。
1.1 微生物对PL的敏感性不同
PL处理刀片表面接种的单细胞增生李斯特菌和大肠杆菌,处理后单细胞增生李斯特菌减少4.57个log值,大肠杆菌可减少4.62个 log值[12],这表明大肠杆菌比单细胞增生李斯特菌具有较强的耐受性。Levy等[13]报道了 PL对不同微生物杀菌效果的影响,白色念珠菌和酿酒酵母细胞较其他菌株细胞如蜡样芽胞杆菌等对脉冲光抵抗性较强,与细菌相比,细菌的芽孢比营养细胞抵抗性强,蜡状芽孢杆菌孢子和巨大芽孢杆菌孢子抵抗性较强,黑曲霉的孢子是所测试微生物中耐受性最强的。Anderson等[14]也得出细菌芽孢比营养细胞的失活需要更强烈的照射、热效应以及脉冲光处理的结论,不同微生物对脉冲敏感性的程度为革兰氏阴性菌>革兰氏阳性菌>真菌孢子。
1.2 PL设置参数影响其杀菌效果
脉冲次数对杀菌效果的影响。Cheigh等[15]研究了PL对固体培养基上单细胞增生李斯特菌的影响,杀灭效果与脉冲次数呈正比,在每次脉冲1.75 J/cm2条件下,脉冲300次可减少4个log值,增加次数为900次时,其数量可减少6个log值。杀灭效果随脉冲次数增加而增强的趋势也适用于真空包装的鸡柳上的鼠伤寒沙门氏菌和肠炎沙门氏菌[16]。
脉冲时间对杀菌效果的影响。脉冲时间2 s时大肠杆菌、肠炎沙门氏菌即可全部灭活,空肠弯曲菌由原来的6.89降到0.60个log值,30s全部死亡,同时也说明空肠弯曲菌具有较强的抵抗性[17]。Keklik等[18]应用不同的时间及距离等条件对鸡肉香肠表面的李斯特菌进行了杀菌效果研究,处理时间60s,未包装和真空包装的香肠表面可分别减少1.5和1.6个log值。
PL光谱范围对杀菌效果的影响。300 nm以上脉冲光在能量密度0.2~1.75 J/cm2条件下处理琼脂上枯草芽孢杆菌孢子的灭菌率将近0,而全光谱可减少6个log值;300 nm以上、能量密度1.5 J/cm2,黑曲霉数量减少2个log值,全光谱减少将近6个log值。这表明300 nm以下的光谱在PL杀菌中扮演重要的作用[13]。
脉冲电压对杀菌效果的影响。对输入电压1、1.5、2、2.5kV,对琼脂上枯草芽孢杆菌进行了测试,随着输入电压的增加,其减少的对数值也在逐渐增加。2.5kV处理电压其数量可减少6个 log值[13],Schaefer等[19]研究发现,脉冲处理中减少输入电压可减少UV-C的百分含量。
此外,不同的基质也可影响其效果,已经证实PL对固体表面灭菌比液体更有效[20]。
2 PL应用领域及研究进展
PL对减少食品表面微生物、提高食用品质方面具有积极的影响。PL能有效灭活金黄色葡萄球菌、大肠杆菌、沙门氏菌、隐孢子虫等大量微生物,广泛用于食品工业中,主要包括牛奶、果汁、蔬菜、水果、鸡蛋、牛肉、香肠等。
2.1 PL在果蔬中的应用及研究进展
我国是最大的果蔬生产国和果蔬制品加工基地,但病原微生物和腐败微生物可引起果蔬的食品安全、腐烂变质等问题[21],病原微生物引起的食物中毒也逐渐增加,严重危害人类的安全。
减少微生物的污染、保持产品品质、延长货架期是果蔬加工过程中的关键。Xu等[22]对大葱进行表面和浸蘸接种分别模拟操作者手臂不卫生、加工处理和冲洗过程造成的污染,PL对大葱根和茎表面接种的大肠杆菌进行了处理,结果发现脉冲对表面接种的大肠杆菌杀菌效果显著,其数量可减少4.1~5.2个log值。浸蘸接种的大肠杆菌杀菌效果较差,原因是细菌能够随着接种液流到葱叶内部和茎上紧密层次的凹陷中,这将保护细菌避免强光的危害。用能量密度2.68和5.36 J/cm2脉冲光处理番茄,表面微生物显著减少,脉冲处理的番茄在处理3 d之后,表面出现褶皱、变软及重量损失,但整个贮藏过程抗血酸含量保持不变,脉冲处理可减少腐败菌的数量不会降低营养价值[23]。Oms-Oliu等[7]研究了 PL 对鲜切蘑菇质量和抗氧化性质的影响,当使用4.8、12、28J/cm2脉冲光处理蘑菇时,微生物的数量可减少0.6~2.2个log值,在4.8J/cm2处理条件脉冲光强光能够延长鲜切蘑菇的货架期,没有显著影响其质构和抗氧化性质。肠炎沙门氏菌已是多数蛋类污染爆发的致病菌,它既可分布在鸡蛋的表面也可通过蛋壳的气孔进入鸡蛋内部,严重影响其食用安全性。为此,Hierro等[24]研究了PL对鸡蛋表面肠炎沙门氏菌的影响。在0.7J/cm2脉冲光处理鸡蛋,数量可减少6.7个log值。并且随着脉冲能量的增加,沙门氏菌的数量逐渐减少。
尤其对于鲜切果蔬,切割降低了果蔬对外界环境的抵抗能力以及加工工具上的微生物增加了侵染机会。PL可减少微生物与果蔬组织接触的机会,有效预防鲜切果蔬的腐败变质问题。
2.2 PL在即食肉制品中的应用及研究进展
即食肉制品随着快捷、简单等现代生活方式的改变,其消耗量逐年增加,即食肉制品主要包括火腿、香肠、猪肉和牛肉等。但工具、操作者及机械设备上的环境微生物可能污染这些产品,对消费者安全构成威胁。这些微生物主要包括大肠埃希菌、沙门氏菌、李斯特菌及金黄色葡萄球菌等致病菌及酵母菌、霉菌等腐败菌[25-27]。致病菌可引起食源性疾病,腐败微生物可导致食品感官品质的下降,如质构改变、弹性变差、异味和褪色等[28-29]。为减少相关疾病的发生,采用PL技术最大程度使它们失活。
为提高即食肉制品的安全性及延长货架期,采用PL对食品进行处理。从图2可知,不同微生物的灭活率与脉冲能量成正比。图2-a~图2-b[30]显示香肠和里脊片中李斯特菌和鼠伤寒沙门氏菌数量最大减少1.5~1.8个log值,鼠伤寒沙门氏菌比单细胞增生李斯特菌具有较强的抵抗性。但随着能量的增加,这种差异性逐渐减少。图2-c~图2-d[31]为PL对火腿和腊肠李斯特菌的影响,数量最大减少值为1.78和1.11个log值,腊肠具有较低的灭菌率,原因是腊肠是一种乳胶体,提供了很多的裂缝,这保护了细菌免受光的危害。产品的表面形态极大程度地影响了脉冲光强光的灭菌效果[32]。脉冲后直接计数、黑暗条件下4h,结果并没有显著性差异,说明李斯特菌无光复活现象。图2-d[33]可知,牛肉片中大肠杆菌的最大减少量为1.2个log值,沙门氏菌可减少1个log值,单细胞增生李斯特菌可减少0.8个log值。
连续照射后病原微生物减少的对数值在不同的肉产品之间不同。原因可能是肉的不同成分影响脉冲光的灭菌效果,肉中脂肪和蛋白质含量增加,PL处理效果降低[20]。

图2 不同种类微生物在脉冲处理后的数量变化情况Fig.2 Effect of PL treatment on the reduction of microbial population[31-34]
PL在杀灭微生物时是否对产品的色泽、风味、氧化程度等造成影响,表1列出了脉冲对理化性质的影响。

表1 脉冲处理对肉制品理化性质的影响Table 1 Effect of PL treatment on physicochemical properties of meat
根据以上研究可知,不同产品在处理及贮藏中颜色均有一定程度的变化,Faustman等[35-37]认为,肉的褪色可能由于表面水分流失、血红素氧化和血红蛋白变化造成的。但keklik等[16]发现轻微及中度的脉冲处理,并没有观察到真空和无包装的鸡脯肉颜色参数发生显著性变化。样品硬度的降低主要是由于脉冲使火腿组织被破坏的缘故,可溶性蛋白、肌原纤维蛋白及火腿的结缔组织都会影响火腿的硬度[34]。脉冲光处理的样品氧化过程较快,可能是热效应促进其氧化,并且氧化反应产生的过氧化物也使肉中脂质的氧化稳定性降低[38]。相反,Elmnasser等[39]叙述了 PL并不能引起脂质的氧化。
脉冲能否显著影响色泽及感官性质还取决于产品的类型及性质。所以在保证较好杀菌效果的同时,应减少处理剂量来保持产品的感官品质。
2.3 PL在食品包装方面的应用及研究进展
对食品包装材料灭菌来满足食品微生物安全及延长货架期。常使用过氧化氢等化学试剂或联合热处理对包装材料进行杀菌,但包装材料表面可残留化学物质,这不仅会改变包装食品的性质,还危害消费者的健康,因此食品行业寻求非化学方法来对食品包装材料灭菌[40]。PL可对包装材料进行杀菌处理,而且处理的效果较明显。Keklik等[16]对包装材料进行较温和的处理,发现包装材料的力学性能发生了很小的变化,这表明脉冲光可在食品包装灭活表面的致病菌及腐败菌。为比较不同材料上微生物的灭活率以期获得脉冲光在包装材料中的应用,表2为PL对不同材料的处理结果。

表2 PL对食品包装材料的杀菌效果Table 2 Effect of PL sterilization on food packaging materials
材料表面性质如凹凸度、粗糙度、反射率等都会影响PL的杀菌效率,原因是表面的粗糙度及裂缝在处理期间可保护细胞。通过Haughton等人可看出PVC较其他材料可取得较大的灭菌率,更适宜脉冲处理,聚苯乙烯与其他材料相比表面具有更多的多孔性质,不锈钢表面较光滑均不适宜脉冲光处理。通过Ringus等[42]研究发现,EP、MET 有微米范围的粗糙度,可允许细菌细胞隐藏其中,具有较低的灭菌率,不适合脉冲处理。UV光可减少表面材料的疏水性,改变了材料的表面结构。由于PL含有一定量的紫外线,为了解脉冲光对包装材料的影响,应检测材料的结构、表面疏水性、透气率等是否变化。
3 PL技术的应用前景与展望
由病原微生物引起的食物中毒是食品加工最为重视的问题,PL也获得美国药品食品监督管理局(FDA)批准在食品加工、生产及处理方面的应用,同时PL具有操作安全、杀菌均匀、减少环境污染等优点。随着该杀菌技术和设备的成熟,也可用于加工设备的杀菌,取得了显著的社会和经济效益,因为设备的不适当清洗以及不良的卫生状态,最终污染食品。为实现PL工业化应用,需积累大量可靠的数据,以保证食品的微生物安全,实现PL的规模化、商业化。
虽然PL比传统热杀菌具有明显的优势,能够最大程度保持食品的营养成分,但想要取得规模应用和商业成功,还有许多问题需要研究和解决。PL是表面杀菌,对产品的厚度有要求,表面死亡的菌体及产品表面凹凸度对下面的微生物起到一定的保护作用,导致杀菌率降低,PL作为一种新型技术,为满足消费者对食品的质量及安全性要求,PL可以与臭氧、微生物防腐剂等其他杀菌技术串联使用来取得较好的杀菌效果[43];PL也可引起杀菌产品表面温度升高,Ringus等[41]应用PL处理食品包装材料,当处理能量为8 J/cm2时,表面温度增加了2~3℃;Wambura等[34]使用PL处理将近20℃的切片火腿,当火腿距离氙灯4.5、8.3、14.6 cm、处理60 s,温度分别增加到 38、37和31℃。所以当处理热敏性物质时,应该考虑降低PL的处理能量,延长处理时间。随着科学技术的发展,PL将逐渐克服上述缺点并趋于成熟完善。
除了微生物杀菌,PL脉冲强光技术应向基因工程、细胞工程等高技术领域渗透,可应用于植物和微生物育种方面,PL处理可能诱发细菌菌落特征和细胞形态变异、生物体遗传物质结构的改变,从而培育成新的优良品种。
PL能有效控制食品中的有害微生物,一定程度可预防和控制微生物危害发生的风险,保障了消费者健康,提升了食品质量安全。同时企业也可以引进此技术,保证食品安全,最大程度造福于人类,PL将会在食品领域发挥更大的作用,有着更为广阔的应用空间及发展前景。
[1] Funes G J,Gómez P L,Resnik S L,et al.Application of pulsed light to patulin reduction in McIlvaine buffer and apple products[J].Food Control,2013,30(2):405-410.
[2] Bolton J R.Calculation of ultraviolet fluence rate distributions in an annular reactor:significance of refraction and reflection[J].Water Research,2000,34(13):3 315-3 324.
[3] Gómez-López V M,Ragaert P,Debevere J,et al.Pulsed light for food decontamination:a review[J].Trends in Food Ccience& Technology,2007,18(9):464-473.
[4] Takeshita K,Shibato J,Sameshima T,et al.Damage of yeast cells induced by pulsed light irradiation[J].International Journal of Food Microbiology,2003,85(1):151-158.
[5] Rowan N J,MacGregor S J,Anderson J G,et al.Pulsedlight inactivation of food-related microorganisms[J].Applied and Environmental Microbiology,1999,65(3):1 312-1 315.
[6] WANG T,MacGregor S J,Anderson J G,et al.Pulsed ultra-violet inactivation spectrum of Escherichia coli[J].Water Research,2005,39(13):2 921-2 925.
[7] Oms-Oliu G,Aguiló-Aguayo I,Martín-Belloso O,et al.Effects of pulsed light treatments on quality and antioxidant properties of fresh-cut mushrooms(Agaricus bisporus)[J].Postharvest Biology and Technology,2010,56(3):216-222.
[8] McDonald K F,Curry R D,Clevenger T E,et al.The development of photosensitized pulsed and continuous ultraviolet decontamination techniques for surfaces and solutions[J].Plasma Science,IEEE Transactions on,2000,28(1):89-96.
[9] Wekhof A,Trompeter F J,Franken O.Pulsed UV disintegration(PUVD):a new sterilisation mechanism for packaging and broad medical-hospital applications.[C].The First International Conference on Ultraviolet Technologies,Washington,2001
[10] Fernández M,Ganan M,Guerra C,et al.Protein oxidation in processed cheese slices treated with pulsed light technology[J].Food Chemistry,2014,159:388-390.
[11] Luksiene Z,Gudelis V,Buchovec I,et al.Advanced high-power pulsed light device to decontaminate food from pathogens:effects on Salmonella typhimurium viability in vitro[J].Journal of Applied Microbiology,2007,103(5):1 545-1 552.
[12] Rajkovic A,Tomasevic I,Smigic N,et al.Pulsed UV light as an intervention strategy against Listeria monocytogenes and Escherichia coli O157:H7 on the surface of a meat slicing knife[J].Journal of Food Engineering,2010,100(3):446-451.
[13] Levy C,Aubert X,Lacour B,et al.Relevant factors affecting microbial surface decontamination by pulsed light[J].International Journal of Food Microbiology,2012,152(3):168-174.
[14] Anderson J G,Rowan N J,MacGregor S J,et al.Inactivation of food-borne enteropathogenic bacteria and spoilage fungi using pulsed-light[J].Plasma Science,IEEE Transactions on,2000,28(1):83-88.
[15] Cheigh C I,Hwang H J,Chung M S.Intense pulsed light(IPL)and UV-C treatments for inactivating Listeria monocytogenes on solid medium and seafoods[J].Food Research International,2013,54(1):745-752.
[16] Keklik N M,Demirci A,Puri V M.Decontamination of unpackaged and vacuum-packaged boneless chicken breast with pulsed ultraviolet light[J].Poultry Science,2010,89(3):570-581.
[17] Haughton P N,Lyng J G,Morgan D J,et al.Efficacy of high-intensity pulsed light for the microbiological decontamination of chicken,associated packaging,and contact surfaces[J].Foodborne Pathogens and Disease,2011,8(1):109-117.
[18] Keklik N M,Demirci A,Puri V M.Inactivation of listeria monocytogenes on unpackaged and vacuum-packaged chicken frankfurters using pulsed UV-light[J].Journal of Food Science,2009,74(8):M431-M439.
[19] Schaefer R,Grapperhaus M,Schaefer I,et al.Pulsed UV lamp performance and comparison with UV mercury lamps[J].Journal of Environmental Engineering and Science,2007,6(3):303-310.
[20] Roberts P,Hope A.Virus inactivation by high intensity broad spectrum pulsed light[J].Journal of Virological Methods,2003,110(1):61-65.
[21] 关文强,李淑芬.天然植物提取物在果蔬保鲜中应用研究进展[J].农业工程学报,2006,22(7):200-204.
[22] XU W,CHEN H,HUANG Y,et al.Decontamination of Escherichia coli O157:H7 on green onions using pulsed light(PL)and PL-surfactant-sanitizer combinations[J].International Journal of Food Microbiology,2013,166(1):102-108.
[23] Aguiló-Aguayo I,Charles F,Renard C M G C,et al.Pulsed light effects on surface decontamination,physical qualities and nutritional composition of tomato fruit[J].Postharvest Biology and Technology,2013,86:29-36.
[24] Hierro E,Manzano S,Ordó ez J A,et al.Inactivation of Salmonella enterica serovar Enteritidis on shell eggs by pulsed light technology[J].International Journal of Food Microbiology,2009,135(2):125-130.
[25] Cabedo L,Picart i Barrot L,Teixido i Canelles A.Prevalence of Listeria monocytogenes and Salmonella in readyto-eat food in Catalonia,Spain[J].Journal of Food Protection,2008,71(4):855-859.
[26] Bohaychuk V M,Gensler G E,King R K,et al.Occurrence of pathogens in raw and ready-to-eat meat and poultry products collected from the retail marketplace in Edmonton,Alberta,Canada[J].Journal of Food Protection,2006,69(9):2176-2182.
[27] Levine P,Rose B,Green S,et al.Pathogen testing of ready-to-eat meat and poultry products collected at federally inspected establishments in the United States,1990 to 1999[J].Journal of Food Protection,2001,64(8):1 188-1 193.
[28] Borch E,Kant-Muermans M L,Blixt Y.Bacterial spoilage of meat and cured meat products[J].International Journal of Food Microbiology,1996,33(1):103-120.
[29] M kel P M,Korkeala H J,Laine J J.Survival of ropy slime-producing lactic acid bacteria in heat processes used in the meat industry[J].Meat Science,1992,31(4):463-471.
[30] Ganan M,Hierro E,Hospital X F,et al.Use of pulsed light to increase the safety of ready-to-eat cured meat products[J].Food Control,2013,32(2):512-517.
[31] Hierro E,Barroso E,la Hoz L,et al.Efficacy of pulsed light for shelf-life extension and inactivation of Listeria monocytogenes on ready-to-eat cooked meat products[J].Innovative Food Science& Emerging Technologies,2011,12(3):275-281.
[32] Woodling S E,Moraru C I.Influence of surface topography on the effectiveness of pulsed light treatment for the inactivation of listeria innocua on stainless-steel surfaces[J].Journal of Food Science,2005,70(7):m345-m351.
[33] Hierro E,Ganan M,Barroso E,et al.Pulsed light treatment for the inactivation of selected pathogens and the shelf-life extension of beef and tuna carpaccio[J].International Journal of Food Microbiology,2012,158(1):42-48.
[34] Wambura P,Verghese M.Effect of pulsed ultraviolet light on quality of sliced ham[J].LWT-Food Science and Technology,2011,44(10):2173-2179.
[35] Faustman C,Cassens R G.The biochemical basis for discoloration in fresh meat:A review[J].Journal of Muscle Foods,1990,1(3):217-243.
[36] Hur S J,Ye B W,Lee J L,et al.Effects of conjugated linoleic acid on color and lipid oxidation of beef patties during cold storage[J].Meat Science,2004,66(4):771-775.
[37] Kannan G,Kouakou B,Gelaye S.Color changes reflecting myoglobin and lipid oxidation in chevon cuts during refrigerated display[J].Small Ruminant Research,2001,42(1):67-74.
[38] McClements D J,Decker E A.Lipid oxidation in Oil-in-Water emulsions:Impact of molecular environment on chemical reactions in heterogeneous food systems[J].Journal of Food Science,2000,65(8):1 270-1 282.
[39] Elmnasser N,Dalgalarrondo M,Orange N,et al.Effect of pulsed-light treatment on milk proteins and lipids[J].Journal of Agricultural and Food Chemistry,2008,56(6):1 984-1 991.
[40] Ansari I A,Datta A K.An overview of sterilization methods for packaging materials used in aseptic packaging systems[J].Food and Bioproducts Processing,2003,81(1):57-65.
[41] Ringus D L,Moraru C I.Pulsed Ligh inactivation of Listeria innocua on food packaging materials of different surface roughness and reflectivity[J].Journal of Food Engineering,2013,114(3):331-337.
[42] Li B,Logan B E.The impact of ultraviolet light on bacterial adhesion to glass and metal oxide-coated surface[J].Colloids and Surfaces B:Biointerfaces,2005,41(2):153-161.
[43] 江天宝.臭氧和PL对大肠杆菌协同杀灭效果的研究[J].海峡药学,2009,21(6):59-62.
