超声协同CDA酶法制备龙虾壳聚糖*
2014-12-25窦勇胡佩红
窦勇,胡佩红
1(江苏财经职业技术学院,江苏淮安,223003)2(淮安正昌饲料有限公司,江苏淮安,223005)
壳聚糖(chitosan)又称脱乙酰甲壳素,是由甲壳素经脱乙酰基而得,化学名聚葡萄糖胺(1-4)-2-氨基-B-D葡萄糖,是天然多糖中唯一的碱性多糖,广泛用于纺织、医药、造纸、化妆品、食品工业和生物技术等领域[1]。一般把N-脱乙酰度55%以上的甲壳素(能溶解于1%的乙酸或1%的HCl中)称为壳聚糖,低于55%的仍称为甲壳素;根据脱乙酰度不同,将壳聚糖分为高(85% ~95%)、中(70% ~85%)、低(55%~70%)脱乙酰度3类[2-3]。目前,国内外有关壳聚糖制备报道十分广泛,其主要制备方法是传统的高浓度强碱法,近年来不少研究学者采用微波法、超声波法有机溶剂介质法等方法制备壳聚糖,但这些方法仍然离不开强碱的作用,其反应时间长,能耗高,产品性质不稳定,对环境造成污染极大[4-7]。
我国淡水资源十分丰富,是淡水小龙虾养殖和加工大国,每年产生的淡水小龙虾加工废弃物数以吨计,既污染环境又浪费了资源。显然,为充分利用虾壳自然资源,减少环境污染,以淡水小龙虾加工废弃物为原料,开发高效、无污染的环境友好型的壳聚糖生产方法势在必行。本研究旨在以淡水小龙虾壳为原料,利用超声波“空化作用”,改善甲壳素脱乙酰基酶(Chitin Deacetylation,简称CDA)与甲壳素之间的相互作用,利用CDA酶的高效催化性和专一性,提高脱乙酰反应速度和脱乙酰度,通过响应面法优化制备工艺参数,建立环境友好型的酶法制备高脱乙酰度壳聚糖的最佳工艺,为环境友好型的酶法工业化生产壳聚糖奠定基础。
1 材料与方法
1.1 主要材料与试剂
淡水小龙虾,购于淮安市城南农贸市场;Na2·EDTA、NaOH、双氧水等试剂均购于国药化学试剂有限公司,均为分析纯;CDA粗酶液(采用1.3.3方法测定酶活力为195.34 U/mL,实验室自制:从淮安市某淡水小龙虾养殖基地淤泥中筛选出1株高产CDA酶霉菌,经鉴定为构巢曲霉菌,将该菌接种于液体发酵培养基,于30℃、150 r/min摇床培养96 h后,所得发酵液低温离心后取上清液,即为CDA粗酶液)。
1.2 主要仪器
多功能超声波清洗机(SCQ-1000C),上海汗诺仪器有限公司;粉碎机(JYL-305),山东九阳小家电有限公司;恒温鼓风干燥箱(DHZG-9070A),上海一恒科学仪器有限公司;电热恒温水浴锅(HWS-28),上海一恒科学仪器有限公司;数显黏度计(NDJ-8S),上海方瑞仪器有限公司。
1.3 实验方法
1.3.1 超声协同CDA制备壳聚糖工艺
虾壳样品预处理→超声辅助EDTA脱钙脱蛋白→过滤→烘干→双氧水脱色→水洗至中性→烘干→甲壳素→超声协同CDA酶法脱乙酰→过滤→水洗至中性→烘干→壳聚糖
1.3.2 脱乙酰度、黏度的测定和壳聚糖得率计算[6-7]
脱乙酰度(D.D.)测定参考文献[6]方法进行,黏度测定参考文献[7]方法进行。壳聚糖得率计算按公式(1)计算:
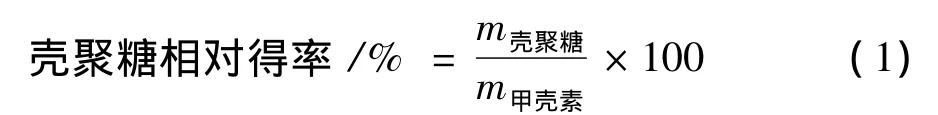
1.3.3 CDA酶活单位定义[8]
[8],采用分光光度法测定酶活,以每小时产生1 μg对硝基苯胺所需要的酶量定义为1个酶活力单位(粗酶液酶活单位:U/mL)。
1.3.4 传统碱法制备淡水小龙虾壳聚糖
参考文献[9]“一步法”壳聚糖制备方法,采用1.3.2、1.3.3方法测其D.D.值、黏度及相对得率。
1.3.5 超声波法制备淡水小龙虾壳聚糖[7]
称取5 g左右自制甲壳素粉末,加入盛有80 mL 50%NaOH的烧杯中,并置于超声波清洗机中,经超声波(频率40 kHz,功率400 W)预处理1 h后,在90℃下恒温搅拌反应10 h,结束后冷却至室温,过滤,用水反复冲洗至中性,烘干即为壳聚糖,采用1.3.2、1.3.3方法测定其D.D.值、黏度及相对得率。
1.3.6 超声协同CDA酶法制备淡水小龙虾壳聚糖[10-13]
将自制甲壳素粉碎过40目筛于烧杯中,按料液比1∶20加入蒸馏水,于100℃水浴中加热预处理1 h后,置于超声波清洗机中,在一定超声功率下,经超声波预处理60 min后,加入CDA粗酶液,磁力搅拌水浴于50℃下恒温酶解一定时间,期间以0.1 mol/L NaOH调节pH 7.5,以使酶活性最高,酶反应结束后,以100℃水浴下连续灭活15 min终止酶反应,迅速冷却至室温,9 000 r/min离心10 min,蒸馏水反复洗涤至中性,沉淀物烘干,即得壳聚糖,采用1.3.2、1.3.3方法测定其D.D.值、黏度及相对得率。
1.3.7 RSM 优化设计[11,14]
采用Design Expert 8.0.5软件,根据Box-Behnken设计原理,以脱乙酰度Y为响应值,从预试验结果中选取加酶量、酶解时间、超声功率3个对D.D值影响较大因素设计试验,以期获得高D.D.的最佳条件,因素水平设计见表1。
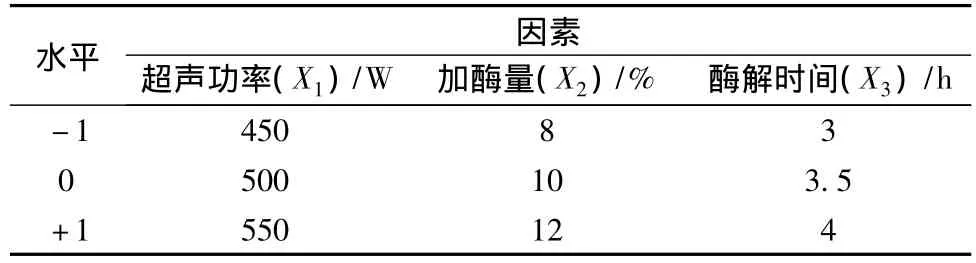
表1 Box-Behnken设计试验因素水平编码表Table 1 Box-Behnken design factors and levels code table
2 结果与分析
2.1 模型建立及其显著性检验
RSM分析试验设计与结果见表2,利用Design Expert 8.0.5软件对表2数据进行回归拟合,得到脱乙酰度(Y)对此3因素编码值的二次多项回归模型为:Y=-319.632+0.717 5X1-0.772 5X2-0.467 5X3+0.98X1X2-0.44X1X3-0.885X2X3-5.718X12-2.248X22-2.998X32。

表2 Box-Behnken试验设计与结果Table 2 Box-Behnken experiment design and results
该模型方差分析与回归方程系数显著性检验结果见表3,模型P<0.000 1,差异极显著;失拟项P=0.100 2>0.05,差异不显著,说明该模型对实际试验拟合度好,试验误差小。方差分析结果显示,决定系数R2=0.991 4校正系数,信噪比(Adeq Precision)=25.22远大于4,表明模型预测值与实际值拟合良好,可信度均很高,能够很好用于超声协同CDA酶法制备壳聚糖的D.D.的分析和预测。表3数据可见,一次项中X1、X2偏回归系数差异高度显著,说明超声功率、加酶量对本法制备的壳聚糖D.D.有高度显著的影响,X3偏回归系数差异显著,说明酶解时间对壳聚糖D.D.影响显著。交互项中除X1X2影响高度显著,X2X3影响显著,而X1X3交互作用不明显,说明超声功率和加酶量交互作用对D.D.影响最大,加酶量与酶解时间交互作用对D.D.影响显著,而超声功率与酶解时间交互作用对其影响很小。由F值可以看出,以上3因素对壳聚糖D.D.的影响顺序为:加酶量>超声功率>酶解时间。
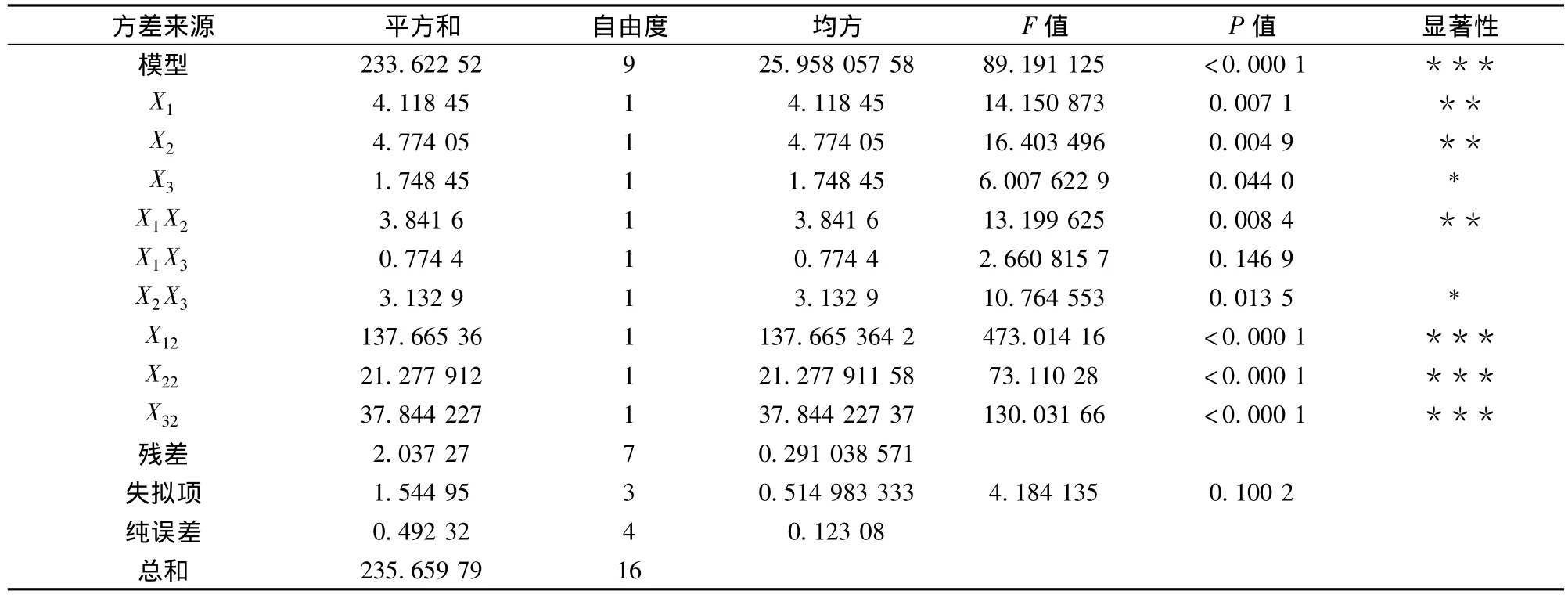
表3 回归方程方差分析结果Table 3 ANOVA results of regression equation
2.2 RSM分析
利用Design Expert 8.0.5软件作响应曲面及等高曲线,考察所拟合的响应面形状,分析超声波功率、加酶量、酶解时间3因素之间交互作用对壳聚糖D.D.的影响,其响应曲面及等高曲线如图1~图3所示。
2.2.1 超声波功率与加酶量交互关系
由图1可以看出,当酶解时间一定时,随着超声功率的增大,D.D.先升高后降低,变化幅度很大,说明在一定范围内提高超声功率有利于甲壳素脱乙酰基,而超声功率过大,可能造成空化气泡在负相位受压过大而直接破裂,减小甚至失去超声“空化作用”[15],从而不利于甲壳素的脱乙酰基。而加酶量对其影响较小,等高线呈椭圆形,说明超声波功率与加酶量交互作用明显。
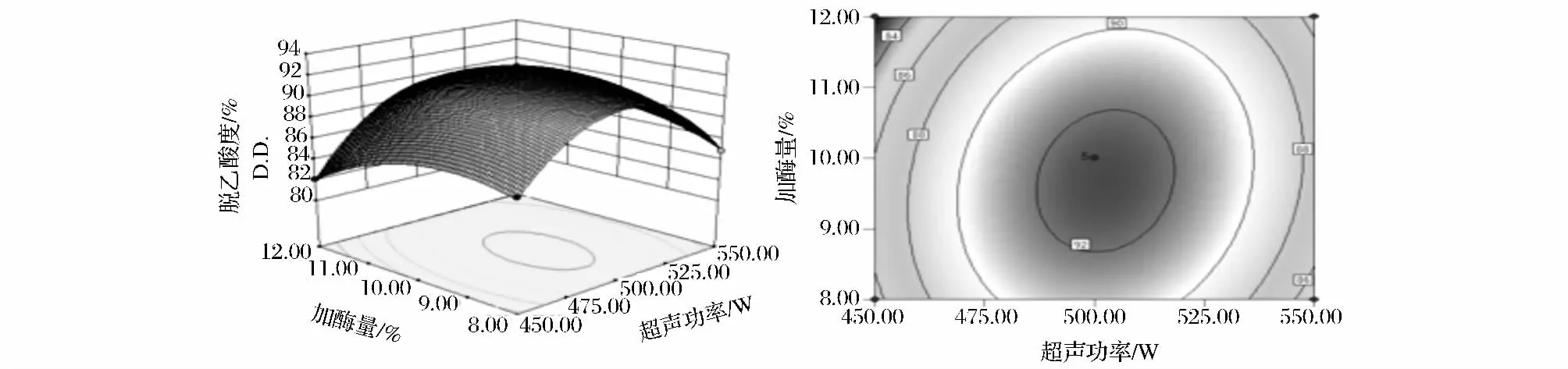
图1 超声波功率与加酶量交互作用的响应面与等高曲线图Fig.1 Response surface and high profile of the interaction between ultrasonic power and enzyme dosage
2.2.2 超声波功率与酶解时间交互关系
从图2可以看出,当加酶量一定时,随着超过功率的增大,壳聚糖D.D.均呈现先上升后下降的趋势,在适宜的超声功率下,促进了甲壳素颗粒粉碎,增加其与CDA酶活性中心的结合几率,充分发挥了酶的高效催化活性,D.D.达到最大值;而高功率超声会产生瞬态空化作用,空化泡崩溃的瞬间,释放出高温高压,导致大量自由基的形成,高能量的自由基可能直接攻击CDA酶分子发生结构变化,使CDA活力下降,D.D.也随之降低[16];而当加酶量一定时,D.D.随酶解时间的延长呈现平稳略有下降趋势,原因可能是因酶解时间过长,产生大量的乙酸,降低了CDA酶的活性,从而影响了D.D.。此外,右侧等高线呈近圆形,说明等高线呈椭圆形交互作用不明显。
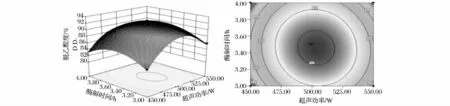
图2 超声波功率与酶解时间交互作用的响应面与等高曲线图Fig.2 Response surface and high profile of the interaction between ultrasonic power and enzymolysis time
2.2.3 加酶量与酶解时间交互关系
图3显示,当超声功率不变时,随着酶解时间和加酶量的增加,响应面曲线变化幅度不明显。说明,当超声功率不适宜时,随加酶量和酶解时间的变化,酶法脱乙酰基效果不明显。等高线呈椭圆形,说明等高线呈椭圆形交互作用明显,当超声功率适宜时,能充分发挥超声与CDA酶的协同作用。

图3 加酶量与酶解时间交互作用的响应面与等高曲线图Fig.3 Response surface and high profile of the interaction between enzyme dosage and enzymolysis time
2.3 RSM优化结果与验证试验
根据回归模型,通过Design Expert 8.0.5软件分析得出,超声协同CDA酶制备壳聚糖的最佳条件优化结果为:超声功率475.91 W,加酶量9.45%,酶解时间3.5 h;预期的D.D.为90.98%。为了验证Box-Behnken试验设计的预测结果可靠性,根据响应面优化结果及预试验的最佳条件,结合实际操作,采用超声功率476 W、超声处理时间60 min、加酶量9.45%、酶解温度50℃、酶解时间3.5 h,进行3组平行试验制备壳聚糖,所得壳聚糖D.D.的平均值为91.09%,这与响应面预测评分90.98%十分接近,说明该模型预测结果与实际结果相符度、可信度高,具有实用价值。
2.4 超声协同酶法与传统碱法及单一超声法制备壳聚糖效果比较
从表4可知,超声协同CDA酶法制备的壳聚糖D.D.为91.09%,黏度为95 mPa·s,制备时间4.5 h,壳聚糖相对得率为85.87%,可见超声协同酶法制备壳聚糖的D.D.、黏度、制备时间和相对得率等产品质量参数明显比传统热碱法、单一超声法效果好。制备时间来看,超声协同酶法,利用了酶的高效催化活性和超声波的“空化作用”大大降低了脱乙酰基的时间,提高了D.D.,酶法条件温和也保证产品性质稳定,其D.D.和黏度明显高于其他两种方法,可见采用超声协同酶法制备淡水小龙虾壳高效、可行,制备时间短,产品具有高D.D.、高黏度的优点,制备过程中不需添加强酸、强碱,保护了环境,将成为未来壳聚糖工业化生产的方向。
3 结论
本研究在预实验基础上,通过响应面法优化了超声协同酶法制备龙虾壳聚糖工艺,得到其最佳制备条件为:超声功率476 W、超声处理时间60 min、加酶量9.45%、酶解温度50℃、酶解时间3.5 h,在此工艺条件下,壳聚糖的D.D.高达91.09%、黏度95 mPa·s,相对得率81.87%,总制备时间为4.5 h,产品为白色粉末。本研究采用自制CDA粗酶液,在酶的纯化及酶学性质及其催化脱乙酰机理方面有待于进一步研究。龙虾壳聚糖的超声协同CDA酶制备法具有制备时间短、产品脱乙酰度高、相对得率高的优点,其最大优势在于一改长期以来无法脱离强碱制备壳聚糖的现状,甲壳素提取所使用的 EDTA回收率可达100%,整个制备过程没有使用强酸、强碱等环境污染试剂,是一种环境友好型的制备方法,必将广泛运用。

表4 不同方法制备壳聚糖效果比较Table 4 Comparison of preparing chitosan effect with different methods
参考文献
[1] Nidhi Pareek,Vivekanand V,Singh R P.Advances in Enzyme Biotechnology[M].India:Springer,2013:125-136.
[2] 李军立,张波,马力.壳聚糖的超声波降解及最佳工艺研究[J].西华大学学报(自然科学版),2011,30(5):100-103.
[3] 宋巍,陈元维,史国齐,等.不同脱乙酰度壳聚糖的制备及结构性能的研究[J].功能材料,2007,38(10):1 705-1 708.
[4] Assaa^d Sila,Najwa Mlaik,Nadhem Sayari Rafik Balt,et al.Chitin and chitosan extracted from shrimp waste using fish proteases aided process:Efficiency of chitosan in the treatment of unhairing effluents[J].J Polym Environ,2014,22:78-87.
[5] 朱利平,黄惠莉.真菌甲壳素脱乙酰酶(CDA)研究进展[J].食品工业科技,2010,31(11):394-400.
[6] 季锦林,汤立新,钱清华.间歇法提取虾甲壳素和制备壳聚糖的工艺优化[J].食品科技,2013,38(4):200-209.
[7] 莫祺红,卢洁,黄佩芳,等.超声波预处理脱乙酰化制备壳聚糖的研究[J].食品科技,2009,34(8):200-209.
[8] 万芳芳.高产甲壳素脱乙酰酶菌株的筛选及发酵研究[D].长沙:中南林业科技大学,2012.
[9] 周安娜,张国栋,张文艺.“一步法”壳聚糖制备新工艺[J].食品工业科技,2003,24(1):73-75.
[10] Win N N,Stevens W F.Shrimp chitin as substrate for fungal chitin deacetylase[J].Applied Microbiology and Biotechnology,2001,57(3):334-341.
[11] 刘振春,韩宇,孙慧娟,等.超声波辅助酶法制备绿豆ACE抑制肽的工艺研究[J].西北农林科技大学学报(自然科学版),2014,42(8):1-8.
[12] 许庆陵,曾庆祝.虾壳甲壳素及壳聚糖提取工艺的研究[J].中国食品添加剂,2013(6):104-109.
[13] Márcia Barreto Cardoso,Roberta Signini,Sérgio Paulo Campana-Filho.On the sonication of chitin:effects on its structure and morphology and influence on its deacetylation[J].Polymer Bulletin,2001,47(2):183-190.
[14] 李侠,马艳梅,孙慧娟,等.超声波一双酶法协同提取玉米须黄酮工艺的优化[J].西北农林科技大学学报(自然科学版),2014,42(4):416-419.
[15] 徐力克,邓慧萍,史俊.超声波降解有机物机理及其应用研究[J].环境科学与技术,2010,33(12):416-419.
[16] 吕鹏,庄重,凌建亚,等.超声对酶的影响[J].生物技术通讯,2004,15(5):534-536.
