混合菌固态发酵豆粕制备大豆活性肽*
2014-12-25李慧娟孙云鹏丁鹏程丁瑞吴光坤李泉
李慧娟,孙云鹏,丁鹏程,2,丁瑞,吴光坤,李泉
1(山东科技大学化学与环境工程学院,山东青岛,266590)2(山东大学生命科学学院,山东济南,250100)
豆粕是大豆榨油后的副产物,其蛋白质含量高达40%~50%,是目前畜牧养殖业中常用的饲料。但因豆粕中含有胰蛋白酶抑制剂、大豆凝集素、大豆抗原蛋白(致敏因子)等多种抗营养因子,对动物的生长发育和健康造成不良影响[1]。通过蛋白酶的作用可减弱食物蛋白的抗原影响,水解产生的小肽不仅具有抗氧化和抑制血管紧张素转化酶活性,产生的游离氨基酸还可改善产物的风味[2-4]。在工业生产中常用酶法和发酵法处理豆粕,使其大分子蛋白降解成小分子肽(大豆肽),由此可以破坏豆粕中的大多数抗营养因子,提高豆粕的消化、吸收和利用率[2,5-6]。酶法酶解豆粕制备大豆肽,因酶价格较高而使生产成本增加,且存在着产物得率不高的问题;而微生物发酵处理豆粕,一方面微生物在发酵过程中分泌的蛋白酶可降解豆粕形成小分子肽,有效降解其中的抗营养因子,另一方面微生物在发酵过程中产生的一些次级代谢产物还能有效改善大豆肽的风味[7-8]。固体发酵具有低能耗、节水、发酵产物稳定性较高、对无菌条件要求低、易加工等特点,有助于工业化生产[9]。关于混合菌固态发酵豆粕的工艺优化和大豆肽生理活性等方面的报道很多[1,7-8],而结合生产实际对混合菌固体发酵工艺及发酵产物生理活性进行系统研究的报道较少,加强此方面的研究对降低大豆肽生产成本,提高大豆肽得率和产品品质,具有重要意义。
本文以实验室筛选的产蛋白酶菌株(枯草芽孢杆菌)和植物乳杆菌对大豆豆粕进行混合菌固态发酵,以小肽含量和挥发性盐基氮含量为检测指标,系统研究了菌种配比、料水比、接种量、发酵温度和发酵时间等单因素对固态发酵豆粕的影响,确定最佳的固态发酵工艺;并对发酵得到的大豆肽进行抗氧化和氨基酸成分分析。本研究将有助于豆粕的高值化开发及应用。
1 材料与方法
1.1 材料、主要化学试剂及培养基
1.1.1 实验材料
豆粕:市场购买,粗蛋白质含量43.54%(实测)。
枯草芽孢杆菌(Bacillus subtilis J3)、植物乳杆菌(Lactobacillus plantarum JNX):本实验室保存。
1.1.2 主要化学试剂及培养基
ABTS [2,2'-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid)]:2,2-二氮-双(3-乙基苯并噻唑-6-磺酸)
枯草芽孢杆菌(B.subtilis J3)的种子培养基(w/v):蛋白胨1%,牛肉浸粉0.3%,NaCl 0.5%。
枯草芽孢杆菌(B.subtilis J3)的发酵培养基(w/v):玉米芯 0.5%,大豆豆粕 3.4%,K2HPO40.34%,(NH4)2SO40.2%,CaCO30.2%,pH 8.0。
植物乳杆菌(L.plantarum JNX)的种子培养基(w/v):蛋白胨 1%,牛肉浸粉 1%,酵母提取物0.5%,葡萄糖 2%,乙酸钠 0.5%,柠檬酸氢二铵0.2%,K2HPO40.2%,吐温 -80 0.1%,pH 7.0。
植物乳杆菌(L.plantarum JNX)发酵培养基:蔗糖4%,蛋白胨1%,酵母提取物1%,乙酸钠0.5%,Tween-80 0.15%,pH 5.0。
1.2 实验方法
1.2.1 固态发酵工艺流程
用种子培养基分别活化枯草芽孢杆菌和植物乳杆菌,按1%接种量接种到相应的发酵培养基中,将在30℃170 r/min振荡培养20 h后的菌液接种到固体发酵培养基中,从菌种配比(1∶1,1∶2,2∶1)、料水比(1∶0.4,1∶0.6,1∶0.8,1∶1,1∶1.2)、接种量(3%,6%,9%,12%)、发酵温度(25,30,35,40℃)和发酵时间(12,24,36,48,60 h)等5个因素进行发酵工艺优化,其中在菌种配比、料水比、接种量单因素优化时,发酵温度为30℃、发酵时间为24 h。发酵完成后测定发酵产物中的小肽含量和挥发性盐基氮含量。
1.2.1.1 小肽含量的测定
发酵产物中酸溶蛋白的含氮量测定:称取发酵产物10 g,加入15% 三氯乙酸溶液60 mL溶解并定容至100 mL。10 000 r/min离心20 min,取上清液10 mL,放入凯斯烧瓶中,采用凯氏定氮法测定含氮量,具体操作和计算参照 GBT 6432-1994[10]的测定方法。豆粕中含氮量的测定:称取豆粕0.5 g加入到干燥的凯斯烧瓶中进行如上所述操作。

1.2.1.2 挥发性盐基氮含量的测定
称取10 g发酵产物置于含100 mL蒸馏水的烧杯中,于磁力搅拌器上搅拌30 min后,倒入离心管中,10 000 r/min离心20 min,取10 mL上清液采用半微量定氮法测定挥发性盐基氮的含量,具体操作和计算参照 GB/T 5009.44-2003[11]。
1.2.2 发酵产物中大豆活性肽的抗氧化活性测定
称取10 g发酵产物于含100 mL蒸馏水的烧杯中,经磁力搅拌器搅拌30 min后,倒入离心管中,10 000 r/min离心20 min后取上清,适量稀释成为待测液(大豆活性肽),利用ABTS法[12]测定大豆肽的抗氧化活性,将大豆肽样品换成蒸馏水作为对照,计算多肽的抗氧化活性。抗氧化活性用消除率来表示。

式中,A0:ABTS+工作液的吸光度;A:待测液与ABTS+工作溶液反应时的吸光度。
1.2.3 发酵产物的SDS-PAGE电泳
取发酵后的豆粕用蒸馏水溶解、浸提、离心取上清液,具体操作同1.2.2,上清液用于SDS-PAGE电泳(15%的分离胶,5%的浓缩胶,电泳的电压200 V)。以未发酵的豆粕提取液为对照。
1.2.4 发酵产物的氨基酸组成成分分析
分别称取未接菌的豆粕和接菌的豆粕在30℃培养箱中固体发酵48 h后的产物10 g溶于100 mL蒸馏水中,于磁力搅拌器上搅拌30 min后,离心取上清液。取1 mL上清液用6 mol/L HCl 110℃水解24 h后,调pH至2.2,利用L8900型氨基酸自动分析仪检测氨基酸组成成分及含量分析。
2 结果与讨论
2.1 混合菌固体发酵豆粕的条件优化
2.1.1 菌种配比对发酵产物的影响

图1 植物乳杆菌与枯草芽孢杆菌配比对发酵产物中小肽含量与挥发性盐基氮含量的影响Fig.1 Effect the ratio of L.plantarum JNX and B.subtilis J3 on the content of small peptides and volatile basic nitrogen in fermented products
称取20 g豆粕加入250 mL的锥形瓶中,料水比选为1∶1,混合菌的接种量为6%,植物乳杆菌和枯草芽孢杆菌菌种设置不同配比进行固体发酵。图1表明,在植物乳酸杆菌接种量一定的情况下,增加枯草芽孢杆菌的接种量 (菌株配比从1∶1至1∶2),发酵产物的小肽含量明显增加,从6.38%增加到10.13%;但发酵产物的挥发性盐基氮含量亦从65.91 mg/100 g增加至84.74 mg/100 g。挥发性盐基氮含量反映了发酵豆粕的氨基酸损失和腐败程度,在发酵生产中应控制其含量在尽可能低的范围内[1],而在增加菌种配比中植物乳杆菌的比例(2∶1)情况下接种,发酵产物小肽含量为7.32%,高于1∶1菌株配比下发酵产物的小肽含量;同时挥发性盐基氮含量降低至56.51 mg/100 g。因此选择植物乳杆菌与枯草芽孢杆菌菌种配比为 2∶1。
2.1.2 料水比对发酵产物的影响
称取20 g豆粕加入250 mL的锥形瓶中,混合菌(植物乳杆菌与枯草芽孢杆菌菌种配比为2∶1)的接种量为6%,设置不同的料水比进行固态发酵。控制料水比是固态发酵过程中重要环节之一,过高的含水量影响氧的传递,限制好氧菌的生长;过低的含水量,抑制菌体的生长,影响酶的活性[9]。由图2可以看出,随着料水比的增加,小肽含量和挥发性盐基氮含量的总体变化趋势均为先增加后减少,在料水比为1∶0.6时,小肽含量达到最大值(10.48%),挥发性盐基氮含量也最低(52.43 mg/100 g)。因此确定最佳料水比为 1∶0.6。

图2 料水比对发酵产物中小肽含量与挥发性盐基氮含量的影响Fig.2 Effect the ratio of material to water on the content of small peptides and volatile basic nitrogen in fermented products
2.1.3 接种量对发酵产物的影响
称取20 g豆粕加入250 mL的锥形瓶中,料水比为1∶0.6,设置不同的接种量进行固态发酵,结果见图3。

图3 接种量对发酵产物中小肽含量与挥发性盐基氮含量的影响Fig.3 Effect inoculum size on the content of small peptides and volatile basic nitrogen in fermented products
由图3可知,随着接种量的增加,小肽含量和挥发性盐基氮含量均增加,接种量12%时,小肽含量虽高达12.75%,但挥发性盐基氮含量也高达98.37 mg/100 g,远超过生产中对挥发性盐基氮含量的最低要求。混合菌的接种量高,所产蛋白酶含量和活力高,使豆粕中更多的蛋白质降解为小肽,增加了小肽的含量;但是,菌体在固体发酵过程中产生的代谢副产物也相应增加,挥发性盐基氮含量的增高将严重影响发酵豆粕的品质,合格植物肽蛋白饲料中挥发性盐基氮含量应控制在50 mg/100 g以下[1]。接种量6%的发酵产物中挥发性盐基氮含量最低,仅为50.77 mg/100 g;小肽含量为 10.02%,仅比最高值(12.75%)下降了2.73%。综合考虑确定最适接种量为6%。
2.1.4 发酵温度对发酵产物的影响
称取20 g豆粕加入250 mL的锥形瓶中,料水比为1∶0.6,混合菌接种量为6%,分别置于不同温度下固体发酵24 h。温度不仅影响微生物的生长而且影响酶的活性,因固态发酵传热性差,故选择合适的发酵温度而使发酵反应进行下去变得尤为重要。由图4可以看出,小肽含量和挥发性盐基氮含量的总体变化趋势是随着温度的升高而增加。发酵温度为40℃时,发酵产物中小肽含量达到最高,为11.17%,而挥发性盐基氮含量也高达92.03 mg/100 g。挥发性盐基氮过高不仅使发酵的豆粕产生氨臭味、适口性变差,严重的会导致动物中毒[1]。当温度为30℃时,挥发性盐基氮含量仅为57.12 mg/100 g,且小肽含量略低于最高值,为9.57%。综合考虑确定最适发酵温度为30℃。

图4 发酵温度对发酵产物中小肽含量与挥发性盐基氮含量的影响Fig.4 Effect fermentation temperature on the content of small peptides and volatile basic nitrogen in fermented products
2.1.5 发酵时间对发酵产物的影响
称取20 g豆粕加入250 mL的锥形瓶中,料水比1∶0.6,混合菌接种量6%,于30℃培养箱中固体发酵不同时间。由图5可以看出,随着发酵时间的延长,菌群大量生长,蛋白酶活性增高,小肽的产量逐渐上升,但随着发酵时间的延长,发酵副产物增多,挥发性盐基氮含量也增加,降低了发酵产物的品质。发酵24 h时,挥发性盐基氮含量最低,为50.70 mg/100 g;相对应的小肽含量为10.64%,略低于发酵48 h的小肽含量(12.76%)。实验中也发现发酵48 h后,豆粕有些稀湿粘连,不利于产品的后续加工,也不利于菌体的生长。综合考虑确定最适发酵周期为24 h。
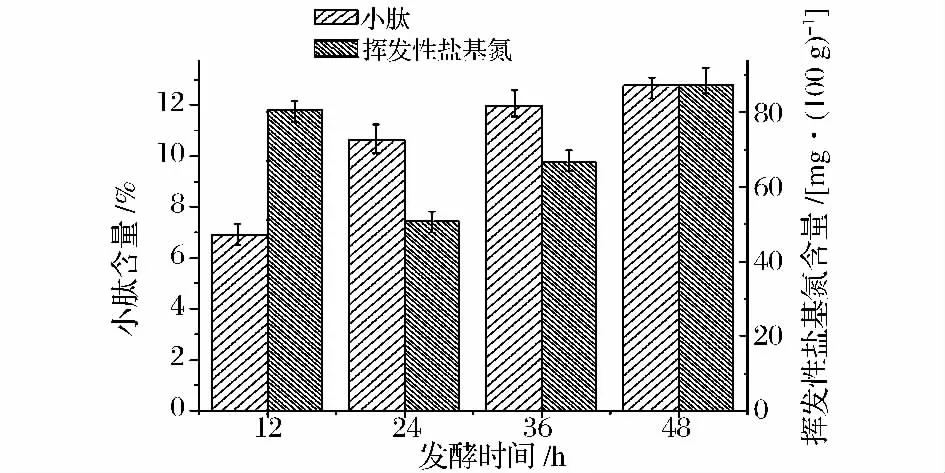
图5 发酵时间对发酵产物中小肽含量与挥发性盐基氮含量的影响Fig.5 Effect fermentation time on the content of small peptides and volatile basic nitrogen in fermented products
2.2 混合菌固态发酵豆粕所制备大豆活性肽的抗氧化活性
称取20 g豆粕加入250 mL的锥形瓶中,料水比1∶0.6,接入6%混合菌菌液,30℃培养箱中固态发酵。水浸提法提取大豆活性肽,利用ABTS法[12]测定大豆肽的抗氧化活性。对照组不接菌,其余同实验组,实验结果见图6。

图6 不同发酵时间下发酵产物中大豆肽的抗氧化活性变化趋势Fig.6 Time course of antioxidant activity of soybean peptides in fermented products
由图6可以看出,随着发酵时间的延长,对照组的ABTS清除自由基能力基本在14.79%~20.17%之间;而在实验组中不同发酵时间所提取的大豆肽,其清除自由基能力均在40%以上,随着发酵时间的延长,所提取大豆肽的清除自由基能力提高,这与小肽含量变化规律(图5)相吻合。固态发酵48 h时,所提取大豆肽的清除自由基能力最高,为65.76%。参与清除自由基的抗氧化肽的分离、纯化及其氨基酸组成成分分析有待进一步深入地探讨。
2.3 发酵产物的电泳分析
由SDS-PAGE电泳图(图7)可以看出,豆粕在枯草芽孢杆菌和植物乳杆菌混合菌的最适发酵工艺条件下,随发酵时间延长,大分子质量的豆粕被降解,发酵24 h后,发酵豆粕中所提取的大豆肽分子质量主要在10 kDa以下,这与庞宗文等[8]用毛霉发酵豆粕和ZHU等[13]用枯草芽孢杆菌发酵传统豆制品的实验结果相类似。

图7 发酵产物的SDS-PAGE电泳图Fig.7 SDS-PAGE profile of fermentation products
2.4 发酵产物的氨基酸组成成分分析
将未接菌的(对照组)和接菌的(实验组)豆粕在30℃培养箱中发酵48 h,其发酵产物经酸水解后测定氨基酸组成成分及其含量,实验结果表明混合菌发酵后的氨基酸含量均高于未接菌的,其中脯氨酸高出16倍、甲硫氨酸高出14倍;而且甲硫氨酸、亮氨酸、缬氨酸、苯丙氨酸和异亮氨酸等必需氨基酸的含量均高于未发酵的豆粕提取液5倍以上(见表1)。已有的研究表明组氨酸、酪氨酸和甲硫氨酸等氨基酸具有一定的抗氧化活性[6,14];且甲硫氨酸易从体内流失,需在食物中大量添加[4]。在本实验中,混合菌发酵后的豆粕提取液中甲硫氨酸、酪氨酸和组氨酸含量明显高于未接菌的,因此所制备的植物肽适于作为饲料添加剂。

表1 发酵产物的氨基酸组成成分含量分析mg/100mLTable 1 Free-amino acid profiles of unfermented and fermented soybean meal mg/100mL
3 结论
本文以在实际生产中衡量发酵豆粕品质常用的两个重要参数(小肽含量和挥发性盐基氮含量)为指标,从菌种配比、料水比、接种量、温度、发酵周期等5个因素对混合菌固体发酵制备大豆肽的工艺进行优化,确定最佳固体发酵豆粕的工艺为:植物乳杆菌与枯草芽孢杆菌菌种配比为2∶1、料水比为1∶0.6、接种量为6%、发酵温度为30℃、发酵周期24 h,此条件下,测得小肽含量为10.64%,与未发酵的对照组(小肽含量:1.82%)相比,小肽含量提高了近10倍;挥发性盐基氮含量为50.70 mg/100 g,基本符合植物肽蛋白饲料中对挥发性盐基氮含量的要求。混合菌固体发酵豆粕所产小肽的抗氧化能力高达65.76%,该发酵产物制成饲料后具有清除生物体内过量自由基的潜力,可用于预防自由基诱发的疾病。此外,混合菌发酵后的产物中必需氨基酸(甲硫氨酸、亮氨酸、缬氨酸、苯丙氨酸和异亮氨酸)含量高于未接菌的5倍以上,可有效补充动物体内的必需氨基酸。综合以上结果,该固体发酵的豆粕将来可开发为富含小肽的产品,添加到动物饲料中。
[1] 胡瑞,陈艳,王之盛,等.复合益生菌发酵豆粕生产工艺参数的优化及酶菌联合发酵对豆粕品质的影响[J].动物营养学报,2013,25(8):1 896-1 903.
[2] Tavano O L.Protein hydrolysis using proteases:an important tool for food biotechnology [J].Journal of Molecular Catalysis B:Enzymatic,2013,90:1-11.
[3] Rho S J,Lee J S,Chung Y I,et al.Purification and identification of an angiotensin I-converting enzyme inhibitory peptide from fermented soybean extract[J].Process Biochemistry,2009,44(4):490-493.
[4] Katekan D,Arunee A,Ekachai C,et al.Free-amino acid profiles of Thua nao,a Thai fermented soybean [J].Food Chemistry,2011,125(2):342-347.
[5] 许晶,江连洲,李杨,等.酶水解高温豆粕制备高水解度大豆肽的研究[J].食品与发酵工业,2009,35(4):98-102.
[6] Singh B P,Vij S,Hati S.Functional significance of bioactive peptides derived from soybean [J].Peptides,2014,54:171-179.
[7] 杨洁芳,刘会平,俞佳,等.发酵法制备大豆肽的工艺优化及其抗氧化能力[J].食品与发酵工业,2013,39(6):59-63.
[8] 庞宗文,李敏,李树波,等.产蛋白酶毛霉的分离筛选及发酵豆粕产大豆肽的初步研究[J].现代食品科技,2010,26(9):956-961.
[9] Vaseghi Z,Najafpour G D.An investigation on lipase production from soybean meal and sugarcane bagasse in solid state fermentation using Rhizopus oryzae[J].International Journal of Engineering,2014,27(2):171-176.
[10] GB/T 6432-94.饲料中粗蛋白测定方法[S].
[11] GB/T 5009.44-2003.肉与肉制品卫生标准的分析方法[S].
[12] Re R,Pellergini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay [J].Free Radical Biology and Medicine,1999,26(9-10):1 231-1 237.
[13] ZHU Y P,FAN J F,CHENG Y Q,et al.Improvement of the antioxidant activity of Chinese traditional fermented okara(Meitauza)using Bacillus subtilis B2 [J].Food Control,2008,19(7):654-661.
[14] XIE Zheng-jun,HUANG Jun-rong,XU Xue-ming,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate [J].Food Chemistry,2008,111(2):370-376.
