稀碱法预处理橡子壳制备生物乙醇*
2014-12-25杨静蒋剑春张宁苗春存卫民赵剑
杨静,蒋剑春,张宁,苗春存,卫民,赵剑
(中国林业科学研究院林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局林产化学工程重点开放性实验室;江苏省生物质能源与材料重点实验室,江苏南京,210042)
利用农林废弃物作为原料生产乙醇,实现生物质资源的高值化利用,有利于改善生态环境,符合循环经济发展的要求。橡子是壳斗科麻栎属和常绿槠栲类野生植物橡树的果实,有8个属900余个种,分布于温带、亚热带和热带,我国占6个属301个种[1],每年可产60~70万t橡子[2]。橡子仁既可作为动物饲料、工业原料,也可用来加工保健食品,以橡实淀粉为原料生产生物燃料酒精也是一条较好的利用途径,成为目前研究的热点[3]。由此产生的橡子壳产量大、来源广、价格低,尚未得到很好的利用。
天然纤维素类物质含有木质素、纤维素和半纤维素,纤维素的有效水解受木质素的空间障碍和纤维素本身高结晶度和聚合度的阻碍,因此,欲水解纤维素必须对原料进行预处理。常用的预处理的方法主要有物理法、化学法、生物法和联合预处理法等[4]。碱法预处理可以破坏木质素和半纤维素之间的化学键,具有较强的脱木质素能力,较酸法而言较为温和,处理过程中糖的损失较少,最终预处理效果较好[5]。稀碱处理后,纤维质材料膨胀,内部表面积增大,聚合度降低,结晶度下降,从而提高水解效率[6]。本研究以林业废弃物橡子壳为原料,考察稀碱法预处理对其酶水解效果的影响,期望得到低成本、高利用率且易于工业化的纤维素糖化工艺,为橡实资源的规模化开发以及在液体燃料生产中的应用提供有价值的参考。
1 实验材料和方法
1.1 材料
橡子采自安徽滁州,风干后脱壳,将橡子壳于105℃烘干,用粉碎机粉碎过筛得0.25~0.3 mm的橡子壳粉备用。
1.2 预处理
采用浓度分别为0.75%、1.0%和2%(w/v)的NaOH处理橡子壳,固液比1∶10(g∶mL),分别在60℃水浴锅和高压蒸汽灭菌锅中121℃(0.15 MPa)处理30、60和90 min。处理结束后,用蒸馏水将原料洗至中性,过滤,所得部分固体预处理原料于-20℃保存待酶水解,取部分烘干进行成分分析并计算固体回收率(yrec)。
1.3 成分分析
纤维素、半纤维素和木质素分析参照NREL[8]法测定,灰分的测定根据GB12086-1989进行。木质素绝对降解率的计算公式如下:
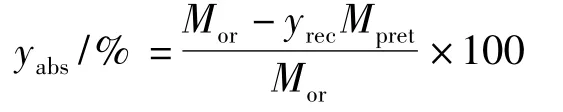
式中:yabs-木质素绝对降解率,%;yrec-原料固体回收率,%;Mor-未处理原料中木质素干重,g;Mpret-预处理后原料中木质素干重,g。
1.4 酶水解
称取一定量的样品,加入0.1 mol/L,pH 4.8的柠檬酸缓冲液,固液比为5%(w/v),于50℃水浴中预热20 min,每克原料加入20 FPU纤维素酶(阿拉丁,上海,酶活为 19.6 FPU/g)、20 CBU β-葡萄糖苷酶(Sigma-Aldrich,美国,酶活为9.3 CBU/mg)和1.5 FXU木聚糖酶,于50℃,150 r/min水解72 h。结束后,立即用冰块终止酶水解,过滤,进行高效液相色谱分析。
1.5 发酵
所用菌种为嗜单宁管囊酵母(Pachysolen tannophilus)1770,购自中国工业微生物菌种保藏中心。
斜面培养基:麦芽浸膏3 g/L,葡萄糖10 g/L,酵母浸膏3 g/L,蛋白胨5 g/L,琼脂20 g/L。121℃灭菌20 min。
种子培养基:马铃薯200 g/L,葡萄糖20 g/L,121℃灭菌30 min。
发酵培养基:橡子壳水解液,酵母浸膏2 g/L,(NH4)2SO410 g/L,KH2PO42 g/L,MgSO42 g/L,初始pH 5.0,121℃灭菌20 min。
将斜面培养基上的酵母菌接种到种子培养基,48 h后作为菌种以8%的接种量(v/v)接种于发酵培养液中。于32℃,转速120 r/min,发酵72 h,每12 h取样,利用HPLC测定葡萄糖浓度和乙醇浓度。色谱条件为:色谱柱Aminex HPX-87H ion Exclusion Column(300 mm×7.8 mm),美国伯乐;流动相为5 mmol/L H2SO4,流速0.6 mL/min;柱温55℃,示差折光检测器温度35℃;进样量10 μL。
2 结果与讨论
2.1 成分分析
对橡子壳进行成分分析并与其他木质素原料进行对比,结果见表1。橡子壳中纤维素的含量达到56.8%,和高粱杆的组成类似,低于麦草和其他硬/软木[8]。木质素的含量较高,远高于高粱杆、麦草等木质纤维素原料,但是较 Yalçın[8]等和 Yeᶊim[9]等报道的榛子壳含量低。橡子壳纤维素含量居中,高于高粱杆和榛子壳,在文献报道的麦草的纤维素含量范围内,可以加以利用。

表1 橡子壳化学组成以及与其他木质纤维素原料的对比(干重)Table 1 Chemical composition comparison among oak shell and other lignocellulosic biomass(dry weight)
2.2 固体回收率
在处理过程中,预处理液分别呈现红褐色到黑色,随着处理条件加剧颜色越深(C1:0.75%NaOH/30 min/60℃;C2:1%NaOH/60 min/60℃;C3:0.75%NaOH/30 min/121℃;C4:2%NaOH/30 min/121℃;C5:2%NaOH/60 min/121℃)。经过碱处理后,橡子壳的固体回收率在48.06%(w/w)(2%NaOH/90 min/121℃)到82.09%(0.75%NaOH/30 min/60℃)之间(图1)。碱浓度、处理时间和温度都对固体回收率有影响。其中温度的影响最大,处理时间次之,影响最小的是碱浓度。在1%NaOH/60 min/121℃的相同处理条件下,对不同原料的固体回收率进行比较发现,橡子壳为68.9%(本研究),高粱杆为48%[16],玉米秸秆为43.8%[17],棉花秆为59%[18],大麦和黑小麦秸秆分别为68.5%和71.5%[19],说明不同原料对相同条件下碱处理的效果不同。

图1 不同预处理条件下橡子壳的固体回收率Fig.1 Solid recovery rates of Oak shell at different conditions
2.3 木质素去除率
木质素是构成植物细胞壁的主要成分之一,通过与纤维素和半纤维素相连接从而限制纤维素酶到达纤维素。降低生物质原料的木质素含量有助于纤维中的无定形区及结晶区表面大量溶出,提高酶对纤维素的可及性。
木质素的去除率从一定程度上反映了稀碱预处理的效果。通过测定预处理原料中的酸不溶木质素随温度、碱液浓度以及处理时间的脱除程度来定量分析碱法处理橡子壳的效果。结果见图2。温度升高大大提高了橡子壳碱法预处理的木素去除率,即121℃(0.15 MPa)比60℃时效果要好。在121℃时,去除率为10.24%(0.75%NaOH/30 min)到39.34%(2%NaOH/60 min)。而在 60℃ 时,为 5.08%(0.75%NaOH/30 min)到23.35%(2%NaOH/90 min)。Mcintosh等[16]报道,在60℃和121 ℃时,随着处理时间的增加,高粱秆的木素去除率均增加。但是,在本研究中,处理时间的增加并不总是能提高去除率。相反,最大去除率出现在60 min/121℃处,在此条件下,延长处理时间(90 min)并没有提高去除率。结合图1,可能的原因是,处理时间延长,碳水化合物降解更多,导致木质素的比例增加。根据固体回收率和降解前后木质素含量计算得出木质素绝对降解率,2%NaOH/60 min/121℃时为 61.82%,2%NaOH/90 min/121℃时为63.12%,后者的去除率相对较高。

图2 不同预处理条件对橡子壳中木质素去除率的影响Fig.2 The effect of different conditions on deligninfication of shell
在所有的处理条件下,碱液浓度对木质素去除率的影响均较明显,高浓度碱液有利于木质素的去除。Varga等[17]利用10%NaOH处理玉米秸秆,高压蒸汽灭菌锅处理1 h,木质素去除率达到95%,但是,可回收碳水化合物量急剧下降。木质素的脱除效果与原料本身结构有关(如,草类、软木和硬木),也受收获时间、收获方法、干燥程度和储存条件的影响[20]。
2.4 酶水解
考察了反应温度(60℃,121℃/0.15 MPa)、反应时间(30、60和90 min)和碱浓度(0.75%,1%和2%,w/v)对酶水解效果的影响。每克预处理原料的酶用量为20 FPU纤维素酶、20 CBU β-葡萄糖苷酶和1.5 FXU木聚糖酶。酶解结束后利用HPLC测定水解液中的单糖含量,结果见图3。高温处理酶水解的效果较好。在121℃时,碱液浓度从0.75%提高到2%,大大增加了单糖得率。最高单糖得率为606.36 mg/g(549 mg葡萄糖、38.2 mg木糖以及19.16 mg阿拉伯糖)出现在2%NaOH/60 min/121℃处。而在同样条件下将处理时间延长到90 min,糖含量不再增加。其中最主要的原因可能是在剧烈条件下,纤维素的损失率较高。该温度和碱液浓度对酶水解效果的影响趋势与Mcintosh等[16]的报道类似。
在60℃时,随着碱液浓度和处理时间的增加,糖释放量增加。最大单糖得率为377.4 mg/g出现在2%NaOH/90 min处。当处理时间从30 min增加到60 min时,单糖得率增幅不大,但是延长至90 min时,在2%的碱液浓度下,单糖得率大幅增加,并且该数值高于0.75%/90 min/121℃和1%/90 min/121℃组合下的得率,并与0.75%/30 min/121℃组的得率接近。这说明在较温和的碱法处理条件下,最优温度和碱液浓度的数值可能会更低,从而降低能源消耗和成本。

图3 不同预处理条件对单糖生成量的影响Fig.3 The effect of different pretreatment conditions on monomeric sugar release
2.5 发酵
对采用最优预处理条件处理后的橡子壳(2%NaOH/60 min/121℃)进行酶水解,结束后,收集水解液,液相色谱测定水解液中葡萄糖含量为27.45 g/L,调节pH至5.0接种嗜单宁管囊酵母进行发酵,结果见图4。发酵48 h后,乙醇含量达到稳定,葡萄糖利用率达到96.7%。60 h后,经测定发酵液中乙醇浓度最大为11.96 g/L,为理论产率的85.4%,获得了较好的效果。
2.6 物料衡算(图5)
经2%NaOH,在121℃/15 MPa处理60 min所得的预处理原料的酶水解效果最好。经过预处理,有31%的固体损失,其中包括部分糖。经20 FPU纤维素酶、20 CBUβ-葡萄糖苷酶和1.5 FXU木聚糖酶的酶水解(固液比5%,w/v,50℃水解48 h),每克未处理原料得到378.8 mg葡萄糖、26.36 mg木糖和13.22 mg阿拉伯糖,经过48 h的嗜单宁管囊酵母发酵,乙醇生成量为165.05 mg,为理论产率的85.4%。

图4 发酵过程中葡萄糖消耗和乙醇生成图Fig.4 Glucose consumption and ethanol during fermentation
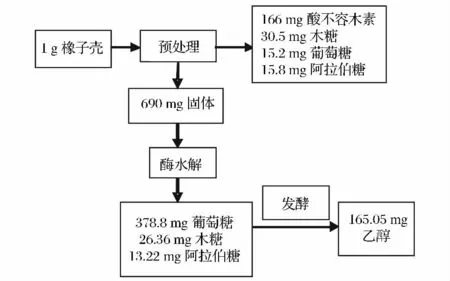
图5 橡子壳预处理、酶水解以及发酵物料衡算Fig.5 Mass balance of pretreatment,enzymatic hydrolysis and fermentation for oak shells
3 结论
本文以橡子壳为原料考察了稀碱法预处理对其酶水解和发酵制备乙醇的影响。结果发现,碱法预处理可以获得高糖回收率并大大增加了酶水解效果。最优处理条件为2%NaOH,121℃(0.15 MPa)处理60 min,在此条件经酶水解的单糖得率达到606.36 mg/g(处理原料),单糖转化率达到78.8%。经过嗜单宁管囊酵母发酵,乙醇浓度达到11.96 g/L,为理论产率的85.4%,达到了较好的效果,为橡子壳的回收利用提供了一条新的途径。
[1] 魏练平,毛非鸿,蒋立科,等.橡子营养成分及其加工利用的初步研究[J].安徽农学通报,2007,13(9):137-138.
[2] 谢碧霞,谢涛.我国橡实资源的开发利用[J].中南林学院学报,2002,22(3):37-41.
[3] 李安平,谢碧霞,田玉峰,等.橡实淀粉生料发酵生产燃料酒精工艺研究[J].中国粮油学报,2011,26(3):91-95.
[4] Gglbe M,Zacchi G.Pretreatment of lignocellulosic materials for efficient bioethanol production[J].Adv Biochemistry Engineering/Biotechnology,2007,108:41-65.
[5] 崔美,黄仁亮,苏荣欣,等.木质纤维素新型预处理与顽抗特性[J].化工学报,2012,63(3):677-687.
[6] SUN Ye,CHENG Jia-yang.Hydrolysis of lignocellulosic materials for ethanol production:a review [J].Bioresour Technol,2002,83(1):1-11.
[7] National Renewable Energy Laboratory(NREL).Biomass Analysis Technology Team Laboratory Analysis Procedure[C].USA:Golden,CO,2008.
[8] Çöpür Y,Tozluoglu A,Özkan M.Evaluating pretreatment techniques for converting hazelnut husks to bioethanol[J].Bioresour Technol,2013,129:182-190.
[9] Yeʂim A,Nurdan E.Effects of pretreatment methods for hazelnut shell hydrolysate fermentation with Pichia stipitis to ethanol [J].Bioresour Technol,2010,101(22):8 664-8 670.
[10] XU Feng,SHI Yong-Cheng,WU Xiao-rong,et al.Sulfuric acid pretreatment and enzymatic hydrolysis of photoperiod sensitive sorghum for ethanol production[J].Bioprocess Biosyst Eng,2011,34(4):485-492.
[11] Vancov T,Mclntosh S.Mild acid pretreatment and enzyme saccharification of sorghum bicolor straw [J].Applied Energy,2012,92:421-428.
[12] ZHU S,WU Y,YU Z,et al.Production of ethanol from microwave-assisted alkali pretreated wheat straw[J].Process Biochem,2006,41(4):869-873.
[13] 孔德城,郑璞,董晋军,等.碱预处理秸秆同步糖化发酵生产丁二酸[J].食品与发酵工业,2010,36(5):86-89.
[14] SUN F,CHEN H.Enhanced enzymatic hydrolysis of wheat straw by aqueous glycerol pretreatment[J].Bioresour Technol,2008,99(14):6 156-6 161.
[15] Reach for unbleached foundation,Clean Air Clean Water Pulp Info Centre,Components of wood[EB/OL].http://www.rfu.org/cacw/basic3KraftPulp.htm.
[16] Mcintosh S,Vancov T.Enhanced enzyme saccharification of Sorghum bicolor straw using dilute alkali pretreatment[J].Bioresour Technol,2010,101(17):6 718-6 727.
[17] Varga E,Szengyel Z,Réczey K.Chemical pretreatments of corn stover for enhancing enzymatic digestibility[J].Appl Biochem Biotechnol,2002,98-100(1-9):73-87.
[18] Silverstein R A,Chen Y,Sharma-Shivappa R R,et al.A comparison of chemical pretreatment methods for improving saccharification of cotton stalks[J].Bioresour Technol,2007,98(16):3 000-3 011.
[19] CHEN Y,Sharma-Shivappa R,Keshwani D,et al.Potential of agricultural residues and hay for bioethanol production[J].Appl Biochem Biotechnol,2007,142(3):276-290.
[20] LI CL,Bernhard K,Chithra M,et al.Comparison of dilute acid and ionic liquid pretreatment of switchgrass:Biomass recalcitrance,delignification and enzymatic saccharification[J].Bioresour Technol,2010,101(13):4 900-4 906.
